爪哇曲殼藻亞縊變種胞外多聚物提取方法及其化學組成研究
黃世玉(集美大學水產學院,農業部東海海水健康養殖重點實驗室,集美 361021)
爪哇曲殼藻亞縊變種胞外多聚物提取方法及其化學組成研究
黃世玉
(集美大學水產學院,農業部東海海水健康養殖重點實驗室,集美 361021)
摘要:優化了爪哇曲殼藻亞縊變種(Achnanthes javanica var.subconstricta)胞外多聚物提取方法并分析了其化學組成。結果表明,使用0.3 mol/L的碳酸氫鈉提取時間為2.5—3h可充分提取非水溶性胞外多聚物而不會破碎細胞,是最優的提取方法。爪哇曲殼藻亞縊變種胞外多聚物多糖占80%以上,蛋白質占16%—19%,不含脂類。水溶性多糖的單糖組分摩爾比為:巖藻糖∶半乳糖∶葡萄糖∶甘露糖∶木糖∶鼠李糖=2.47∶2.13∶1∶0.69∶0.57∶0.46,而非水溶性多糖的單糖組分摩爾比為:半乳糖∶巖藻糖∶木糖∶葡萄糖∶甘露糖∶鼠李糖=3.56∶2.73∶1.30∶1∶0.67∶0.57。
關鍵詞:爪哇曲殼藻亞縊變種; 胞外多聚物; 提取方法; 化學組成
硅藻胞外多聚物(Extracellular Polymeric Substances,EPSs)是硅藻細胞分泌到胞外的一類黏性物質。這些胞外多聚物在硅藻運動、附著、棲息地的穩定、集群和抗干燥等方面都起著非常重要的作用,是硅藻生命活動過程中不可或缺的一部分[1]。此外,硅藻胞外多聚物在海洋生態系統的物質循環和能量傳遞中也起著極其重要的作用[2]。目前,在胞外多聚物的形態及細微結構、合成分泌機制、功能及生態作用等方面都取得了豐碩的成果[1,3]。
胞外多聚物的有效提取方法和化學成分分析是理解其生態作用的基礎[4]。但附著硅藻胞外多聚物提取方法及其化學組成方面的報道較少,迄今尚未發現提取胞外多聚物通用的提取方法[5]。目前文獻報道的提取方法可以分為化學方法和物理方法兩類。有些報道將兩者結合起來,使用戊二醛或甲醛作為固定劑來保護細胞,防止提取過程對細胞的損傷[6—8]。但是固定劑影響EPSs的測定,并且會與EPSs發生反應改變其理化性質[9]。
爪哇曲殼藻亞縊變種(A.javanica var.subconstricta)是我國海域常見的一種底棲硅藻[9]。本文建立了爪哇曲殼藻亞縊變種(A.javanica var.subconstricta)胞外多聚物的提取方法,研究了其胞外多聚物的化學組成,以期為硅藻胞外多聚物的提取和化學組成研究提供借鑒和參考。
1 材料與方法
1.1 藻種及培養條件
實驗用藻種爪哇曲殼藻亞縊變種篩選自廈門附近海域的大型海藻上。經3—5次純化后,并經抗生素處理,得到無菌純藻種用于實驗。爪哇曲殼藻亞縊變種的大量培養采用20 L的方形玻璃缸,所用培養基為f/2培養基。培養體積5 L,溫度23°C,光照強度為5000 lx。
1.2 提取時間對非水溶性胞外多聚物提取的影響
爪哇曲殼藻亞縊變種培養5d后,倒去上層培養液,附著藻細胞用消毒海水清洗2—3次,用毛筆輕輕將藻類刮下并用離心的方法收集藻細胞(轉速,8000 r/m,5min,下同),將藻細胞用蒸餾水清洗,離心收集沉淀物(重復3次)。在沉淀物中加入90%的乙醇抽提10min,離心收集沉淀物(反復5次),將所得沉淀物用蒸餾水再沖洗,離心后收集沉淀物(反復3次)。在所得沉淀物中加入40 mL蒸餾水在90°C下水浴1h,離心,所得上清液即為WS(水溶性胞外多聚物)。
離心后的沉淀物中加入0.3 mol/L碳酸氫鈉溶液40 mL置于95°C水浴提取非水溶性胞外多聚物(WI)。在水浴0.5h、1.0h、1.5h、2.0h、2.5h、3.0h、3.5h、4.0h和4.5h時分別從提取液中吸出1 mL均勻混合液,離心所得上清液即為WI用于DNA、總碳水化合物以及蛋白質含量的測定。同時另取0.1 mL在ZEISS Axioskop型表面熒光顯微鏡下觀察提取過程中細胞及胞外多聚物形態的變化。
1.3 碳酸氫鈉濃度對WI提取的影響
用0.1、0.3、0.5、0.8、1、1.2 mol/L濃度的碳酸氫鈉溶液提取WI,提取時間2.5h,測定各濃度組的DNA、總碳水化合物和蛋白質含量。
1.4 參數的測定:
DNA的測定:將待測物在分光光度計下測量其在260和280nm下的光密度值,采用下列公式計算DNA的濃度:
DNA濃度=A260×稀釋倍數×50(μg/mL)
A260相當于50 μg/mL DNA或40 μg/mL RNA
糖類測定采用硫酸-苯酚法[10],蛋白質的測定采用Lowry等[11]的方法。
1.5 胞外多聚物組分的測定
胞外多聚物組分的測定采用高效液相色譜法,用蒸發光散射檢測器檢測。具體方法如下:將兩種組分(WS、WI)用旋轉蒸發儀濃縮至4 mL左右后放入蒸餾水中透析。透析時將樣品裝入透析袋,將兩端扎緊密封,吊置于裝有蒸餾水的大燒杯中(蒸餾水淹沒透析袋),置于4℃冰箱透析24h,期間換水一次。透析完畢后繼續濃縮至近干。將濃縮后的WS與WI消化,用氮氣吹干后加入1 mL三氟乙酸(4 mol/L),充氮氣加蓋密封,100°C分解5h,用氮氣吹干后加蒸餾水1 mL,最后用高效液相色譜儀測定WS與WI的糖類組分。
2 結果
2.1 提取時間對胞外多聚物的影響
圖 1為提取時間對胞外多聚物提取的影響。結果表明,在0—2.5h提取時間內,糖類和蛋白質的含量逐漸增加,而DNA含量比較穩定。當提取時間為2.5—3h時,提取液中糖類和蛋白質含量增加的趨勢已不明顯,但當提取時間超過3h時,蛋白質含量明顯增加,DNA含量也有較大增加,但多糖含量則幾乎沒有變化。光鏡下觀察結果也表明(圖 2),隨著提取時間的推移,胞外多聚物的形狀逐漸變得模糊,輪廓也逐漸消失,當達到3h時,胞外多聚物基本觀察不到,隨著提取時間的進一步增加,部分藻細胞破碎。因而為了盡可能減少藻細胞的破碎程度,選擇碳酸氫鈉提取時間為2.5—3h。
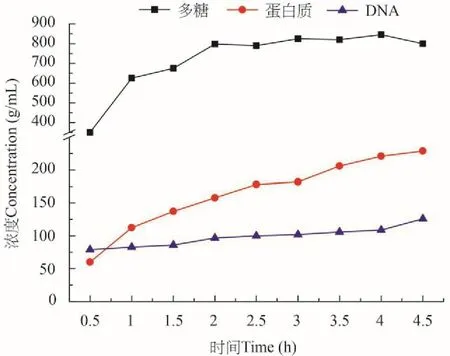
圖 1 不同提取時間提取液中DNA、蛋白質和多糖的變化
2.2 碳酸氫鈉濃度對胞外多聚物提取的影響
圖 3為碳酸氫鈉濃度對硅藻胞外多聚物提取的影響。結果表明,在0.1—0.3 mol/L濃度范圍內,糖類和蛋白質含量都有顯著增加,但DNA的含量則變化不大。隨著碳酸氫鈉濃度的進一步增加,達0.5—0.8 mol/L時,提取液中糖類和蛋白質含量增加的趨勢已不明顯,而DNA含量則有明顯增加,表明細胞發生了破碎。因而為了盡可能減少細胞破碎,選擇碳酸氫鈉提取濃度為0.3 mol/L。
2.3 胞外多聚物的化學組成
爪哇曲殼藻亞縊變種胞外多聚物水溶性和水不溶性組分的主要成分為多糖類,達總量的80%以上,此外還含有一定量的蛋白質(16%—19%左右),但不含脂類。圖 4為爪哇曲殼藻亞縊變種胞外多聚物水溶性(A)和非水溶性(B)組分的高效液相色譜圖。對照單糖標準品色譜圖可知,爪哇曲殼藻亞縊變種胞外多聚物的單糖組分主要為巖藻糖、半乳糖,此外還含有少量的木糖、葡萄糖、甘露糖和鼠李糖等。經引入相對校正因子并采用面積歸一法計算其摩爾比表明,水溶性(WS)組分中巖藻糖的含量最高,單糖的摩爾比為:巖藻糖∶半乳糖∶葡萄糖∶甘露糖∶木糖∶鼠李糖=2.47∶2.13∶1∶0.69∶0.57∶0.46; 而非水溶性(WI)組分中半乳糖的含量最高,單糖的摩爾比為:半乳糖∶巖藻糖∶木糖∶葡萄糖∶甘露糖∶鼠李糖=3.56∶2.73∶1.30∶1∶0.67∶0.57。
3 討論
EPSs在底棲硅藻和細菌的相互作用中具有重要意義,并且在維持潮間帶泥灘附著生物穩定性發揮了關鍵作用[12]。目前開發的EPSs提取方法雖然簡單方便,但是一般效率都很低,缺少對提取方法的優化。

圖 2 不同提取時間藻細胞和胞外多聚物形態的變化
鹽溶液可以有效地提取EPSs。0.5 mol/L碳酸氫鈉可以有效提取長柄曲殼藻(Achnathes longipes)和咖啡形雙眉藻(Amphora coffeaeformis)的EPSs而不破壞細胞[1 3]。磷酸二氫鉀也可以用來提取EPSs[14]。甚至人工海水也具有良好的提取EPSs效果。其效果甚至媲美離子交換樹脂,對細胞的損傷極低[5]。鹽溶液提取法的效果依賴其濃度和處理時間[14]。經過優化后可以作為一種提取EPSs的最優方法。Takahashi[5]比較了6種提取EPSs的方法,認為用50%的人工海水處理1h是一種有效提取EPSs的方法。該方法處理后,硅藻細胞皺縮程度與對照類似,內部損傷很低; 并且碳水化合物和蛋白的得率與離子交換樹脂類似。本研究中,碳酸氫鈉法提取胞外多聚物的最優濃度是0.3 mol/L,最佳時間為2.5—3h。在這種條件下,細胞能夠保持完整的形態,其EPSs能夠被有效提取。
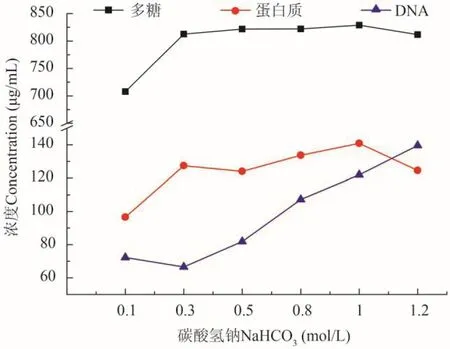
圖 3 不同濃度碳酸氫鈉提取液中DNA、蛋白質和多糖的變化
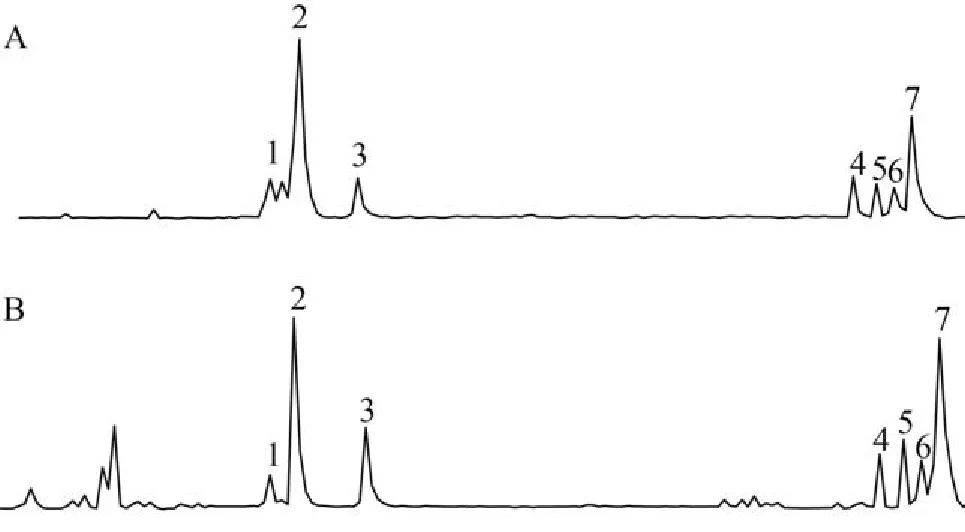
圖 4 爪哇曲殼藻亞縊變種水溶性(A)和非水溶性(B)胞外多聚物高效液相色譜圖
多糖的生理活性與其結構有密切關系,但其分離純化和鑒定存在一定的困難,藻類多糖分離純化的方法不同則得到的組分可能不一樣[15]。國外大多用核磁共振技術來解決多糖的問題,盡管可以減少多糖樣品的破壞,但由于多糖分子量、黏度都很大,用核磁共振檢測多糖樣品并不理想。本研究用90%乙醇多次抽提,能夠有效降低甘油等脂溶性成分,從而有利于核磁共振檢測。
色譜法是分析海洋生物多糖基本結構的重要方法,一般是加酸將多糖分解后進行單糖分析[16]。硅藻胞外多聚物主要由多糖類組成[1,17],此外還包括一些含硫大分子及少量蛋白質[15],目前在胞外多聚物中尚未發現脂類物質。Wustman等[13]的研究則表明,硅藻EPSs主要由酸性多糖組成,此外還有少量的蛋白質及酚類物質。Suresh等[15]的研究表明,硅藻胞外多糖主要由葡萄糖,半乳聚糖,古洛糖,木酮糖,阿拉伯糖,巖藻糖和鼠李糖等8種單糖組成,這些組成在不同種類中有所差異。本研究結果表明,爪哇曲殼藻亞縊變種巖藻糖和半乳糖的摩爾數是最高的,而鼠李糖最低。而并基角毛藻(Chaetoceros decipiens),則是鼠李糖和巖藻糖最高,葡萄糖最低,并且在生長的不同階段其胞外多糖的單糖組成也不同[18]。這表明胞外多糖的組成不僅具有種屬差異性,而且與細胞具體狀態密切相關[1]。
盡管EPSs中的主要成分是多糖,但是蛋白也具有重要作用。其賦予了EPSs特殊性能,例如能夠形成膠狀結構、保留間隙水、調節黏附表面和保護細胞免受環境有毒影響等[4]。EPSs中蛋白和多糖的比例在正常情況下一般保持穩定。但是硅藻細胞面臨環境脅迫時其蛋白的分泌量會發生相應變化。而在提取過程中,蛋白質比例升高主要原因是提取導致細胞裂解內部蛋白質釋放。
EPSs中出現DNA一般認為是細胞裂解所致,或是細胞膜的通透性增大的原因。本研究的結果也表明DNA含量與細胞裂解存在正相關關系。DNA是指示細胞裂解程度的好指標。
本研究結果表明,爪哇曲殼藻亞縊變種胞外多聚物的最佳提取條件為:碳酸氫鈉濃度為0.3 mol/L,提取時間為2.5—3h時,在此條件下可充分提取胞外多聚物而不會破壞細胞。爪哇曲殼藻亞縊變種胞外多聚物多糖組分主要為巖藻糖和半乳糖,此外還含有少量的木糖、葡萄糖、甘露糖等。
參 考 文 獻:
[1]Steele D J,Franklin D J,Underwood G J C.Protection of cells from salinity stress by extracellular polymeric substances in diatom biofilms[J].Biofouling,2014,30(8):987—998
[2]Taylor J D,McKew B A,Kuhl A,et al.Microphytobenthic extracellular polymeric substances(EPS)in intertidal sediments fuel both generalist and specialist EPS-degrading bacteria[J].Limnology and Oceanography,2013,58(4):1463—1480
[3]Lin H,Zhang M,Wang F,et al.A critical review of extracellular polymeric substances(EPSs)in membrane bioreactors:characteristics,roles in membrane fouling and control strategies[J].Journal of Membrane Science,2014,460:110—125
[4]Salama Y,Chennaoui M,Sylla A,et al.Characterization,structure,and function of extracellular polymeric substances(EPS)of microbial biofilm in biological wastewater treatment systems:a review[J].Desalination & Water Treatment,2015:1—18
[5]Takahashi E,Ledauphin J,Goux D,et al.Optimising extraction of extracellular polymeric substances(EPS)from benthic diatoms:comparison of the efficiency of six EPS extraction methods[J].Marine and Freshwater Research,2009,60:1201—1210
[6]Subramanian S B,Yan S,Tyagi R D,et al.Extracellular polymeric substances(EPS)producing bacterial strains of municipal wastewater sludge:isolation,molecular identification,EPS characterization and performance for sludge settling and dewatering[J].Water Research,2010,44(44):2253—2266
[7]Lin H,Zhang M,Wang F,et al.A critical review of extracellular polymeric substances(EPSs)in membrane bioreactors:Characteristics,roles in membrane fouling and control strategies[J].Journal of Membrane Science,2014,460(9):110—125
[8]Leiyan Z,Hongqiang R,Lili D.Comparison of extracellular polymeric substances(EPS)extraction from two different activated sludges[J].Water Science & Technology,2012,66(7):1558—1564
[9]Yang J L,Wang C,Gu Z Q,et al.A review on the role of marine biofilms on larval settlement and metamorphosis of marine invertebrates[J].Marine Sciences,2012,36(8):116—121[楊金龍,王沖,顧忠旗,等.微生物膜對海洋無脊椎動物幼體附著變態的影響研究.海洋科學,2012,36(8):116—121]
[10]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28:350—356
[11]Lowry O H,RosebrotIgh N J,Farr A L,et al.Protein measurement with the Folin phenol reagent[J].The Journal of Biological Chemistry,1951,193:265—275
[12]Montanié H,Crignis M G D,Lavaud J.Viral impact on prokaryotic and microalgal activities in the microphytobenthic biofilm of an intertidal mudflat(French Atlantic Coast)[J].Frontiers in Microbiology,2015,(6):1—15
[13]Wustman B A,Gretz M R,Hoagland K D.Extracellular matrix assembly in diatoms(Bacillariophyceae).I.Amodel of adhesives based on chemical characterization and localization of polysaccharides from the marine diatom Achnanthes longipes and other diatoms[J].Plant Physiology,1997,113:1059—1069
[14]Dong D M,Kang C L,Li Z H,et al.Extarction of extracellular polymers from bioiflms in natural water by potassium Bi-phosphate solution[J].Science Technology and Engineering,2002,2(5):51—53[董得明,康春莉,李忠華,等.磷酸氫二鉀法分離自然水體中的生物膜胞外聚合物.科學技術與工程,2002,2(5):51—53]
[15]Suresh V,Senthilkumar N,Thangam R,et al.Separation,purification and preliminary characterization of sulfated polysaccharides from Sargassum plagiophyllum and its in vitro anticancer and antioxidant activity[J].Process Biochemistry,2013,48(2):364—373
[16]Urbani R,Pletikapi? G,Sist P,et al.Diatom Polysaccharides:Extracellular Production,Isolation and Molecular Characterization[M].INTECH Open Access Publisher.2012,345—370
[17]Xu L L,Zhan X R,Zeng Z W,et al.Study on preparation and chemical characterization of iron(III)- Polygonatum odoratum polysaccharides complex[J].Journal of Chinese Pharmaceutical Sciences,2012,47(5):331—334
[18]Nicolas V O,Moerdijk-Poortvliet T C W,Boschker H T S,et al.Release of dissolved carbohydrates by Emiliania huxleyi and formation of transparent exopolymer particles depend on algal life cycle and bacterial activity[J].Environmental Microbiology,2013,15(5):1514—1531
EXTRACTION METHOD AND CHEMICAL COMPOSITION OF EXTRACELLULAR POLYMERIC SUBSTANCES FROM DIATOM ACHNANTHES JAVANICA VAR.SUBCONSTRICTA
HUANG Shi-Yu
(Key Laboratory of Healthy Mariculture for the East China Sea,Ministry of Agriculture,College of Auaculture,Jimei University,Jimei 361021,China)
Abstract:The current study reported the method to extract extracellular polymeric substances(EPSs)from Achnanthes javanica var.subconstricta and analyzed compositions of the EPSs.The results showed that the optimal extraction condition was 0.3 mol/L NaHCO3with 2.5—3h extraction time,which produced little lysis.Polysaccharide is the main component of EPSs that contributed more than 80% of EPSs,while protein contributed 16%—19% of EPSs.There is no lipid in the EPSs.The monosaccharide composition of flucose,galactose,glucose,mannose,xylose,and rhamnose in water-soluble polysaccharide is 2.47∶2.13∶1∶0.69∶0.57∶0.46(molar ratio).The monosaccharide composition of galactose,flucose,xylose,glucose,mannose,and rhamnose in non-water-soluble polysaccharide is 3.56∶2.73∶1.30∶1∶0.67∶0.57.
Key words:Achnanthes javanica var.subconstricta; Extracellular polymeric substances; Extraction method; Chemical compositions
中圖分類號:Q942
文獻標識碼:A
文章編號:1000-3207(2016)03-0589-05
doi:10.7541/2016.79
收稿日期:2015-10-19;
修訂日期:2016-02-17
基金項目:國家自然科學基金(39900020)資助[Supported by the National Natural Science Foundation of China(39900020)]
通信作者:黃世玉(1964—),男,福建南平人; 副教授,學士; 主要從事水產養殖與微藻生理生態研究。E-mail:hsy@jmu.edu.cn

