免疫刺激誘導草魚腫瘤壞死因子TNF-α的體外表達特征研究
盧翠玉李 炎劉慶慧呂利群(.上海海洋大學水產與生命學院,農業部淡水種質資源重點實驗室,上海 0306; .中國水產科學研究院黃海水產研究所,青島 6607)
免疫刺激誘導草魚腫瘤壞死因子TNF-α的體外表達特征研究
盧翠玉1,2李 炎1劉慶慧2呂利群1
(1.上海海洋大學水產與生命學院,農業部淡水種質資源重點實驗室,上海 201306; 2.中國水產科學研究院黃海水產研究所,青島 266071)
摘要:為了闡明免疫刺激誘導草魚腫瘤壞死因子TNF-α的體外表達特征,克隆了草魚TNF-α的cDNA,構建了原核表達載體pET-32-TNF-α,并在大腸桿菌DH5α中表達了His6-TNF-α。利用親和層析鎳柱純化表達重組蛋白后將其作為免疫原免疫小鼠制備了抗草魚TNF-α多克隆抗體。免疫印跡實驗顯示,制備的抗體能特異性識別細胞內源性TNF-α。在此基礎上,分別研究了GCRV(草魚呼腸孤病毒)感染、免疫刺激物Poly(I:C)及LPS處理下不同時間點草魚腎細胞CIK中TNF-α的表達情況,結果表明,TNF-α在草魚腎細胞內翻譯水平的表達量基本保持穩定。研究顯示經典的TNF信號通路激活因子不能引起CIK細胞內TNF-α蛋白水平的顯著變化。
關鍵詞:草魚呼腸孤病毒; 腫瘤壞死因子TNF-α; 原核表達; 多克隆抗體
草魚呼腸孤病毒(Grass carp reovirus,GCRV)是草魚病毒性出血病的致病病原。由GCRV引起的草魚出血病在中國、朝鮮、越南等亞洲國家危害嚴重[1—3]。在分類學上,草魚呼腸孤病毒屬于呼腸孤病毒科(Reoviridae),水生呼腸孤病毒屬(Aquareovirus),完整的病毒粒子含11條分節段雙鏈RNA基因組和雙層蛋白質衣殼。迄今,我國水產科學工作者已從發病草魚中分離出Ⅰ、Ⅱ、Ⅲ三種類型草魚呼腸孤病毒[1—4]。由于Ⅰ型呼腸孤病毒被確定并研究的時間較長,特別是其感染草魚腎細胞(CIK)能出現快速且顯著的細胞病變現象,Ⅰ型GCRV和CIK細胞成為了為體外研究魚類抗病毒先天免疫的良好細胞模型,Ⅰ型GCRV也逐漸成為了國際公認的研究水生動物呼腸孤病毒的模式毒株[5]。有研究表明,腫瘤壞死因子(Tumor necrosis factor,TNF)介導的信號通路可能與草魚呼腸孤病毒誘導的細胞凋亡相關[6]。
TNF由Carswell等發現于1975年,因其能抑制和殺傷某些腫瘤細胞,并使體內腫瘤發生出血壞死而得名。TNF按其結構分兩型:TNF-α和TNF-β,Shalaby等把由活化的單核細胞、巨噬細胞和T細胞分泌的腫瘤壞死因子命名為TNF-α[7]。目前國際上對TNF-a的研究比較深入。TNF不僅對多種腫瘤具有細胞毒作用,并參與機體炎癥與免疫應答的調節,發揮促進細胞生長、分化、凋亡等重要作用,與休克、發熱、多器官功能衰竭及惡病質等均有密切關系。在分子生物學研究進展突出,先后完成了基因定位、cDNA克隆、mRNA 表達以及分子水平的檢測,科學界對TNF作用的了解正不斷深入[7]。
目前,多種魚類的TNF-α基因已經被克隆,如牙鲆[8]、鯉、斑馬魚、虹鱒和草魚等。草魚經免疫刺激物LPS體外刺激后的早期,特別是在12h之內TNF-α轉錄水平出現明顯上調[9,10],但LPS對金頭鯛巨噬細胞的TNF-α基因的表達卻沒有刺激作用[11]。Ⅰ型GCRV感染和免疫刺激物poly(I:C)刺激CIK也能引起TNF-α轉錄水平瞬時上調。現有的魚類TNF-α應激表達研究均停留在轉錄水平上。由于TNF-α的表達不但在轉錄水平受多種轉錄因子調控[12],也存在復雜的轉錄后調控機制[13],因此轉錄水平表達量變化的研究結果不足以說明TNF-α信號通路的應激反應。不同細胞中TNF-α信號通路的反應性也不盡相同,目前也沒有足夠生物學證據表明CIK細胞適合用于研究草魚所有細胞水平的抗病毒先天免疫反應。本研究通過制備TNF-α多克隆抗體,從翻譯水平檢測在病毒感染過程中或不同免疫刺激劑作用下草魚CIK細胞內TNF-α蛋白表達量的變化,旨在厘清CIK細胞是否適合于研究TNF-α信號通路的應激反應,并為下一步探索在草魚免疫應答中特定免疫細胞類型或器官介導的TNF-α免疫應答奠定基礎。
1 材料與方法
1.1 實驗材料
I型草魚呼腸孤病毒JX-01株(由本實驗室保存);草魚腎細胞CIK(購自武漢大學國家組織培養物保藏中心),在添加10%牛胚胎血清的M199 Medium培養基(購自上海吉諾生物科技有限公司)中培養;ICR小白鼠(購自上海實驗動物研究中心),4周齡雌性小鼠; 聚肌胞甘酸,炎性刺激物脂多糖(LPS)(購自Sigma-Aldrich,St.Louis,MO,USA)。
1.2 GCRV感染草魚腎細胞
在75 cm2培養瓶中于28℃恒溫培養CIK細胞,48h后將培養至80%—90%且處于對數生長期的CIK細胞用胰酶消化,用完全培養基稀釋使細胞濃度達到1×107/mL。按每孔0.5 mL細胞懸液將CIK細胞傳至含完全培養基(2 mL/孔)的6孔板。細胞貼壁完成后吸除培養液并用感染復數為1的GCRV感染細胞,1h后吸出病毒液,用無血清培養基清洗一次,然后添加完全培養基繼續培養。分別在0、4h、8h、12h和24h用NP-40裂解液收集細胞。
1.3 聚肌胞甘酸和細菌脂多糖分別刺激CIK細胞
Poly(I:C)用無菌PBS溶解,配制成1 mg/mL儲備液,0.22 μm濾膜過濾,取適量用PBS稀釋后(終濃度5 μg/mL)刺激CIK細胞,對照組用等量PBS處理,分別在0、4h、8h、12h和24h用NP-40裂解液收集細胞。
LPS用無菌雙蒸水溶解,配制成600 μg/mL儲備液,取適量稀釋后(終濃度30 μg/mL)刺激CIK細胞,分別在0、4h、8h、12h和24h用NP-40裂解液收集細胞。
1.4 pET32a(+)-TNF-α重組質粒構建
Trizol法提取草魚草魚腎細胞中總RNA,逆轉錄獲得cDNA。根據NCBI GenBank數據庫中同源比對出保守序列設計一對引物,分別為sTNF-P32-F1 5′-CGCGGATCCATGAGAGATCATTTTTCAA AAGC-3′(下劃線序列為BamH Ⅰ酶切位點),sTNFP32-R1 5′-CCGCTCGAGGCAGAGCAAACAC CCCAAAAAAG-3′(下劃線序列為XhoⅠ酶切位點),用上述引物通過溫度梯度PCR擴增TNF-α片段。凝膠電泳獲得目的條帶后用膠回收試劑盒回收目的片段,分別用BamH Ⅰ、XhoⅠ酶切后用T4 DNA連接酶連接TNF-α目的片段和pET-32a(+),將產物轉化到大腸桿菌DH5α,篩選陽性克隆,菌液PCR鑒定為陽性的提取質粒,提取的重組質粒通過雙酶切驗證和測序(由上海生工生物工程股份有限公司完成)鑒定都正確后,命名為pET-32a(+)-TNF-α(圖 1)。活化的菌液以1∶100接種于200 mL含氨芐青霉素培養液中,37℃,180 r/min搖床5h,進行擴大培養。
1.5 pET32a(+)-TNF-α蛋白誘導表達
pET32a(+)-TNF-α蛋白誘導表達。向菌液中加入0.1 mmol/L(終濃度)IPTG,37℃,90 r/min搖床誘導6h。
1.6 pET32a(+)-TNF-α蛋白純化
收集誘導表達后的菌體,菌液離心后棄上清,每克菌體約加10 mL Wash Buffer進行懸浮。加入0.2 mg/mL溶菌酶處理,同時加入1 mmol/L(終濃度)PMSF、蛋白酶抑制劑混合物和磷酸酶抑制劑混合物,防止蛋白降解,冰浴30min后超聲破碎100次,之后12000 r/min,4℃離心20min,棄上清,沉淀用2 mol/L尿素(用PBS溶解)溶解,8500 r/min,4℃,離心15min,棄上清,繼續用4和6 mol/L尿素各洗一次,沉淀用8 mol/L的尿素溶解,8500 r/min離心25min后取上清用0.45 μm濾膜過濾,加入10 mmol/L(終濃度)DTT和1% Triton,按1∶50比例在上清中加入Resin(使用前用Wash Buffer平衡),采用親和層析柱鎳低溫結合6—12h。Wash Buffer清洗過后用Eluting Buffer洗脫。洗脫樣品分別取適量樣品,加入蛋白裂解液,SDS-PAGE檢測。
蛋白濃度檢測。用改良型Brandford法蛋白質濃度測定試劑盒測定純化后的蛋白濃度。
1.7 TNF-α多克隆抗體制備
將純化好的pET32-TNF-α蛋白調至1 mg/mL,并且分裝至1.5 mL EP管于-80℃保存。然后將其免疫4周齡雌性ICR小鼠,抗原注射量約200 μg/只/次,共免疫4只小鼠。第1次免疫為腹腔注射,將抗原蛋白與等體積FCA(弗氏完全佐劑)(Sigma公司)用1 mL無菌注射器反復吹打,充分混和均勻,直至滴入水中呈乳白色液滴且不會擴散時方可進行免疫; 14d后進行第2次腹腔注射,將抗原蛋白與等體積弗氏不完全佐劑用1 mL無菌注射器反復吹打混勻,注射; 一周之后進行第3次免疫,將純抗原pET32a(+)-TNF-α蛋白采用小鼠背部皮下多點注射的方法進行免疫,3d后斷尾取血,做Western Blot檢測; 4d后第4次加強免疫后3d,采用摘眼球取血的方式取血,將采集到的血液傾斜放在37℃恒溫培養箱中1h,4℃過夜,3000 r/min離心20min,取上清分裝多個EP管-80℃保存,用于后續實驗。
1.8 體外檢測草魚TNF-α蛋白表達特征
利用已制備抗pET32a(+)-TNF-α抗體作為一抗,Western Blot檢測病原或免疫刺激劑刺激條件下草魚腎細胞TNF-α蛋白表達量變化。同時采用抗GAPDH多抗作為一抗檢測GAPDH表達量作為對照。
提前將轉膜所用兩層海綿與六層濾紙浸泡在轉膜緩沖液中10min,并準備好割膠板,剪刀,鑷子和玻璃棒。SDS-PAGE電泳結束后,將凝膠切下來,并浸泡在轉膜緩沖液中,同時用無水甲醇中活化PVDF膜(0.45 μm)15s,再浸泡在ddH2O中2min,之后在轉膜緩沖液中浸泡1min左右,在半干轉膜設備上制作轉膜三明治,從負極到正極依次是海綿,三層濾紙,膠,PVDF膜,三層濾紙,海綿。100 V,45min轉膜后用含5%脫脂牛奶的PBST封閉3h,用相應一抗4℃過夜孵育,PBST清洗8次,每次5min,用1∶5000相應二抗37℃孵育2h后用DAB顯色試劑顯色,膜晾干后在凝膠成像儀下拍照保存結果。
2 結果
2.1 構建草魚TNF-α基因編碼區序列的原核表達質粒及His6- TNF-α的原核表達
pET32a(+)質粒是一種常用的大腸桿菌表達載體,被用于表達攜帶6個His接頭的重組蛋白。利用RT-PCR擴增技術從草魚總RNA序列中擴增得到草魚TNF-α基因的全長cDNA(圖 1),瓊脂糖凝膠電泳分析的結果顯示該片段與預計片段大小接近。利用膠DNA回收試劑盒回收產物后進行雙酶切,并選接到經相同雙酶切的載體上。連接后的DNA轉化進大腸桿菌DH5α,獲得的菌落經菌落PCR初篩后,陽性單克隆菌落送生工生物工程公司進行測序。測序結來顯示該片段為草魚TNF-α,通過NCBI BLAST比對分析,該核苷酸序列與已報道的草魚TNF-α序列一致,說明原核表達質粒構建成功。
重組表達質粒pET32a(+)-TNF-α轉化進大腸桿菌DH5α后,經IPTG誘導可以表達出目的蛋白。本研究對His6-TNF-α在細菌中的表達條件進行了優化。結果表明,使用0.1 mmol/L濃度IPTG在37℃誘導6h即可實現目的蛋白高表達(圖 1)。
2.2 His6-TNF-α的純化及其His6-TNF-α多克隆抗體制備
將His6-TNF-α重組蛋白表達后,超聲波破碎分析發現該重組蛋白主要以包涵體的形式存在,所以將其用尿素,His-link purification resin及結合液Buffer C、漂洗液Buffer D、洗脫Buffer E溶液純化蛋白,Buffer E溶液可以添加不同濃度的咪唑。為了驗證上述純化的His6-TNF-α重組蛋白是否含有組氨酸標簽,利用商品化的抗組氨酸單抗檢測,結果顯示,所純化的蛋白即為His6-TNF-α(圖 2A)。利用所純化的His6-TNF-α蛋白做免疫原,免疫小鼠制備多克隆抗體。利用純化的His6-TNF-α和草魚腎細胞樣品,檢測該多克隆抗體的特異性。免疫學檢測方法顯示,所制備的多克隆抗體既能識別原核表達的His6-TNF-α,也能識別細胞內源性的TNF-α(圖2B)。
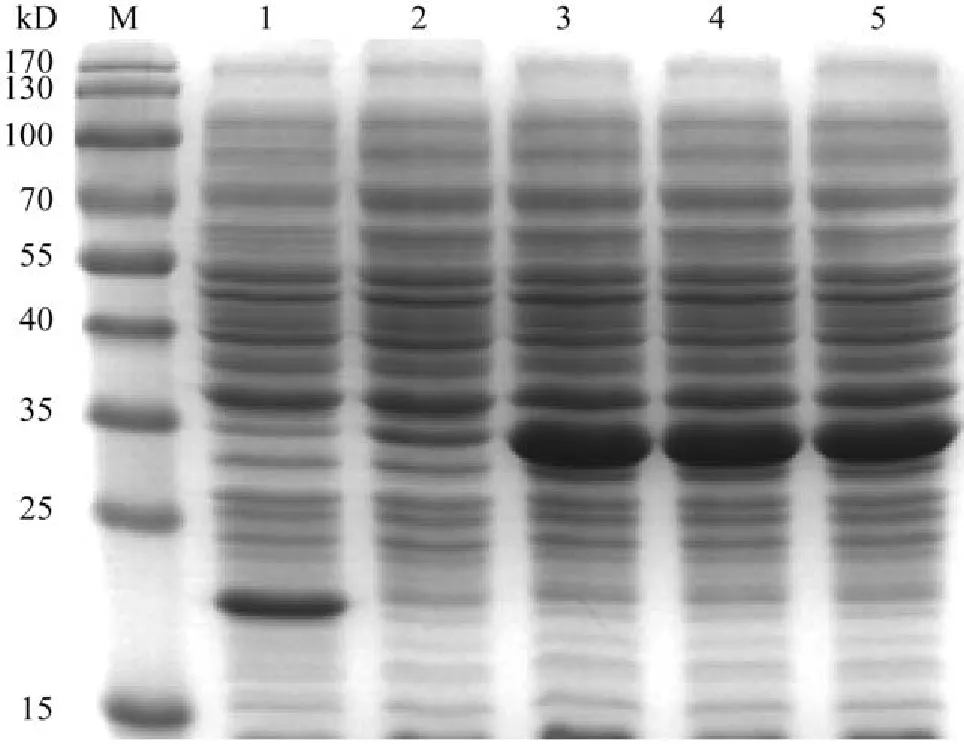
圖 1 IPTG濃度的優化
2.3 GCRV感染過程中CIK細胞TNF-α蛋白表達量的Western Blot檢測
為了闡明GCRV感染過程中細胞內TNF-α的表達特征表達,利用制備的抗體對細胞總蛋白進行免疫學檢測。利用所制備的抗TNF-α抗體檢測GCRV感染后不同時間點細胞TNF-α的表達水平。Western blot結果顯示,病毒感染過程中TNF-α表達水平維持穩定(圖 3)。
2.4 Poly(I:C)刺激CIK細胞后TNF-α的應激表達
Poly(I:C)是雙鏈RNA結構類似物,是常用的免疫刺激劑,常用于誘導抗病毒先天免疫基因。為了闡明Poly(I:C)刺激下CIK細胞內TNF-α蛋白水平的表達變化,本文利用制備的抗TNF-α多克隆抗體對poly(I:C)刺激后不同時間點的CIK細胞進行免疫學檢測。Western blot 結果顯示:CIK細胞內的TNF-α表達量基本保持穩定(圖 4)。

圖 2 純化His6- TNF-α及His6-TNF-α多克隆抗體在CIK細胞內的免疫學檢測
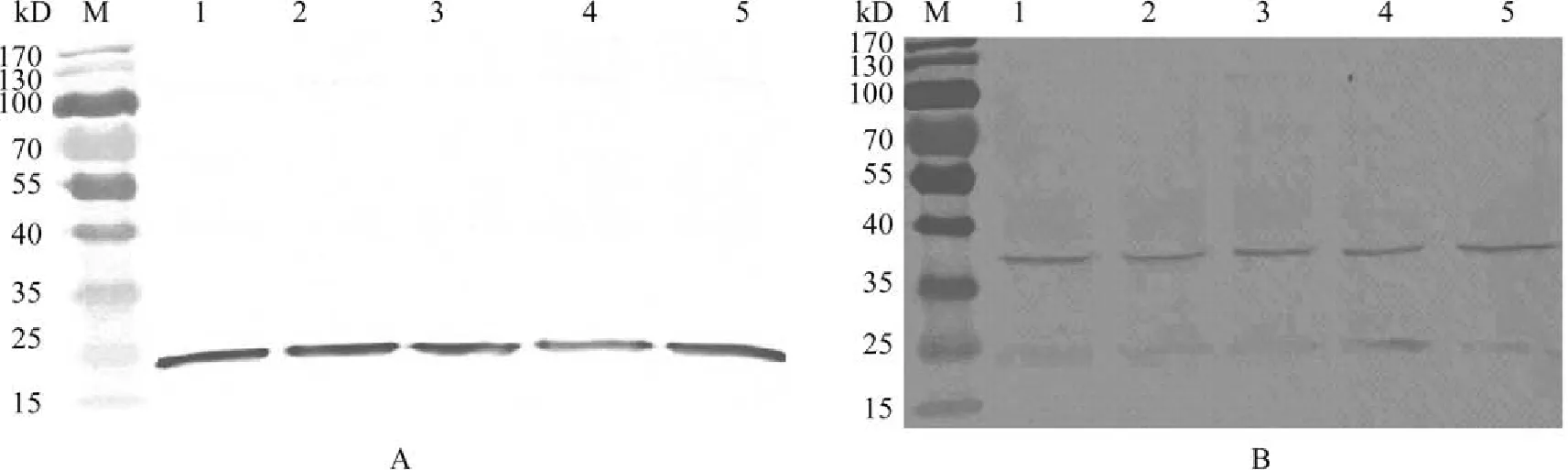
圖 3 草魚呼腸孤病毒GCRV感染過程中細胞TNF-α表達的免疫學檢測
2.5 LPS刺激CIK細胞后TNF-α的應激表達
LPS是細菌外膜成分,是常用的免疫刺激劑,常用于誘導抗細菌先天免疫基因。為了闡明LPS刺激下CIK細胞內TNF-α蛋白水平的表達變化,本文利用制備的抗TNF-α多克隆抗體對LPS刺激后不同時間點的CIK細胞進行免疫學檢測。Western blot 結果顯示:CIK細胞內的TNF-α表達量基本保持穩定(圖 5)。
3 討論
哺乳動物TNF-α作為一個在先天免疫和獲得性免疫中發揮多種功能的炎性細胞因子,通常在免疫刺激下由巨噬/單核細胞、T細胞、B細胞和NK細胞等多種細胞表達[14]。關于多種魚類TNF-α的初步研究表明其可能具有與哺乳動物同源蛋白相似的功能[15—17]。然而,限于魚類免疫細胞研究的滯后,很多相關研究只局限于魚體免疫組織[18]; 在細胞水平闡明草魚TNF-α的應激表達水平的研究迄今為止只局限于草魚CIK細胞[10]或原代頭腎總白細胞[9]。而且,在草魚TNF的研究中尚無蛋白質表達水平的研究結果。為了闡明轉錄水平的上調是否意味著TNF-α在翻譯水平的表達也會發生上調,本文制備了高特異性的抗草魚TNF-α抗體。選取PET32載體在細菌中表達TNF-α作為免疫原制備抗體是因為該載體表達真核蛋白成功的概率比較高。本文發現該載體表達的TNF-α在細菌中主要以包涵體存在。雖然在變形條件下可以利用鎳柱純化包涵體蛋白,并成功用于免疫小鼠制備抗體,本文的實驗結果只是表明原核表達的TNF-α具有免疫原性。由于變性后的TNF-α會喪失生物活性,本文并沒有進一步利用純化的重組TNF-α蛋白作為細胞因子研究其對細胞表面TNF-α受體蛋白的激活效應。

圖 4 Poly(I:C)刺激后細胞TNF-α表達的免疫學檢測

圖 5 LPS刺激后細胞TNF-α表達的免疫學檢測
本文研究了GCRV病毒感染、Poly(I:C)處理及LPS處理等3種免疫刺激下CIK細胞內源性TNF-α表達的變化情況。結果顯示,草魚腎細胞CIK細胞內源性TNF-α的表達量在刺激前后基本保持穩定。本文的研究結果表明CIK細胞可能不適合于研究草魚TNF-α信號通路,未來應該選取魚體內產生TNF-α免疫應答的特定組織和細胞來開展研究。
盡管GCRV感染或Poly(I:C)刺激均能在CIK細胞內誘導TNF-α基因在轉錄水平瞬時顯著上升[10];本研究表明轉錄水平的瞬時上升并沒有表現為翻譯水平的表達量上調。其原因可能與TNF-α的分泌表達性相關,另外也不排除草魚TNF-α基因存在復雜的轉錄后水平的調控。在哺乳動物的研究中發現,TNF-α的轉錄受多種因子調控,包括:LITAFSTAT6、NF-kB、Ets、NF-AT、AP-1和C/EBPβ等[19]; 在轉錄后水平,TNF-α的調控因子包括Mk2/ MK3[20]、Tpl2/ERK[21]等。因此,轉錄后的調控可能保證了TNF-α蛋白水平的穩定。未來,我們計劃利用本文制備的特異性抗體建立ELISA檢測方法鑒定分泌表達的草魚TNF-α,利用免疫組化技術在魚體水平鑒定應激表達TNF-α的免疫組織和細胞類型。
本文發現已有的草魚腎細胞系CIK中TNF-α表達水平在病毒等免疫刺激條件下仍然保持穩定,顯示TNF-α介導的抗病毒信號通路有可能沒有激活,這可能與該細胞對病毒的敏感性相關[5]。鑒定合適的TNF-α誘導反應性好的免疫類型細胞將有助于闡明TNF-α在蛋白水平的表達特征將有助于理解TNF-α信號通路與病原感染的相互關系,厘清TNF-α信號通路在抗病方面的作用機制。
參 考 文 獻:
[1]He Y,Jiang Y,Lu L.Serodiagnosis of grass carp reovirus infection in grass carp Ctenopharyngodon idyll by a novel Western blot technique[J].Journal of Virological Method,2013,194(1—2):14—20
[2]Zeng W W,Wang Q,Liu Y K,et al.Isolation and identification of new GCRV strain and primary study on its immunogenicity[J].Act Hydrobiologica Sinica,2011,35(5):790—795[曾偉偉,王慶,劉永奎,等.一株草魚呼腸孤病毒弱毒株的分離、鑒定及免疫原性初步分析.水生生物學報,2011,35(5):790—795]
[3]Pei C,Ke F,Chen Z Y,et al.Complete genome sequence and comparative analysis of grass carp reovirus strain 109(GCReV-109)with other grass carp reovirus strains reveals no significant correlation with regional distribution[J].Archives of Virology,2014,159(9):2435—2440
[4]Liang H R,Li Y G,Zeng W W,et al.Pathogenicity and tissue distribution of grass carp reovirus after intraperitoneal administration[J].Virology Journal,2014,11:1998—1998
[5]Guo S,Li J L,Lü L Q.Molecular pathogenesis of grass carp reovirus and novel antiviral strategies[J].Fishery Modernization,2010,37(1):37—42[郭帥,李家樂,呂利群.草魚呼腸孤病毒的致病機制及抗病毒新對策.漁業現代化,2010,37(1):37—42]
[6]Li Y,Zang Y,Wang T,et al.Proteomic identification and characterization of Ctenopharyngodon idella tumor necrosis factor receptor-associated protein 1(CiTrap1):An anti-apoptosis factor upregulated by grass carp reovirus infection[J].Fish & Shellfish Immunology,2015,43(2):449—459
[7]Caminero A,Comabella M,Montalban X.Tumor necrosis factor alpha(TNF-α),anti-TNF-α and demyelination revisited:an ongoing story[J].Journal of Neuroimmunology,2011,234(1—2):1—6
[8]Hirono I,Nam B H,Kurobe T,et al.Molecular cloning,characterization,expression of TNF cDNA and gene from Japanese flounder Paralychthys olivaceus[J].Journal of Immunology,2000,165(8):4423—4427
[9]Zhang A Y,Chen D Y,He W,et al.Functional characterization of TNF-α in grass carp head kidney leukocytes:induction and involvement in the regulation of NF-κB signaling[J].Fish & Shellfish Immunology,2012,33(5):1123—1132
[10]Wang H,Shen X,Xu D,et al.Lipopolysaccharide-induced TNF-ɑ factor in grass carp(Ctenopharyngodon idella):Evidence for its involvement in antiviral innate immunity[J].Fish & Shellfish Immunology,2013,34(2):538—545
[11]Qiu L H,Zhang H H,Wu J F.TNFαand receptors in fish-A review[J].Journal of Fishery Sciences of China,2004,11(5):482—487[邱麗華,張漢華,吳進鋒.魚類腫瘤壞死因子基因和受體的研究進展.中國水產科學,2004,11(5):482—487]
[12]Saha R N,Liu X,Pahan K.Up-regulation of BDNF in astrocytes by TNF-alpha:a case for the neuroprotective role of cytokine[J].Journal of Neuroimmune Pharmacology,2006,1(3):212—222
[13]Brenner D,Blaser H,Mak T W.Regulationof tumour necrosis factor signaling:live or let die[J].Nature Reviews Immunology,2015,15(6):362—374
[14]Tracey K J,Cerami A.Tumor necrosis factor,other cytokines and disease[J].Annual Review of Cell Biology,1993,9(1):317—343
[15]Saeij J P,de Dries B J,Wiegertjes G F.The immune response of carp to Trypanoplasma borreli:kinetics of immune gene expression and polyclonal lymphocyte activation[J].Developmental and Comparative Immunology,2003,27(10):859—874
[16]Grayfer L,Belosevic M.Molecular characterization,expression and functional analysis of goldfish(Carassius aurutus L.)interferon gamma[J].Developmental and Comparative Immunology,2009,33(2):235—246
[17]Wang W L,Liu W,Gong H Y,et al.Activation of cytokine expression occurs through the TNFα/NF-κB-mediated pathway in birnavirus-infected cells[J].Fish & Shellfish Immunology,2011,31(1):10—21
[18]Peng X Y,Liu H,Chen X X,et al.Effects of LPS from Aeromonas hydrophila and Escherichia coli on expression of immune related genes in grass carp,Ctenopharyngodon idella[J].Journal of Huazhong Agricultural University,2014,33(1):67—72[彭小云,劉紅,陳孝煊,等.嗜水氣單胞菌和大腸桿菌LPS對草魚免疫相關基因表達的影響.華中農業大學學報,2014,33(1):67—72]
[19]Tang X R,Marciano D L,Leeman S E,et al.LPS induces the interaction of a transcription factor,LPS-induced TNF-alpha factor,and STAT6(B)with effects on multiple cytokines[J].Proceedings of the National Academy of Sciences,2005,102(14):5132—5137
[20]Ronkina N,Menon M B,Schwermann J,et al.MAPKAP kinases MK2 and MK3 in inflammation:complex regulation of TNF biosynthesis via expression and phosphorylation of tristetraprolin[J].Biochemical Pharmacology,2010,80(12):1915—1920
[21]Dumitru C D,Ceci J D,Tsatsanis C,et al.TNF-α induction by LPS is regulated posttranscriptionally via a Tpl2/ERK-dependent pathway[J].Cell,2000,103(7):1071—1083
IN VITRO EXPRESSION PATTERN OF GRASS CARP TUMOR NECROSIS FACTOR(TNF-α)IN RESPONSE TO IMMUNE STIMULATION
LU Cui-Yu1,2,LI Yan1,LIU Qing-Hui2and Lü Li-Qun1
(1.Key Laboratory of Freshwater Fishery Germplasm Resources,Ministry of Agriculture,Shanghai Ocean University,Shanghai 201306,China; 2.Yellow Sea Aquatic Research Institute of China Aquatic Institute,Qingdao 266071,China)
Abstract:Tumor necrosis factor alpha(TNF-α)is a multi-functional cytokine that plays important role in immune response,the homeostasis of the immune system,apoptosis,cell proliferation,and differentiation.Whether pathogen and immune stimulation can enhance the protein level of TNF-α is unclear.In this study,the cDNA of grass carp TNF-α was cloned into the prokaryotic expression vector pET-32 for expression of His6-tagged TNF-α.After purification through Ni2+-affinity chromotopraphy column,purified His6- TNF-α was subjected to immunize mouse to get polyclonal antibody,anti- TNF-α.Western blot analysis showed that the anti- TNF-α could specifically recognize endogenic grass carp TNF-α as well as His6- TNF-α.Furthermore,our results indicated that the CIK TNF-α level remain constant when challenged with GCRV or treated with immune stimulators in vitro.Since CIK cells seemed to be not a good cell line in investigating the response of TNF alpha signal pathway to stress,an in vivo experiment might be required to monitor the protein expression of TNF-α in specific immune organs or cells.
Key words:Grass carp reovirus; Tumor necrosis factor(TNF alpha); Prokaryotic expression; Polyclonal antibody
中圖分類號:S941.4
文獻標識碼:A
文章編號:1000-3207(2016)03-0481-07
doi:10.7541/2016.64
收稿日期:2015-06-11;
修訂日期:2015-12-04
基金項目:現代農業產業技術體系建設專項資金(CARS-46-12); 國家自然科學基金(31372561)資助[Supported by the Earmarked Fund for China Agriculture Research System(No.CARS-46-12); the National Natural Science Foundation of China(No.31372561)]
作者簡介:盧翠玉(1991—),女,山西運城人; 碩士; 主要從事水產動物病原學研究。E-mail:JADE20100000@163.com
通信作者:呂利群,男,教授; 博士; 主要從事水產動物病原學研究。E-mail:lqlv@shou.edu.cn

