低溫誘導型凡納濱對蝦DEAD-box RNA解旋酶基因的克隆與表達分析
彭金霞呂麗虹韋嬪媛何蘋萍陳曉漢(.廣西水產科學研究院,南寧 53002; 2.廣西水產技術推廣總站,南寧 53002)
低溫誘導型凡納濱對蝦DEAD-box RNA解旋酶基因的克隆與表達分析
彭金霞1 *呂麗虹2 *韋嬪媛1何蘋萍1陳曉漢1
(1.廣西水產科學研究院,南寧 530021; 2.廣西水產技術推廣總站,南寧 530021)
摘要:為研究凡納濱對蝦耐寒性狀的分子基礎,克隆鑒定了凡納濱對蝦DEAD-box RNA解旋酶的同源基因。根據差減文庫中篩選到的一個低溫上調表達的DEAD-box RNA解旋酶基因片段,通過RACE PCR擴增獲得兩條高度相似的cDNA全長序列,兩條cDNA均為1430 bp,包含139 bp 5′UTR、79 bp 3′UTR和1212 bp 開放閱讀框,編碼403個氨基酸殘基。Blast比對結果顯示,兩條cDNA與其他物種的DDX5相似性最高,推測為凡納濱對蝦DDX5基因的兩個變異體,分別命名為LvDDX5variant A(LvDDX5A)和LvDDX5variant B(LvDDX5B),在系統進化樹中,LvDDX5A和LvDDX5B聚為最近的一支,并與蝦類DDX5、文昌魚DDX、貝類的DDX5距離較近。Real-time PCR分析結果顯示,LvDDX5A和LvDDX5B都呈多組織遍在表達,在精巢、鰓、腸、肌肉和卵巢中,LvDDX5B表達量高于LvDDX5A,而在肝胰腺中LvDDX5A表達量高于LvDDX5B。在低溫脅迫對蝦肝胰腺和心中,LvDDX5A呈上調表達而LvDDX5B表達量無明顯變化。進一步對LvDDX5A在不同低溫條件脅迫對蝦的肝胰腺中表達變化進行了分析。結果顯示,LvDDX5A在18℃、15℃、13℃和11℃低溫脅迫36h均被誘導表達,并隨著15℃和13℃低溫脅迫時間的增加呈先上升后下降的表達模式,在48h達到峰值,LvDDX5A的低溫誘導表達模式暗示其可能是在凡納濱對蝦低溫適應中發揮作用的剪接體。
關鍵詞:凡納濱對蝦; 低溫誘導; DEAD-box; RNA解旋酶; 耐寒
低溫誘導型DEAD-box RNA解旋酶(DEAD-box RNA helicase)基因是目前發現在古細菌、原核生物、植物等生物中廣泛存在的耐寒調控因子。在對15種嗜熱古細菌的比較中發現,9種具有低溫誘導型DEAD-box RNA解旋酶基因的菌種的生存溫度明顯低于6種不具低溫誘導型DEAD-box RNA解旋酶的菌種; DEAD-box RNA 解旋酶基因也能使嗜冷古細菌Methanococcoides burtonii的生存溫度從23℃降低到4℃,表明DEAD-box RNA解旋酶基因可提高古細菌耐受相對低溫的能力,從而降低其生存溫度的下限[1—4]。通過低溫誘導型DEAD-box RNA解旋酶基因的表達提高耐寒能力是也原核生物通用的機制,如大腸桿菌CsdA和 SrmB、枯草桿菌CshA和CshB、藍細菌的CrhC等均能通過低溫誘導表達提高機體耐寒能力[5—10],且大腸桿菌CsdA的研究表明,DEAD-box RNA解旋酶基因通過調控RNA二級結構和翻譯過程,使機體細胞產生對低溫環境的適應[11—15]。
在擬藍芥(Arabidopsis)LOS4基因的研究中則找到了低溫誘導型DEAD-box RNA解旋酶基因單核苷酸突變(第五外顯子G→A突變,對應氨基酸突變為Gly-364-Arg)與耐寒能力的關系。并發現LOS4基因通過誘導CBF等下游效應基因的表達,提高機體耐寒能力,使22℃生長的植株在4℃正常生長[16—18]。另外2個低溫誘導型擬藍芥DEAD-box RNA解旋酶基因AtRH9和AtRH25,則可以挽救大腸桿菌冷休克蛋白的缺失突變,使其從低溫敏感型變為低溫耐受型[19],說明DEAD-box RNA解旋酶基因在提高耐寒能力方面的保守性。
Boudet等[20]從基因進化角度分析了擬藍芥和果蠅、線蟲等動物在DEAD-box RNA解旋酶基因結構上的異同及基因進化規律,但動物中關于DEAD-box RNA解旋酶基因功能的研究主要涉及細胞增殖、癌癥的發生、生殖發育等,目前尚未見與耐寒相關的報道。
凡納濱對蝦是我國主導水產養殖品種之一,但凡納濱對蝦為暖水性物種,耐寒能力差是制約其產業發展的重要原因之一。因此,解析耐寒性狀的分子調控機制,通過分子輔助耐寒新品種選育是產業發展的迫切需求[21,22]。本研究對差減文庫中篩選到一個低溫上調表達的DEAD-box RNA解旋酶基因進行了全長序列克隆分析,并對其在低溫脅迫條件下的表達特征進行了研究,為進一步開展功能研究和應用于分子輔助耐寒品種選育提供基礎數據。
1 材料與方法
1.1 實驗材料
實驗所使用凡納濱對蝦均為廣西水產科學研究院下屬廣西SPF南美白對蝦遺傳育種中心培育的2—3月齡快速生長期家系對蝦,規格8—12 g。將實驗對蝦運至水族實驗室后,在40 cm×160 cm 可控溫的玻璃容器中通氣養殖,水溫為28℃,鹽度為22‰。暫養7d后隨機分為均等的5組,一組保持常溫養殖,另外4組根據前期預實驗確定的目的溫度(18℃、15℃、13℃和11℃)和降溫速率(4h/1℃)進行降溫。15℃和13℃組降至目的溫度后的12h、24h、36h、48h、60h和72h采集對蝦的肝胰腺組織,18℃和11℃組僅采集了處理36h對蝦肝胰腺。降溫處理組及同批次的常溫組各取樣點分別取3—5尾,采集的組織液氮速凍,隨后移入-80℃冰箱中凍存備用。常溫組另取對蝦的心、鰓、腸、肌肉、精巢、卵巢等組織用于組織表達譜分析。
1.2 實驗方法
基因克隆 對低溫差減文庫測序獲得的表達序列(ESTs)用DNAStar軟件進行拼接獲得Contig,然后進行在線blast同源性比對分析。選擇低溫表達豐度高的DDX同源片段設計上下游引物WK5F/WK5R。根據定向插入pBluescript lI SK載體的SMART全長文庫插入位點上下游序列設計M13+/M13-引物。以低溫脅迫仔蝦SMART全長文庫[23]為模板,用M13+/WK5R和WK5F/M13-引物對分別進行5′和3′RACE擴增。擴增片段經1.5%瓊脂糖凝膠電泳分離后,回收目的片段,克隆至PGEMTeasy載體,轉化Top10感受態細胞后,每個片段挑取10個克隆測序。
序列分析 測序結果去除載體和文庫接頭序列后,用DNAstar軟件中的Seqman程序進行拼接,將拼接后所得序列使用EdiSeq程序進行開放閱讀框(ORF)的搜索,使用NCBI網站(http:∥www.ncbi.nlm.nih.gov/blast)的BLASTX軟件進行同源比對并下載相關蛋白序列。
熒光定量PCR 用TRizol試劑盒(Invitrogen公司)進行總RNA的抽提,然后取部分RNA溶液通過紫外分光光度計測定RNA的A260/A280的值,判斷RNA的純度并計算其濃度,通過1%的瓊脂糖電泳分析RNA的完整性。以Random引物(隨機6核苷酸序列,Promega C1181),在M-MLV 逆轉錄酶作用下反轉錄合成第一鏈cDNA,將cDNA產物稀釋10倍,以β-actin基因作內參,采用含SYBR Green I Dye熒光染料的THUNDERBIRD qPCR Mix(TOYOBO)進行熒光定量PCR擴增,儀器為ABI 7500-fast。反應體系:1.0 μL cDNA,10 μL 2×THUNDERBIRD qPCR Mix,上下游引物各0.5 μL,補足水至總體積20 μL。擴增程序為:95℃ 20s預變性; 95℃ 3s、60℃ 30s進行40個循環反應。基因的引物序列見表1,DDX1F2/R2用于擴增LvDDX5A,DDX2F/2R用于擴增LvDDX5B,。基因的相對表達量按照2-ΔΔCt法對本試驗所得數據進行分析獲得[24]。
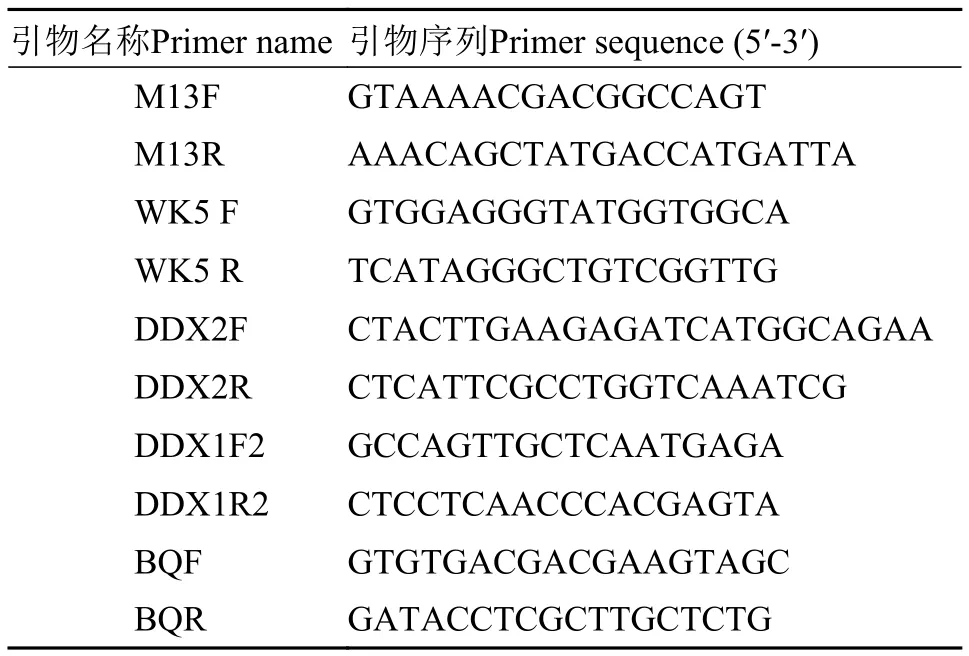
表 1 引物及序列Tab.1 Primer name and sequence
2 結果
2.1 LvDDX5基因的克隆與序列分析
通過凡納濱對蝦低溫差減文庫篩選,獲得1條851 bp的低溫誘導上調表達型contig序列。Blast比對結果顯示,該序列與其他物種的DEAD-box RNAhelicase 基因家族的成員DDX5和DDX17同源性最高。根據已獲得的contig序列通過5′和3′-RACE擴增,分別獲得一條300 bp左右的5′片段和一條1.2 kb 的3′片段。克隆測序結果顯示,5′片段為342 bp,3′片段為1252 bp,且3′ 1252 bp序列中存在兩種不同的變異體,兩個變異體間除了一個109 bp 片段差異,其他位置堿基完全一致。將5′序列與兩條3′序列分別拼接獲得兩條cDNA序列,Blast比對結果顯示,兩條cDNA與其他物種的DDX5和DDX17相似性都很高,但blastn和blastx比對結果中,相似性最高的都是DDX5同源基因,推測擴增獲得的是凡納濱對蝦DDX5的兩個變異體,分別命名為LvDDX5A(GenBank登錄號:KT122790)和LvDDX5B(GenBank登錄號:KT122791)。LvDDX5A和LvDDX5B cDNA全長均為1430 bp,包含139 bp 5′UTR、79 bp 3′UTR和1212 bp開放閱讀框,編碼403個氨基酸殘基。
然后從GenBank下載不同分類地位物種的同源蛋白序列進行進化樹構建。如圖 1所示,LvDDX5A和LvDDX5B聚為最近的一支,與LvDDX5遺傳距離較近的分別為蝦類DDX5、文昌魚DDX、貝類的DDX5。昆蟲的DDX5和DDX17分別聚為兩支,哺乳動物、鳥類、兩棲類和魚類的DDX5和DDX17分別聚為另外兩支,LvDDX5A和LvDDX5B與哺乳動物、鳥類、兩棲類和魚類的DDX5距離較近,卻與昆蟲類的DDX17較近。南美白對蝦另一個DEAD-box RNA helicase基因PL10作為外類群,獨立于DDX5 和DDX17單獨聚為一支。
2.2 LvDDX5基因的表達譜分析

圖 1 利用MEGA4.1 軟件構建的基于DDX 氨基酸序列的NJ系統樹
根據差異序列分別設計特異于LvDDX5A和LvDDX5B的兩對引物,比較分析兩個變異體的表達模式。首先,將正常對蝦心中的表達量定義為1,分析組織表達譜,兩個變異體都呈多組織遍在表達,且在肌肉中表達量最高,在精巢、卵巢、腸和鰓中表達量較高,心中最低。比較兩個變異體的表達量發現,在精巢、鰓、腸、肌肉和卵巢中,LvDDX5B表達量高于LvDDX5A,而在肝胰腺中LvDDX5A表達量高于LvDDX5B(圖 2)。
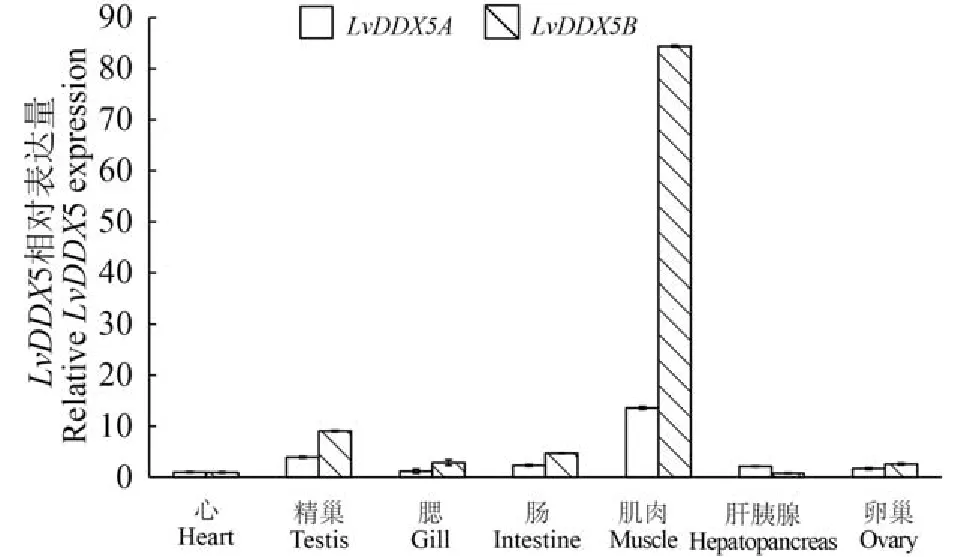
圖 2 LvDDX5基因在不同組織中的相對表達分析
然后選擇在低溫脅迫應答中比較重要的組織肝胰腺、心、鰓和肌肉進行兩個變異體的低溫表達分析。結果如圖 3所示,LvDDX5A在肝胰腺和心中呈低溫上調表達,在肌肉和鰓中下調表達,而LvDDX5B在低溫脅迫對蝦肝胰腺和心中表達量無明顯變化,在肌肉和鰓中下調表達。
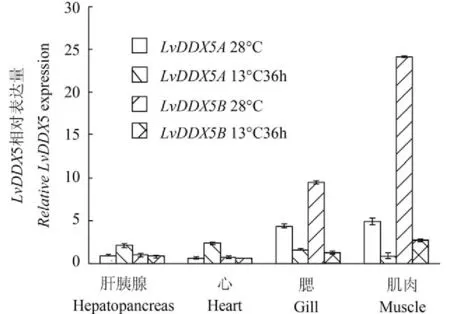
圖 3 LvDDX5基因在不同組織中的低溫表達分析
進一步對LvDDX5A在不同低溫條件脅迫對蝦的肝胰腺中表達變化進行了分析。首先,在不同強度的低溫脅迫下,LvDDX5A均被誘導表達,18℃、15℃、13℃和11℃低溫脅迫36h的表達量分別為常溫的2.3、1.5、2.1和1.9倍。然后分析了15℃和13℃低溫脅迫不同時間下的表達變化。在15℃和13℃低溫脅迫的各時間點LvDDX5A的表達量均高于常溫對照,兩組都隨著處理時間的增加呈先上升后下降的表達模式,且都在48h達到峰值(15℃組:常溫的3.1倍; 13℃組:常溫的5.2倍)(圖 4)。
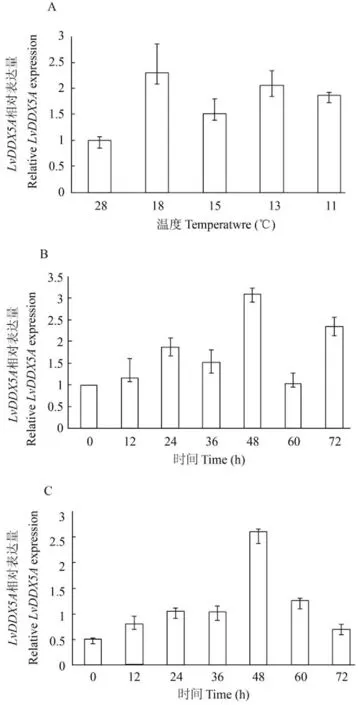
圖 4 LvDDX5A在肝胰腺中的低溫表達分析
3 討論
3.1 LvDDX5基因序列特征分析
DEAD-box RNA解旋酶基因(DDX)是RNA解旋酶的一個亞家族,具有與ATP水解相關的Asp-Glu-Ala-Asp結構域和保守的催化結構域,而其他側翼序列在不同的DEAD-box RNA解旋酶家族成員之間差異很大,以適應不同功能[25]。在細胞活動中,RNA分子容易形成非功能性的二級結構,往往需要在分子伴侶的協助下形成正確的二級結構才能發揮功能。在逆境脅迫條件下,細胞中的翻譯起始受阻,導致更多的錯誤的mRNA二級結構形成,而這些二級結構反過來進一步抑制了翻譯活動。DEAD-box RNA解旋酶是一類重要的分子伴侶,它們可借助ATP水解釋放的能量解開mRNA錯誤二級結構,引導正確結構的形成,從而啟動低溫下的正常翻譯活動[10,14]。DEAD-box RNA解旋酶基因還可以通過激活轉錄因子和通過自身磷酸化在轉錄或翻譯水平調控下游低溫效應基因的表達[16,17,26]。
Blast比對結果表明,LvDDX5與DDX5、DDX17的相似性都很高,但與DDX5的相似性最高。DDX5 和DDX17在其核心催化結構域具有92%相似性,在N端和C端可變區仍有72%和44%相似性,兩個基因均具有RNA解旋酶活性并參與基因剪接和轉錄調控[27]。在系統進化樹中,LvDDX5A和LvDDX5B與哺乳動物、鳥類、兩棲類和魚類的DDX5距離較近,卻與昆蟲類的DDX17較近,因此,通過序列比對推測本研究克隆的是凡納濱對蝦DDX5直系同源基因,但從進化分析結果難以確定LvDDX5 到底是DDX5還是DDX17,這可能是因為無脊椎動物中DDX5/DDX17同源基因序列還不夠多,而兩個基因的相似性又很高,導致進化分析聚類時出現偏差。
基因的選擇性剪接是轉錄后調控的重要部分,在生物的逆境適應中被廣泛應用,逆境下選擇性剪接使蛋白的定位、結合特性、活性及穩定性發生改變,從而適應新的環境[28]。在斑馬魚的低溫轉錄組研究中,作者發現197個功能基因在低溫脅迫時發生了選擇性剪接,主要涉及蛋白酶、轉錄調控因子、剪接調控因子和抗病因子等[29]。DEAD-box RNA解旋酶是一類重要的低溫轉錄調控因子,很可能通過選擇性剪接實現功能,在斑馬魚中,DDX5基因也在編碼區的3′端發生選擇性剪接,產生2條mRNA序列(NM_212612,NM_001309525),但兩個剪接體的具體功能分歧尚未見報道。通過LvDDX5基因兩個變異體的序列比較分析,推測109 bp外顯子的選擇與其耐寒功能相關,LvDDX5A在肝胰腺和心中呈低溫誘導表達,而LvDDX5B在低溫下表達無上調,因此LvDDX5A變異體可能在凡納濱對蝦的耐寒中發揮作用。
3.2 LvDDX5基因的表達特征分析
各物種的研究結果均顯示,低溫誘導上調表達是RNA解旋酶基因發揮功能提高機體耐寒能力的基礎[2,15]。為了解LvDDX5A基因在對蝦低溫適應中的可能作用,本研究通過熒光定量PCR對其低溫表達譜進行了詳細的分析。根據預實驗對蝦的低溫行為反應,本研究設置了一系列低溫脅迫條件和取樣點,如18℃雖然已經低于對蝦適宜生存溫度,但并不影響其活動,攝食也基本正常,推測不會引起基因表達的變化,因而只設置一個取樣點; 在15℃低溫時,對蝦攝食明顯減少且活動減弱,在13℃低溫脅迫后,對蝦聚集于缸底活動很少,少數個體身體失去平衡呈側躺狀態,15℃和13℃低溫對對蝦造成了較明顯的行為影響,但在其可忍受的范圍內,推測此時基因的表達調控起到重要作用,因此設置了不同脅迫時間的取樣點進行基因表達量分析; 而當溫度降到11℃時,對蝦全部側躺,活動微弱,部分個體在脅迫36h死亡,低溫對大部分蝦體造成不可逆損傷,推測此時對蝦應難以通過調整自身的基因表達應對低溫。但LvDDX5A基因的低溫表達譜結果與我們的推測不盡相同,LvDDX5A基因在較低強度低溫(18℃)脅迫時即上調表達,并在11℃極度低溫時仍維持與13℃基本相當的高表達水平。
在甲殼動物中,肝胰腺是反應機體健康、營養、疾病、重金屬積累等狀況的重要器官[30],而且LvDDX5基因也呈現肝胰腺低溫誘導表達現象,因此本研究著眼于肝胰腺中基因表達的量的變化,而肌肉和鰓中的下調表達可能與基因的多功能性相關。LvDDX5A和LvDDX5B呈現不同的表達模式可能與兩個剪接體功能的分歧有關,如在高山離子芥中發現,DEAD-box RNA解旋酶基因CbGRP通過選擇性剪接產生mRNA CbDRH.2 和CbDRH.1,其中CbDRH.2可與已知的低溫效應蛋白結合參與提高耐寒性狀,而CbDRH.1則參與無義介導的mRNA降解[31]。15℃和13℃低溫處理不同時間的表達譜分析表明,LvDDX5A mRNA都是呈先上升后下降,并在低溫下一直維持高表達水平,與已報道的低溫應答基因AtRH9、RCF1、CBF2、RD29A等的表達模式相一致[18,19,32]。LvDDX5A的表達模式也與實驗中觀察到的對蝦狀態一致,在15℃和13℃低溫處理組,開始低溫脅迫時對蝦活動很少且側躺的個體較多,隨著脅迫時間延長,13℃組對蝦基本都能逐漸恢復直立狀態,而15℃組對蝦能恢復到正常游泳狀態。可能因為低溫脅迫早期,細胞需要大量合成LvDDX5A mRNA并不斷翻譯成蛋白,糾正低溫引起的RNA錯誤折疊,而隨著低溫脅迫時間的延長,細胞中翻譯等活動新的穩態逐漸建立,LvDDX5A mRNA表達量逐漸降低并維持在較高水平以維護細胞低溫條件下的正常翻譯活動。
參 考 文 獻:
[1]Shimada Y,Fukuda W,Akada Y,et al.Property of cold inducible DEAD-box RNA helicase in hyperthermophilic archaea[J].Biochemical and Biophysical Research Communications,2009,389(4):622—627
[2]Lim J,Thomas T,Cavicchioli R.Low temperature regulated DEAD-box RNA helicase from the Antarctic archaeon,Methanococcoides burtonii[J].Journal of Molecular Biology,2000,297(3):553—567
[3]Fukui T,Atomi H,Kanai T,et al.Complete genome sequence of the hyperthermophilic archaeon The rmococcus kodakaraensis KOD1 and comparison with Pyrococcus genomes[J].Genome Research,2005,15(3):352—363
[4]Boonyaratanakornkit B B,Simpson A J,Whitehead T A,et al.Transcriptional profiling of the hyperthermophilic methanarchaeon Methanococcus jannaschii in response to lethal heat and non-lethal cold shock[J].Environmental Microbiology,2005,7(6):789—797
[5]Cartier G,Lorieux F,Allemand F,et al.Cold adaptation in DEAD-box proteins[J].Biochemistry,2010,49(12):2636—2646
[6]Hunger K,Beckering C L,Wiegeshoff F,et al.Cold-induced putative DEAD box RNA helicases CshA and CshB are essential for cold adaptation and interact with cold shock protein B in Bacillus subtilis[J].Journal of Bacteriology,2006,188(1):240—248
[7]Owttrim G W.RNA helicases and abiotic stress[J].Nucleic Acids Research,2006,34(11):3220—3230
[8]Yu E,Owttrim G W.Characterization of the cold stressinduced cyanobacterial DEAD-box protein CrhC as an RNA helicase[J].Nucleic Acids Research,2000,28(20):3926—3934
[9]Broussolle V,Pandiani F,Haddad N,et al.Insertional mutagenesis reveals genes involved in Bacillus cereus ATCC 14579 growth at low temperature[J].FEMS Microbiology Letters,306(2):177—183
[10]Chamot D,Owttrim G W.Regulation of cold shock-induced RNA helicase gene expression in the Cyanobacterium anabaena sp.strain PCC 7120[J].Journal of Bacteriology,2000,182(5):1251—1256
[11]Jones P G,Mitta M,Kim Y,et al.Cold shock induces a major ribosomal-associated protein that unwinds doublestranded RNA in Escherichia coli[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93(1):76—80
[12]Charollais J,Pflieger D,Vinh J,et al.The DEAD-box RNA helicase SrmB is involved in the assembly of 50S ribosomal subunits in Escherichia coli[J].Molecular Microbiology,2003,48(5):1253—1265
[13]Prud'homme-Genereux A,Beran R K,Iost I,et al.Physical and functional interactions among RNase E,polynucleotide phosphorylase and the cold-shock protein,CsdA:evidence for a cold shock degradosome[J].Molecular Microbiology,2004,54(5):1409—1421
[14]Chamot D,Colvin K R,Kujat-Choy S L,et al.RNA structural rearrangement via unwinding and annealing by the cyanobacterial RNA helicase,CrhR[J].The Journal of Biological Chemistry,2005,280(3):2036—2044
[15]Charollais J,Dreyfus M,Iost I.CsdA,a cold-shock RNA helicase from Escherichia coli,is involved in the biogenesis of 50S ribosomal subunit[J].Nucleic Acids Research,2004,32(9):2751—2759
[16]Vashisht A A,Tuteja N.Stress responsive DEAD-box helicases:a new pathway to engineer plant stress tolerance[J].Journal of Photochemisty and Photobiology B,2006,84(2):150—160
[17]Gong Z,Lee H,Xiong L,et al.RNA helicase-like protein as an early regulator of transcription factors for plant chilling and freezing tolerance[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(17):11507—11512
[18]Gong Z,Dong C H,Lee H,et al.A DEAD box RNA helicase is essential for mRNA export and important for development and stress responses in Arabidopsis[J].Plant Cell,2005,17(1):256—267
[19]Kim J S,Kim K A,Oh T R,et al.Functional characterization of DEAD-box RNA helicases in Arabidopsis thaliana under abiotic stress conditions[J].Plant Cell Physiology,2008,49(10):1563—1571
[20]Boudet N,Aubourg S,Toffano-Nioche C,et al.Evolution of intron/exon structure of DEAD helicase family genes in Arabidopsis,Caenorhabditis,and Drosophila[J].Genome Research,2001,11(12):2101—2114
[21]Peng J X,Fang Z F,Wei P Y,et al.Sequence and expression analysis of metallothionein from Litopenaeus vannamei[J].Acta Hydrobiologica Sinica,2013,37(4):24—28[彭金霞,房振峰,韋嬪媛,等.凡納濱對蝦MT基因序列及其在卵巢發育和低溫脅迫中的表達分析.水生生物學報,2013,37(4):24—28]
[22]Yin Q,Cui L,Peng J X,et al.Molecular cloning of LVANT2 gene and its expression pattern by cold induction[J].Acta Hydrobiologica Sinica,2012,36(1):678—683[殷勤,崔亮,彭金霞,等.凡納濱對蝦ANT2基因的克隆及低溫表達譜分析.水生生物學報,2012,36(1):678—683]
[23]Peng J,Fang Z,Wei B,et al.Analysis of A cDNA library and 3 copies of troponin i genes in juvenile pacific white leg shrimp Litopenaeus vannamei exposed to low temperature[J].Fisheries Science,2013,32(2):73—79
[24]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402—408
[25]Fukuda T,Yamagata K,Fujiyama S,et al.DEAD-boxRNA helicase subunits of the Drosha complex are required for processing of rRNA and a subset of microRNAs[J].Nature Cell Biology,2007,9(5):604—611
[26]Intile P J,Balzer G J,Wolfgang M C,et al.The RNA helicase DeaD stimulates ExsA translation to promote expression of the Pseudomonas aeruginosa type III secretion system[J].Journal of Bacteriology,2015,197(16):2664—2674
[27]Fuller-Pace F V.DExD/H box RNA helicases:multifunctional proteins with important roles in transcriptional regulation[J].Nucleic Acids Research,2006,34(15):4206—4215
[28]Mastrangelo A M,Marone D,Laido G,et al.Alternative splicing:enhancing ability to cope with stress via transcriptome plasticity[J].Plant Science,2012,185—186:40—49
[29]Long Y,Song G l,Yan J J,et al.Transcriptomic characterization of cold acclimation in larval zebrafish[J].BMC Genomics,2013,14:612
[30]Guo T F,Huang X X,Su M,et al.Effect of dietary copper level on the immunity,vibrio-resistant ability,lysozyme mRNA and toll receptor mRNA expressions in the white shrimp Litopenaeus vannamei[J].Acta Hydrobiologica Sinica,2012,36(5):809—816[郭騰飛,黃旭雄,蘇明,等.飼料中銅水平對凡納濱對蝦免疫相關基因表達和抗菌能力的影響.水生生物學報,2012,36(5):809—816]
[31]Yang Y,Sun Z L,Ding C C,et al.A DEAD-box RNA helicase produces two forms of transcript that differentially respond to cold stress in a cryophyte(Chorispora bungeana)[J].Planta,2014,240(2):369—380
[32]Guan Q M,Wu J M,Zhang Y Y,et al.A DEAD Box RNA helicase is critical for pre-mRNA splicing,cold-responsive gene regulation,and cold tolerance in arabidopsis[J].Plant Cell,2013,25(1):342—356
CLONING,CHARACTERIZATION AND EXPRESSION ANALYSIS OF A COLDINDUCIBLE DEAD-BOX RNA HELICASE GENE IN LITOPENAEUS VANNAMEI
PENG Jing-Xia1,Lü Li-Hong2,WEI Pin-Yuan1,HE Ping-Ping1and CHEN Xiao-Han1
(1.Guangxi Academy of Fisheries Science,Nanning 530021,China; 2.Guangxi Fisheries Extension Center,Nanning 530021,China)
Abstract:Cold-inducible DEAD-box RNA helicases are conservative regulator of cold tolerance in archaea,prokaryote and eukaryote.We have got a cold-inducible DEAD-box RNA helicase EST from cold tolerant shrimps.In this study,two cDNA sequence of the DEAD-box RNA helicase gene were obtained by RACR PCR.The two cDNAs were 1430 bp in length including a 139 bp 5′UTR,a 79 bp 3′UTR and a 1212 bp open reading frame,encoding a peptide of 403 aa.Blast analysis showed that the two cDNAs had top hit of DDX homologous,thus named LvDDX5 variant A(LvDDX5A)and LvDDX5 variant B(LvDDX5B).Phylogenetic analysis revealed that LvDDX was related closely to shrimp DDX5,Branchiostoma floridae DDX and Aplysia californica DDX5.LvDDX5A and LvDDX5B were widely expressed,and LvDDX5B was higher in testis,gill,intestine,muscle and ovary,whereas LvDDX5A was higher in hepatopancreas.LvDDX5A but not LvDDX5B was up-regulated in hepatopancreas and heart by cold induction.LvDDX5A can be induced by various low temperatures including 18,15,13 and 11℃.With different time treatment at 15 and 13℃,LvDDX5A increased firstly,reached to the peak at 48h,and decreased afterward.These results suggest that LvDDX5A may play an important role in cold tolerance of Litopenaeus vannamei.
Key words:Litopenaeus vannamei; Cold-inducible; DEAD-box; RNA helicases; Cold tolerant
中圖分類號:Q344+.1
文獻標識碼:A
文章編號:1000-3207(2016)03-0474-07
doi:10.7541/2016.63
收稿日期:2015-06-24;
修訂日期:2015-12-12
基金項目:廣西壯族自治區直屬公益性科研院所基本科研業務費(編號:GXIF-2014-002),國家自然科學基金項目(編號:31460690); 八桂學者建設專項資金(編號:BGXZ-NMBDX-05); 現代農業產業技術體系建設專項(編號:CARS-47)資助[Supported by the Fundamental Research Funds for Nonprofit Research Institutes under Guangxi Zhuang Autonomous Region(Grant No.GXIF-2014-002); the National Natural Science Foundation of China(Grant No.31460690),the Special Funds for Ba Gui Scholars Project Construction(Grant No.BGXZ-NMBDX-05); the China Agriculture Research System(Grant No.CARS-47)]
作者簡介:彭金霞(1981—),女,安徽潛山縣人; 遺傳學博士; 主要從事水產動物遺傳育種與分子輔助育種研究。E-mail:pengjinxia@gmail.com; 呂麗虹(1970—),女,廣西北流人; 主要從事水產技術推廣工作。E-mail:Lvlihong5829857@163.com.*共同第一作者
通信作者:陳曉漢,E-mail:chnxhn@163.com

