二甲雙胍與西格列汀對非酒精性脂肪肝病大鼠肝臟FGF21及SREBP-1c mRNA表達的影響
申 甜,喻 明,章志建,徐碧林,張翠平
二甲雙胍與西格列汀對非酒精性脂肪肝病大鼠肝臟FGF21及SREBP-1c mRNA表達的影響
申甜,喻明*,章志建,徐碧林,張翠平
上海市普陀區中心醫院,上海 200062
[摘要]目的比較二甲雙胍及西格列汀對高脂飲食誘導大鼠肝臟FGF21 mRNA及SREBP-1c mRNA的作用。方法將60只SD大鼠隨機分為正常組20只(普通飼料,NC組)及高脂組40只(高脂飲食,HF組),喂養8周后,每組隨機抽取10只,比較后證實HF組NAFLD模型成功建立。繼將HF組分3組:二甲雙胍干預組(HF+M,10只)[加二甲雙胍500 mg/(kg·d)]、西格列汀干預組(HF+XI,10只)[加西格列汀10 mg/(kg·d)]及高脂組(HF1,10只)(等體積生理鹽水)。灌胃8周末處死,檢測血清丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、總膽固醇(TC)、三酰甘油(TG)、游離脂肪酸(FFA)含量,空腹血糖(FBG)及胰島素(FINS)水平,計算胰島素抵抗指數(HOMA-IR);HE染色觀察肝臟病理形態學的變化;Real-time PCR檢測肝組織FGF21 mRNA及SREBP-1c mRNA表達的變化。結果兩種藥物均可降低血清ALT、AST活性(P<0.05),減少TC、TG、FFA含量,FBG、肝臟TG含量及HOMA-IR(P<0.05);西格列汀可明顯改善大鼠肝臟脂肪變,效果優于二甲雙胍;二甲雙胍可下調肝組織SREBP-1c mRNA表達量,上調FGF21 mRNA表達量(P<0.01),而西格列汀可同時降低肝臟FGF21 mRNA及SREBP-1c mRNA表達量(P<0.01)。結論西格列汀與二甲雙胍均可有效減少肝臟TG含量,但西格列汀改善肝組織病理變化較二甲雙胍明顯,而二甲雙胍減輕HOMA-IR強于西格列汀;同時,二者均可不同程度影響肝組織SREBP-1c與FGF21 mRNA表達量。
[關鍵詞]二甲雙胍;西格列汀;非酒精性脂肪性肝病
0引言
流行病學顯示,我國普通人群非酒精脂肪肝病(Nonalcoholic fatty liver disease,NAFLD)患病率為12%~17%,而患者中有21%~45%發生糖尿病,且有學者發現,NAFLD可以預測2型糖尿病(T2DM)的發生和發展。李華亭等[1]發現,血清成纖維細胞生長因子21(FGF21)水平對NAFLD的早期診斷具有一定的特異性及準確性;而固醇調節元件結合蛋白-1c(Sterol regulatory element-binding protein1c,SREBP-1c)主要在肝臟和脂肪細胞表達,可調控體內的脂肪合成,與肝臟脂質沉積有關。胰島素抵抗(IR)在NAFLD及T2DM形成中起到關鍵作用[2-4],故改善IR將成為防治NAFLD的一個主要方向[5]。本實驗對高脂誘導NAFLD大鼠分別選用二甲雙胍及西格列汀干預8周,探討二者對肝臟TG含量、肝組織病理組織學及胰島素抵抗、肝組織FGF21 mRNA及SREBP-1c mRNA表達的影響。
1材料與方法
1.1動物選用SPF級6~8周齡、體重(180±10)g雄性SD大鼠60只,購于上海斯萊克實驗動物有限責任公司,動物許可證號:SCXK(滬)2012-0002,由上海市普陀區中心醫院動物飼養中心分籠喂養,動物房內通風良好,室溫保持在18~25 ℃,相對濕度40%~60%,光照時間每天12 h。
1.2實驗藥物鹽酸二甲雙胍片(500 mg/片,上海施貴寶制藥公司,批號:1112103);西格列汀由默沙東饋贈(100 mg/片,杭州默沙東制藥有限公司分裝,批號:J20120058)。
1.3動物分組及模型建立所有大鼠正常喂養1周后,隨機分為正常組(NC組,20只)、高脂組(HF組,40只)。NC組給予基礎飼料(蛋白質21%、脂肪6%、碳水化合物55%)喂養,HF組給予高脂飼料(上海斯萊克實驗動物有限公司定制,組成為83%基礎飼料,10%豬油,5%蔗糖,1.5%膽固醇,0.5%膽鹽)喂養。8周后,每組抽取10只,進行稱重、檢測生化學指標,行肝組織病理檢測,HF組證實NAFLD造模成功。將HF組大鼠按隨機數字表法分為高脂組(HF1組,等體積生理鹽水)、二甲雙胍干預組[HF+M組,加二甲雙胍500 mg/(kg·d)]、西格列汀干預組[HF+XI組,加西格列汀10 mg/(kg·d)],每組10只,連續灌胃8周。8周結束后,各組動物于末次給藥后,禁食不禁水12 h,行乙醚腹腔麻醉大鼠,稱重,腹主動脈采血,分離血清;迅速取出肝臟并稱重,計算肝臟指數(肝臟濕重/體重);取相同部位肝右葉用10%中性甲醛固定,作肝組織病理學觀察,其余肝臟-70 ℃凍存備用,行FGF21及SREBP-1c mRNA檢測。
1.4實驗試劑血清FFA、肝臟三酰甘油(TG)及胰島素試劑盒均購自上海博谷生物有限公司,RT-PCR試劑盒TRIzol、PrimeScript RT-PCR Kit和Premix EX Taq購自TaKaRa。
1.5指標檢測
1.5.1生化指標采用日本OLYMPUS公司AU2700型全自動生化檢測儀檢測丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、總膽固醇(TC)、TG、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C),空腹血糖(FBG)。
1.5.2IR評價方法血清胰島素采用放射免疫方法進行檢測,穩態模型IR指數(HOMA-IR)計算方法為:HOMA-IR=空腹血糖×空腹血清胰島素/22.5。
1.5.3肝組織行病理學檢查將取出的肝組織,大小約2 cm×2 cm×0.3 cm,用4%甲醛溶液固定,制備石蠟切片,行HE染色,觀察肝細胞脂肪變性程度、炎性活動度及肝纖維化的程度,相關標準參照Dixon等[6]提出的肝細胞脂肪變分級方法及2000年全國肝病會議通過的肝纖維化分期方法[7]。
1.5.4氯仿∶甲醇(2∶1)肝臟勻漿液的制備及TG含量測定稱取適量肝臟組織,放入玻璃勻漿管中,加入3倍體積的甲醇,1 500 r/min電動勻漿5 min,倒入具塞離心管中,再加入6倍體積的氯仿,漩渦混合器混勻,制備10%的組織勻漿,根據TG測定試劑盒對TG含量進行測定。
1.5.5肝臟FGF21 mRNA表達水平檢測肝臟RNA提取和cDNA合成:組織RNA提取參考所附步驟。所有RNA光密度分析結果260 nm/280 nm均在1.8~2.2之間。按照逆轉錄試劑盒說明書合成cDNA。PCR反應采用SYBRGreen試劑(ABI公司,美國),在ABI 7300 Real Time PCR儀上設定反應條件,反應條件為:95 ℃ 30 s變性,95 ℃ 5 s,60 ℃ 31 s,45個循環。目的基因mRNA表達水平相對定量與分析:反應結束后,ABI7300 SDS Software自動分析熒光信號并將其轉換Ct值。Ct值取三復管平均值。△Ct為目的基因Ct值與內參Ct值的差值。引物設計和合成:所有基因序列均從GenBank中獲取,引物用Primer 5.0軟件進行設計,上海閃晶公司合成。引物序列見表1。
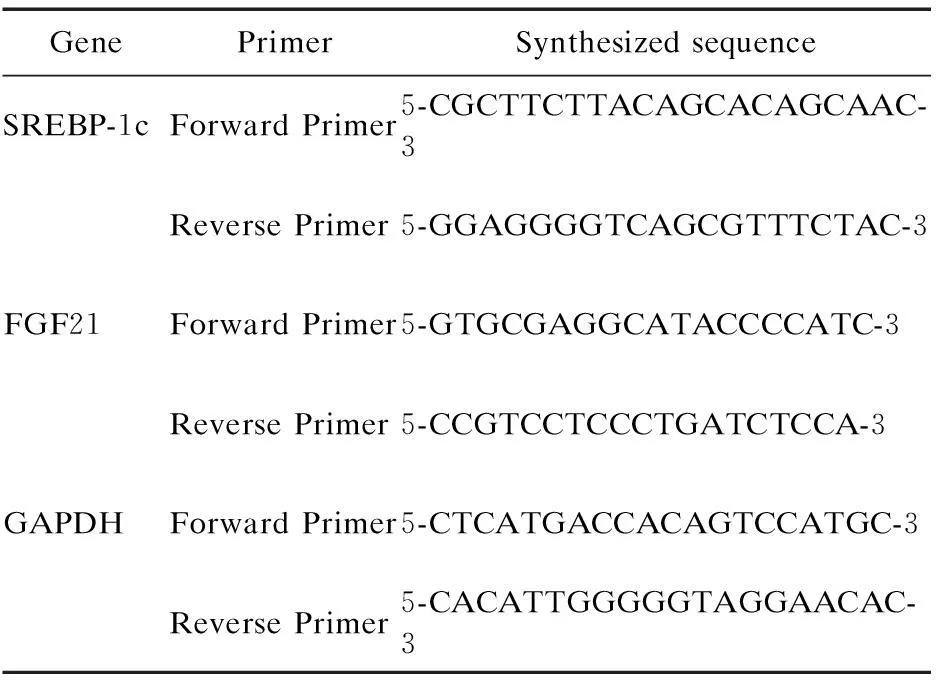
表1 引物序列
2結果
2.18周后兩組大鼠相關指標比較8周后HF組大鼠體重、肝臟濕重及肝指數高于NC組,差異有統計學意義(P<0.05),提示造模成功。HF組大鼠血清FINS、FFA、AST、ALT、TG、TC,肝臟TG、HOMA-IR和FGF21明顯高于NC組(P<0.05),而兩組FBG差異無統計學意義。見表2。
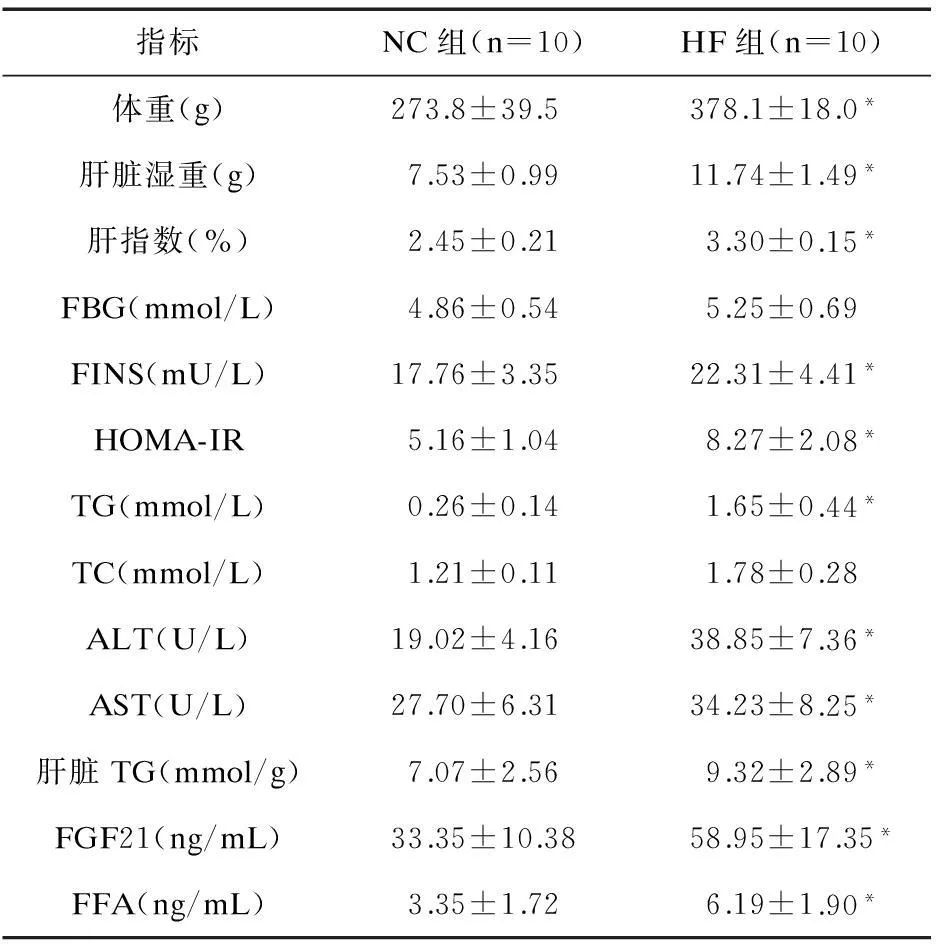
表2 8周后兩組大鼠相關指標比較
注:與NC組比較,*P<0.05
2.28周后兩組肝臟組織學及病理觀察肉眼觀察NC組大鼠肝臟形態正常。HF組大鼠第8周起肝臟外形稍飽滿圓鈍,色紅,質地較脆。光鏡觀察:8周后NC組肝小葉結構完整,輪廓清晰,肝細胞以中央靜脈為中心呈放射狀排列,肝小葉肝細胞分界清晰,胞核圓,位于細胞中央,胞質豐富,未見肝細胞脂肪變性或壞死及炎性細胞浸潤;HF組肝小葉結構模糊,肝索放射狀排列不明顯,大部分細胞腫脹,胞核消失或被脂肪空泡。
2.3藥物干預8周后各組生化指標、FGF21、FFA測定及胰島素抵抗指數的比較見表3。
2.4肝組織形態學及病理觀察
2.4.1肝組織形態學灌胃8周末,肉眼觀察NC組大鼠肝臟形態正常;HF組大鼠肝臟外形稍飽滿圓鈍,色變黃,肝臟體積明顯增大,包膜緊張,觸之有油膩感。二甲雙胍及西格列汀組肝臟色澤暗黃,較單純高脂組肝臟體積縮小,但仍有部分油脂沉積。
2.4.2光鏡下HE染色HF組呈漁網狀,肝小葉內及匯管區可見大量以單核、淋巴細胞為主的炎癥細胞浸潤及點狀壞死,所有標本均未見肝纖維化。HF+M組肝小葉結構紊亂,但肝細胞空泡樣變及胞漿疏松化略有減輕,未見肝細胞壞死;而HF+XI組肝小葉結構基本正常,無肝細胞脂滴及細胞氣球樣變,無明顯炎癥細胞浸潤,明顯優于HF+M組。見圖1~圖3。
2.5FGF21與SREBP-1c mRNA表達HF組肝SREBP-1c及FGF21 mRNA表達明顯高于NC組,差異有統計學意義(P<0.05)。與HF組相比,二甲雙胍干預后,FGF21 mRNA表達量明顯增多(P<0.05),而SREBP-1c mRNA表達量下降(P<0.01);西格列汀干預后,FGF21 mRNA表達量、SREBP-1c mRNA表達量均下降(P<0.01)。
3討論
NAFLD指除外酒精及其他明確肝臟損害因素,由遺傳-環境-代謝應激相關因素聯合所致的脂質特別是TG在肝細胞沉積導致彌漫性肝細胞脂肪變為主要特征的臨床病理綜合征。NAFLD人群是T2DM及心血管疾病(CVD)的高危人群。究其原因,胰島素抵抗為NAFLD及T2DM的共同發病中心環節,而二甲雙胍具有明確的改善IR及調節糖脂代謝的作用,從而用于NAFLD的治療。臨床觀察也發現,對合并NAFLD的T2DM患者,使用二肽基肽酶Ⅳ(DPP-4)單藥或聯合干預治療后,在血糖下降的同時,血脂、肝功能也有較明顯的改善[8-9],但確切的機制尚不清楚。本研究發現,使用DPP-4抑制劑西格列汀可明顯改善NAFLD大鼠肝臟脂肪變,效果優于二甲雙胍;二甲雙胍對改善IR的作用明顯優于西格列汀;同時,二甲雙胍能顯著降低血清AST、ALT、TG、TC、FFA、FBG及肝臟TG含量,且效果優于西格列汀。
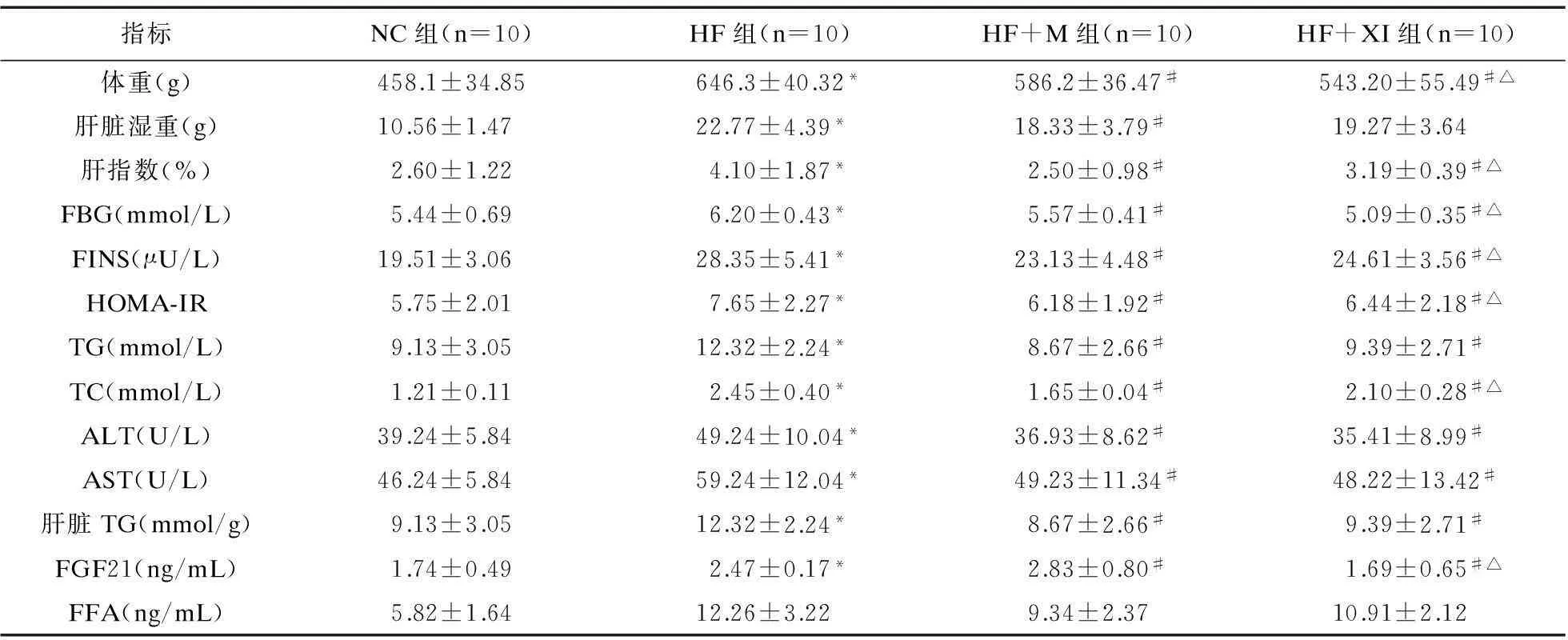
表3 藥物干預8周后各組生化指標、FGF21、FFA測定及胰島素抵抗指數的比較
注:與NC組比較,*P<0.05;與HF1組比較,#P<0.05;與HF+M比較,△P<0.05
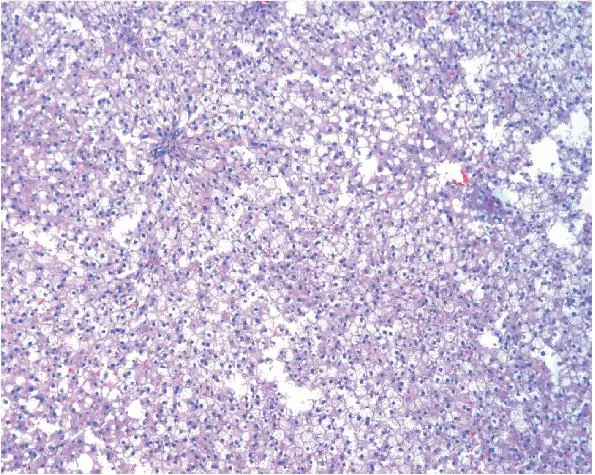
圖1 16周HF1組(HE,×100)
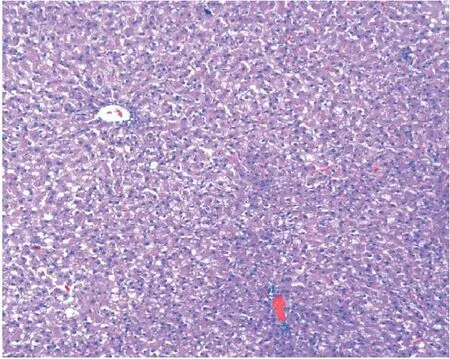
圖2 16周HF+M組(HE,×100)
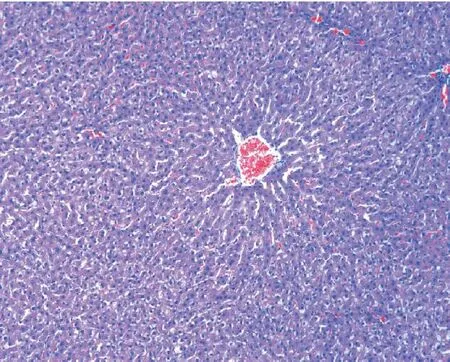
圖3 16周HF+XI(HE,×100)
FGF21主要由肝組織、脂肪組織和胰腺分泌,其具有內源性調節糖脂代謝及胰島素分泌調控的作用;以往研究發現,血清FGF21水平在非酒精性脂肪肝患者中明顯增高[10-12]。顏紅梅等[13]證實,NAFLD患者血清FGF21水平是反應非酒精性脂肪肝患者肝臟脂肪含量的潛在性生物學指標,FGF21濃度與肝臟脂肪含量有關。此外,在對白種人進行的為期5.3年的隨訪中,發現FGF21是代謝綜合征和T2DM的獨立預測因子[14]。筆者既往研究發現,血清FGF21與肝臟FGF21 mRNA變化呈一致性,且早期脂肪肝階段FGF21 mRNA與肝臟TG含量呈正相關性,故血清FGF21可以作為NAFLD的早期診斷預測因子。
作為脂代謝異常-非酒精性脂肪肝形成的主要發病機制之一[15-16],SREBP-1c在脂質代謝及沉積發揮關鍵作用。SREBP-1c屬于堿性-螺旋-環-螺旋-亮氨酸鋅超家族的一員,是一種核轉錄因子,在人類和嚙齒類動物中,SREBP-1c主要在肝臟和脂肪細胞表達,它通過作用其靶基因FAS和乙酰輔酶A羧化酶來調控體內的脂肪合成,與肝臟脂質沉積有關[17]。NAFLD患者肝活檢組織SREBP-1c mRNA表達上調[17],高脂飼料喂養小鼠9個月后,肝FAS mRNA的表達和蛋白含量顯著增加,小鼠出現脂肪肝[18]。本實驗發現,高脂組大鼠肝組織SREBP-1c及FGF21 mRNA表達明顯高于正常對照組,差異有統計學意義(P<0.05)。
既往筆者觀察到在高脂喂養過程中,肝臟FGF21 mRNA表達呈現先升高后下降的變化,推測早期FGF21升高可能為保護性改變,而后期受外周胰島素抵抗的相對抑制。二甲雙胍干預后,使血清FGF21水平及肝臟FGF21 mRNA表達較高脂組明顯升高,提示此種升高是保護性反應的增強,且差異有統計學意義(P<0.05)。此結果與Nygaard等[19]的結果(作為間接的AMPK激動劑,二甲雙胍可刺激FGF21在原代肝細胞的表達)相一致。同時,二甲雙胍可顯著下調脂質代謝調控因子SREBP-1c mRNA在肝臟的表達,提示干預后肝內脂肪酸合成減少,氧化分解代謝增強。Ding等[20]及Souza等[21]研究西格列汀對高脂飲食誘導的NAFLD小鼠模型的干預療效,與高脂組相比,可使肝內脂肪含量、胰島素抵抗指數及肝組織SREBP-1/PPARa比值均下降;DING等[22]研究艾塞那肽干預ob/ob小鼠2個月的研究結果顯示,GLP-1干預增加PPARa,減少SCD-1及SREBP-1c在肝組織內的表達。本實驗發現,西格列汀可減少肝臟SREBP-1c mRNA表達,推測其可能通過有效抑制肥胖大鼠肝臟SREBP-1c基因表達,進而影響脂肪酸合成代謝,減少肝臟TG沉積及FGF21 mRNA的表達,其確切機制仍有待進一步研究。
參考文獻:
[1]Li H,Dong K,Fang Q,et al.High serum level of fibroblast growth factor 21 is an independent predictor of non-alcoholic fatty liver disease:a 3-year prospective study in China[J].J Hepatol,2013,58(3):557-563.
[2]Samuel VT,Liu ZX,Qu X,et al. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease[J].J Biol Chem,2004,279(31):32345-32353.
[3]Neuschwander-Tetri BA,Caldwell SH.Nonalcoholic steatohepatitis:summary of an AASLD Single Topic Conference[J].Hepatology,2003,37(5):1202-1219.
[4]Choudhury J,Sanyal AJ.Insulin resistance and the pathogenesis of nonalcoholic fatty liver disease[J].Clin Liver Dis,2004,8:575-594.
[5]Bugianesi E,Zannoni C,Vanni E,et al.Non-alcoholic fatty liver and insulin resistance:a cause-effect relationship[J].Dig Liver Dis,2004,36:165-173.
[6]Dixon JB,Bhathal PS,Hughes NR,et al.Nonalcoholic fatty liver disease:improvement in liver histological analysis withweight lose[J].Hepatology,2004,39:1647-1654.
[7]中華醫學會,傳染病與寄生蟲病學分會.病毒性肝炎防治方案[J].中華內科雜志,2001,40(1):62-68.
[8]Iwasaki T,Yoneda M,Inamori M,et al.Sitagliptin as a novel treatment agent for non -alcoholic fatty liver disease patients with type 2 fatty liver disease patients with type 2 diabetes mellitus[J].Hepatogastroenterology,2011,58(112):2103-2210.
[9]Flock G,Baggio LL,Longuet C,et al.Incretin receptors for glucagon-like peptide 1 and glucose-dependent insulino tropic polypeptide are essential for the sustained metabolic actions of vildagliptin in mice[J].Diabetes,2007,56(12):3006-3013.
[10]Li H,Fang Q,Gao F,et al.Fibroblast growth factor 21 levels are increased in non-alcoholic fatty liver disease patients and are correlated with hepatic triglyceride[J].Hepatol 2010,53:934-940.
[11]Dushay J,Chui PC,Gopalakrishnan GS,et al.Increased fibroblast growth factor 21 in obesity and non-alcoholic fatty liver disease[J].Gastroenterology,2010,139:456-463.
[12]Yilmaz Y,Eren F,Yonal O,et al.Increased serum FGF21 levels in patients with non-alcoholic fatty liver disease[J].Eur J Clin Invest,2010,40:887-892.
[13]Yan H,Xia M,Chang X,et al.Circulating fibroblast growth factor 21 levels are closely associated with hepatic fat content:a cross-sectional study[J].PLoS One,2011,6:e24895-e24902.
[14]Bobbert T,Schwarz F,Fischer-Rosinsky A,et al.Fibroblast growth factor 21 predicts the metabolic syndrome and diabetes type 2 mellitus in Caucasians[J].Diabetes Care,2013,36(1):145-149.
[15]范建高,鄭曉英,田麗艷,等.非酒精性脂肪性肝病大鼠血漿前列環素與血栓素的變化及其與肝臟損傷的關系[J].中華肝臟病雜志,2004,12(11):681-683.
[16]Goto T,Yoshino R,Wat anabe S.Non-alcoholic steatohepatitis(NASH).1.General concept[J].Nippon Naika Gakkai Zasshi,2006,95(1):39-45.
[17]Higuchi N,Kato M,Shundo Y,et al.Liver X receptor in cooperation with SREBP-1c is a major lipid synthesis regulator in nonalcoholic fatty liver disease[J].Hepatol Res,2008,38(11):1122-1129.
[18]Morgan K,Uyuni A,Nandgiri G,et al.Altered expression of transcription factors and genes regulating lipogenesis in liver and adipose t issue of mice with high fat diet-induced obesity and nonalcoholic fatty liver disease[J].Eur J Gastroenterol Hepatol,2008,20(9):843-854.
[19]Nygaard EB,Vienberg SG.Metformin stimulates FGF21 expression in primary hepatocytes[J].Exp Diabetes Res,2012,2012:465282-465290.
[20]Ding X,Saxena NK,Lin S,et al.Exendin-4,a glucagon-like protein-1(GLP-1)receptor agonist,reverseshepatic steatosis in ob/ob mice[J].Hepatology,2006,43(1):173-181.
[21]Souza MV,Bianca M,Orio G,et al.Comparative effects of telmisartan,sitagliptin and metformin alone or in combination on obesity,insulin resistance,and liver and pancreas remodelling in C57BL/6 mice fed on a very high-fat diet[J].Clin Sci,2010,119(6):239-250.
[22]Shirakawa J,Fujii H,Ohnuma K,et al.Diet-induced adipose tissue inflammation and liver steatosis are prevented by DPP-4 inhibition in diabetic mice[J].Diabetes,2011,60(4):1246-1257.
Influence of metformin and sitagliptin on the expression of SREBP-1c mRNA and FGF21 mRNA in liver tissue of NAFLD rats
SHEN Tian,YU Ming*,ZHANG Zhi-jian,XU Bi-lin,ZHANG Cui-ping
(Department of Endocrinology,Shanghai Putuo District Center Hospital,Shanghai 200062,China)
[Abstract]ObjectiveTo compare the effect of metformin and sitagliptin on the expression of liver SREBP-1c mRNA and FGF21 mRNA in rats induced by high fat-diet.MethodsSixty SD rats were randomly divided into two groups:normal control group (NC group,n=20,fed with normal diet),high fat group (HF group,n=40,fed with high fat diet),after 8-week feeding,10 rats were randomly selected from two groups respectively,and NAFLD model of HF group was confirmed to be built successfully compared with NC group.Rats in HF group was divided into 3 groups:metformin treatment group (HF+M,n=10) [plus metformin 500 mg/(kg·d)],sitagliptin treatment group (HF+XI,n=10) [only sitagliptin 10 mg/(kg·d)] and HF1 group (n=10) (only an equal volume of saline).The serum contents of alanine transferase (ALT),aspartate aminotransferase (AST),total cholesterol (TC),total glyceride (TG) and free fatty acid (FFA) were detected after 8-week lavage;the fasting serum glucose and insulin (FINS) level were measured and the insulin resistance index (HOMA-IR) was calculated;HE staining was carried out to observe the liver pathological changes and the expression levels of FGF21 and SREBP-1c mRNA were measured using Real-time PCR.ResultsIn all treatment groups,the serum content of ALT,AST,TC,TG,FFA and TG and HOMA-IR were reduced significantly (P<0.05),the pathological changes of the rat liver were reduced significantly by sitagliptin,which was significantly better than metformin,the expression of SREBP-1c mRNA in the liver was reduced by the metformin and FGF21 mRNA was increased,but the expression of SREBP-1c mRNA and FGF21 mRNA in the liver was also reduced significantly by sitagliptin (P<0.01).ConclusionSitagliptin and metformin can effectively reduce the content of TG in the liver,but the liver pathological changes improved by sitagliptin are better than by metformin,while metformin can reduce HOMA-IR more significantly than sitagliptin;and both of them can change SREBP-1c and FGF21 mRNA expression in the liver tissue in different degree.
Key words:Metformin;Sitagliptin;Non-alcoholic fatty liver disease
收稿日期:2015-10-10
基金項目:上海中醫藥大學后備業務專家培養;上海市衛生局項目
*通信作者
DOI:10.14053/j.cnki.ppcr.201605002

