銅綠假單胞菌群體感應(yīng)效應(yīng)系統(tǒng)細菌毒力調(diào)節(jié)的研究進展
陳雙紅,陳銳勇,徐雄利,肖衛(wèi)兵
?
·綜述與講座·
銅綠假單胞菌群體感應(yīng)效應(yīng)系統(tǒng)細菌毒力調(diào)節(jié)的研究進展
陳雙紅,陳銳勇,徐雄利,肖衛(wèi)兵
[關(guān)鍵詞]銅綠假單胞菌;群體感應(yīng)系統(tǒng);感染;適應(yīng)性
銅綠假單胞菌分布廣,發(fā)病率、致死率高,是院內(nèi)感染的第三大病原。銅綠假單胞菌有超過10%的基因組動態(tài)多變,隨環(huán)境改變展示極強的種群遺傳進化功能,以使其適應(yīng)不同生長環(huán)境[1-2]。其中,群體感應(yīng)效應(yīng)(quorum-sensing, QS)系統(tǒng)是其種內(nèi)及種間相互交流、并完成生物學(xué)特性適應(yīng)性表達的關(guān)鍵基因族群。QS系統(tǒng)接受環(huán)境信號激活后可調(diào)節(jié)銅綠假單胞菌300多個毒力基因,包括:細菌生長、運動、鞭毛形成、分泌系統(tǒng)、生物被膜形成因子及參與細菌與宿主間的相互作用等關(guān)鍵致病環(huán)節(jié)。另外,QS系統(tǒng)調(diào)節(jié)生物被膜形成是銅綠假單胞菌臨床頑固性耐藥菌株產(chǎn)生的主要原因[3]。故,銅綠假單胞菌QS系統(tǒng)調(diào)節(jié)效應(yīng),與細菌致病和宿主逃避等行為密切相關(guān),一直是臨床細菌抗感染研究的熱點[4-5]。
1銅綠假單胞菌QS系統(tǒng)組成
銅綠假單胞菌的QS系統(tǒng)是一個依賴于種群內(nèi)細胞密度而被激活的基因調(diào)控系統(tǒng),通過產(chǎn)生自誘導(dǎo)復(fù)合調(diào)節(jié)子調(diào)控下游靶基因,實現(xiàn)種群環(huán)境適應(yīng)性生存。迄今認為,銅綠假單胞菌QS系統(tǒng)至少包括三套子系統(tǒng),即AHL(N-acylated homoserine lactones,AHLs)信號依賴系統(tǒng):las系統(tǒng),rhl系統(tǒng);AQ信號依賴的PQS系統(tǒng)[4-5](圖1)。
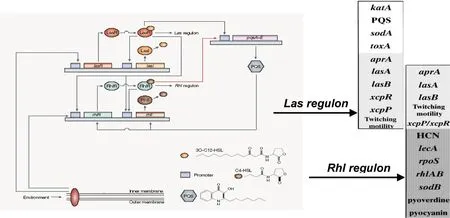
圖1 環(huán)境信號觸發(fā)銅綠假單胞菌QS系統(tǒng)響應(yīng)的級聯(lián)調(diào)控示意圖
1.1AHL信號依賴的QS系統(tǒng)QS系統(tǒng)的核心子系統(tǒng)是AHL信號依賴的las/rhl系統(tǒng)[2,6-7]。las系統(tǒng)由lasI、lasR和信號分子3OC12-HSL(N-3-oxo-dodecanoyl-homoserine lactone, 3OC12-HSL)構(gòu)成,rhl系統(tǒng)由rhlI、rhlR和信號分子C4-HSL(N-butanoyl-homoserine lactone, C4-HSL)構(gòu)成。在las/rhl系統(tǒng)中I基因編碼合成酶I蛋白,催化酰基載體蛋白酰基側(cè)鏈與S-腺苷蛋氨酸高絲氨酸側(cè)鏈生成AHL信號分子。AHL信號分子細胞外濃度達到一定,進入細胞內(nèi)與R基因編碼的R蛋白結(jié)合形成復(fù)合調(diào)節(jié)子,啟動對下游靶基因的調(diào)控。lasR/3OC12-HSL復(fù)合子主要調(diào)節(jié)堿性蛋白酶、外毒素A、彈性蛋白酶等細胞主要急性毒力因子的基因轉(zhuǎn)錄表達;rhlR/ C4-HSL復(fù)合子則指導(dǎo)鼠李糖脂溶血素、幾丁質(zhì)酶、氰化物、綠膿菌素等細胞外次級代謝物質(zhì)的產(chǎn)生,其調(diào)節(jié)作用滯后于lasR/3OC12-HSL復(fù)合子。
1.2AHQ信號依賴的QS系統(tǒng)喹諾酮類[2-alkyl-4(1H)-quinolone, AHQ]信號分子系統(tǒng),是近期發(fā)現(xiàn)的銅綠假單胞菌第三套QS系統(tǒng)。由Pqs操縱子基因pqsABCDEH的產(chǎn)物指導(dǎo)細胞中的鄰氨基苯甲酸合成4-羥基-2庚基-喹諾酮(4-hydroxy-2-heptylquinoli ne,HHQ)分子,同時該操縱子受轉(zhuǎn)錄調(diào)節(jié)子PqsR調(diào)控以維持信號分子的生理穩(wěn)定性。PQS信號分子是由加單氧化酶催化HHQ生成,該酶的生成受pqsH操縱子產(chǎn)物調(diào)節(jié),從而進一步調(diào)控PQS信號分子水平。PqsR/PQS復(fù)合調(diào)節(jié)子的主要功能是調(diào)節(jié)細菌密度及毒力因子釋放相關(guān)基因的功能[2,6-7]。
1.3其他信號分子依賴的QS系統(tǒng)除外AHL和AHQ信號依賴QS系統(tǒng),近年來還有報道將GacS/GacA系統(tǒng)作為銅綠假單胞菌QS的另一種輔助系統(tǒng)[2-3]。該系統(tǒng)的具體構(gòu)成和調(diào)控機制尚待明確,但已證明其能夠提高細菌運動能力、釋放可可堿醋酸鈉、促進生物被膜形成。
2銅綠假單胞QS系統(tǒng)調(diào)節(jié)
2.1QS系統(tǒng)內(nèi)的級聯(lián)調(diào)節(jié)銅綠假單胞菌QS系統(tǒng)內(nèi)存在嚴格的等級分層調(diào)控,las系統(tǒng)位于QS系統(tǒng)內(nèi)級聯(lián)調(diào)節(jié)的最上游。lasR/3OC12-HSL調(diào)節(jié)子正反饋調(diào)節(jié)lasI,rhlI和rhlR的基因表達。同時,細胞內(nèi)存在由RsaL蛋白介導(dǎo)的負反饋回路,調(diào)節(jié)lasR/3OC12-HSL的功能。亦即,通過RsaL轉(zhuǎn)錄調(diào)節(jié)抑制子與rsaL-lasI雙向啟動子結(jié)合抑制lasI基因轉(zhuǎn)錄,使細胞中3OC12-HSL維持穩(wěn)態(tài)水平,進而維持lasR/3OC12-HSL復(fù)合調(diào)節(jié)子正反饋回路的平衡穩(wěn)定性。RsaL與lasR/3OC12-HSL調(diào)節(jié)子在rsaL-lasI雙向啟動子DNA序列上的結(jié)合位點是毗鄰而非競爭性,且RsaL調(diào)節(jié)子活性優(yōu)先于lasR/3OC12-HSL的激活調(diào)節(jié)。不僅如此,RsaL還直接與QS系統(tǒng)調(diào)節(jié)的下游毒力基因(如:綠膿菌素等)的啟動子區(qū)域結(jié)合,可直接調(diào)節(jié)毒力基因的功能[2-3,8-11]。
另外,las系統(tǒng)同時參與調(diào)節(jié)PQS系統(tǒng),其中l(wèi)asR/3OC12-HSL調(diào)節(jié)子激活pqsH操縱子功能,促進HHQ向PQS信號分子的轉(zhuǎn)化,同時AHQ系統(tǒng)中的pqsABCD和PqsR的轉(zhuǎn)錄活性受rhlR/C4-HSL復(fù)合調(diào)節(jié)子的抑制。從而PQS系統(tǒng)信號分子的合成受las和rhl控制,同時PQS信號分子濃度影響las和rhl系統(tǒng)的基因表達,兩者之間存在精細生理學(xué)平衡關(guān)系。這一序貫性級聯(lián)調(diào)節(jié)決定las/rhl系統(tǒng)在銅綠假單胞菌QS系統(tǒng)的看家基因(home gene)地位,從而是其環(huán)境適應(yīng)和調(diào)節(jié)的中心環(huán)節(jié)[4-5,8-14]。
2.2細菌全局調(diào)控因子對QS系統(tǒng)的調(diào)節(jié)除外QS系統(tǒng)內(nèi)自反饋調(diào)節(jié),銅綠假單胞菌QS系統(tǒng)還受細菌內(nèi)源性全局調(diào)控因子的調(diào)節(jié)[14]。GacA被認為是QS系統(tǒng)最重要的全局調(diào)控因子,GacA蛋白正調(diào)控lasR和rhlR啟動子;全局轉(zhuǎn)錄調(diào)節(jié)因子AlgR2則與lasR和rhlR啟動子區(qū)結(jié)合,負向調(diào)節(jié)lasR和rhlR的轉(zhuǎn)錄活性;cAMP受體蛋白家族成員之一的Vfr蛋白,是細菌能量代謝和生長活性狀態(tài)的感應(yīng)因子,直接參與lasR基因的表達調(diào)控,也部分參與rhlR基因的活性調(diào)節(jié)。lasI基因的表達和轉(zhuǎn)錄水平分別受Vfr蛋白和rsaL的調(diào)節(jié)影響。ppK基因編碼的多聚磷酸激酶正向調(diào)節(jié)QS信號分子3OC12-HSL和C4-HSL合成,轉(zhuǎn)錄起始因子σ家族的RpoN和RpoS對維持細胞內(nèi)子3OC12-HSL和C4-HSL水平的穩(wěn)定性有重要作用。同時,全局調(diào)節(jié)因子GacA還調(diào)節(jié)著另外2個與LuxR同源的R蛋白QscR 和 VqsR的合成。QscR蛋白不僅能抑制lasI基因轉(zhuǎn)錄水平,而且在AHLs信號分子缺失情況下,通過形成同源多聚體或與lasR和rhlR蛋白形成異源二聚體對QS系統(tǒng)進行精細調(diào)節(jié),其調(diào)節(jié)功能與其他內(nèi)源性性調(diào)節(jié)子的調(diào)節(jié)功能協(xié)調(diào)統(tǒng)一。研究還表明,在AHLs基因缺失細胞中,如果同時沉默VqsR基因功能,可以大大降低銅綠假單胞菌內(nèi)毒力因子水平及其致病性,亦即VqsR參與了QS系統(tǒng)及其下游基因的調(diào)節(jié)功能。
細胞內(nèi)參與調(diào)節(jié)QS系統(tǒng)的額外調(diào)節(jié)因子大致可分為3類:①正調(diào)控因子:GacA,Vfr和DksA等。②負調(diào)控因子:AlgR2,MvaT,RsmA和QscR等。③雙向調(diào)節(jié)因子:VqsR,RpoN,RpoS等。這些額外調(diào)節(jié)因子既參與QS系統(tǒng)調(diào)節(jié),又參與銅綠假單胞菌生物學(xué)功能中其他基因的調(diào)節(jié)作用,同時這些額外調(diào)節(jié)因子幾乎都是環(huán)境刺激感應(yīng)因子。正是這一調(diào)節(jié)特點使得銅綠假單胞菌能在不同環(huán)境刺激中激活不同的QS精細調(diào)節(jié)通路以表達特定的基因,實現(xiàn)對環(huán)境的適應(yīng)性生長表型,從而得以在自然界中廣泛存在[4-5,8-14]。
3銅綠假單胞菌QS系統(tǒng)與感染環(huán)境適應(yīng)性調(diào)節(jié)
環(huán)境刺激誘導(dǎo)QS系統(tǒng)響應(yīng)是銅綠假單胞菌間進行種內(nèi)交流并完成生物特性適應(yīng)性表達的關(guān)鍵步驟。該系統(tǒng)接受環(huán)境信號刺激并激活調(diào)節(jié)銅綠假單胞菌10%以上的有效基因,主要包括毒力、生物膜形成、鞭毛運動、細菌與宿主間的相互作用等關(guān)鍵致病環(huán)節(jié)因子,最終實現(xiàn)利于細菌種群侵襲、定植、免疫逃避和耐藥性產(chǎn)生的有益生長表型。正是基于QS系統(tǒng)介導(dǎo)臨床特殊生理環(huán)境中銅綠假單胞菌感染適應(yīng)性中的重要作用,近年來其已成為國際研究和關(guān)注的熱點。銅綠假單胞菌對環(huán)境適應(yīng)性調(diào)節(jié)研究最為透徹的是侵入臨床CF患者并能迅速適應(yīng)CF患者肺部環(huán)境,完成急性感染到慢性遷延性感染的轉(zhuǎn)變。由于慢性適應(yīng)性感染的病菌無一例外都是頑固耐藥菌,合并銅綠假單胞菌感染已成為CF患者院內(nèi)死亡的主要原因[1,3-4]。
CF患者臨床不同感染期,銅綠假單胞菌毒力基因表達差異明顯,而這一差異主要是由細菌在不同感染期維持種群適應(yīng)性生長進化需求決定(圖2)[2]。在急性感染侵襲期細菌需要快速生長、侵入并定植于宿主。因此,環(huán)境信號主要誘導(dǎo)細菌感應(yīng)系統(tǒng)激活與侵襲相關(guān)的毒力基因(如:toxA,aprA,phzA1)、與生長定植相關(guān)的基因(如:鞭毛運動)、與逃避宿主防御功能相關(guān)基因(如:TypeⅢ分泌系統(tǒng))等的大量表達,以適應(yīng)細菌快速侵染定植的生長需要。慢性感染的臨床患者分離株中,銅綠假單胞菌的細胞外分泌產(chǎn)物明顯減少,TypeⅢ分泌系統(tǒng)功能失活,與侵襲相關(guān)的脂多糖被代之以與生物膜形成相關(guān)的表多糖,與細菌黏液樣生長表型密切相關(guān)的藻酸鹽過量表達。銅綠假單胞菌細胞外一旦產(chǎn)生大量的藻酸鹽,則可形成生物膜包圍細胞使其免遭機體巨噬細胞的吞噬,生物膜形成是細菌慢性感染和耐藥性產(chǎn)生的重要基礎(chǔ)。這些在急性感染期高表達的毒力基因出現(xiàn)表達抑制,甚至高頻失活性序列突變等是為適應(yīng)缺氧、免疫鈍化和抗生素治療壓力等CF慢性感染環(huán)境。急慢性環(huán)境刺激誘導(dǎo)銅綠假單胞菌的適應(yīng)調(diào)節(jié)機制主要有兩方面:直接的信號感應(yīng)激發(fā)精細的信號轉(zhuǎn)導(dǎo)調(diào)節(jié),持續(xù)選擇壓力誘導(dǎo)基因遺傳變異的適應(yīng)調(diào)節(jié)[11-12]。
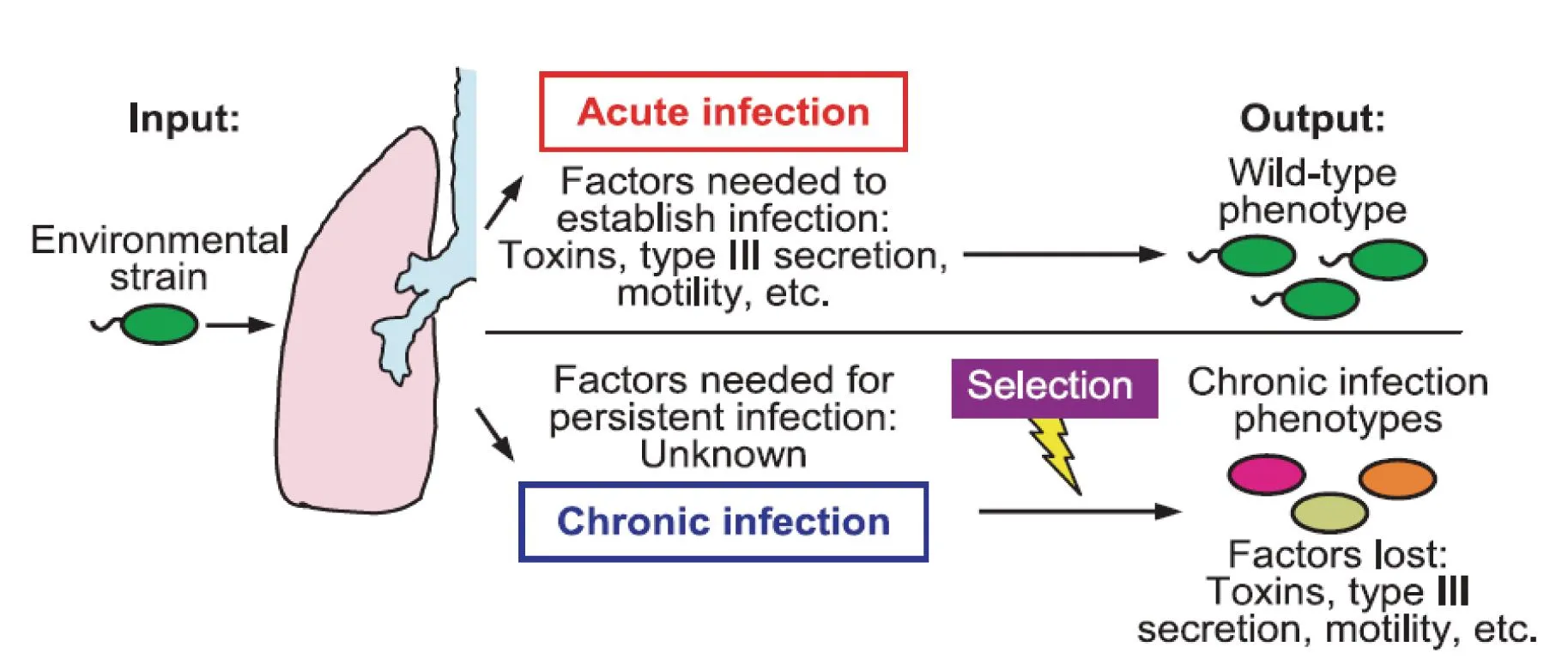
圖2 銅綠假單胞菌細胞急慢性毒力因子感染適應(yīng)性
在持續(xù)的環(huán)境選擇壓力下,QS系統(tǒng)及其調(diào)節(jié)因子的基因組遺傳信息改變是其對環(huán)境有效適應(yīng)的另一途徑。 Smith對臨床急慢性感染的銅綠假單胞菌分離株進行比較基因組學(xué)研究發(fā)現(xiàn),慢性感染分離株基因組發(fā)生大量的基因突變。基因突變的特點是以單堿基改變、1~3個堿基的插入或丟失居多,少數(shù)也出現(xiàn)大片段基因缺失,從而出現(xiàn)相應(yīng)基因編碼蛋白翻譯的提前終止、讀碼框移位、轉(zhuǎn)座子插入等。這種自然環(huán)境選擇下的非同義突變中約有2/3以上是陽性選擇性突變,直接導(dǎo)致了相應(yīng)蛋白功能的部分或全部丟失。通過對感染早期和感染96個月的分離株的比較發(fā)現(xiàn),感染晚期分離株基因突變發(fā)生率最高的是QS效應(yīng)系統(tǒng)基因,其次突變基因涉及菌體抗原合成、III型分泌因子、細菌顫動、外毒素A調(diào)節(jié)、多藥耐藥泵、滲透壓平衡和離子獲取等基因,這些基因型的改變都減低了細菌在急性感染期的毒性表型,也進一步證明這些表型的改變是為適應(yīng)CF慢性感染的缺氧、免疫鈍化和抗生素治療的環(huán)境選擇壓力[13-14]。
其中QS系統(tǒng)的lasR基因突變頻率最高。研究表明:在對CF慢性感染環(huán)境適應(yīng)過程中,lasR基因的突變至少出現(xiàn)3種有益于種群內(nèi)和種群間的生長效應(yīng):①減少lasR/ 3OC12-HSL復(fù)合調(diào)節(jié)子對急性侵襲因子的誘導(dǎo)表達,逃避宿主細胞對細菌的免疫識別;②減少對lasI基因表達的誘導(dǎo)功能,通過減少細胞自感應(yīng)分子生成,控制局部種群生長密度以減少生長信息感知。③lasR基因自身功能完全缺失,對細胞外種群間效應(yīng)分子無反應(yīng)(signal blind),出現(xiàn)種群間的隱身欺騙效應(yīng),以維持種內(nèi)生長適應(yīng)要求。除外lasR基因的高頻突變外,臨床頑固性感染株基因組還檢測到rhlR和lasI基因突變,lasR基因上游的全局調(diào)控因子Vfr基因突變頻率也很高。更有意義的是,在QS系統(tǒng)及其調(diào)節(jié)子高頻突變的菌株中,往往同時伴有Muts基因的突變,Muts基因是銅綠假單胞菌基因組中DNA堿基錯配修復(fù)基因。其基因突變導(dǎo)致的修復(fù)功能缺失,可維持特定環(huán)境下細菌自體基因組序列遺傳學(xué)適應(yīng)性穩(wěn)定,從而QS及相關(guān)毒力基因環(huán)境選擇性基因高頻突變效率得以選擇性維持[8,12]。
因此,細胞生存環(huán)境的外源信號一方面通過跨膜的信號感知系統(tǒng)激活下游的全局調(diào)控因子,幾乎都參與調(diào)節(jié)QS系統(tǒng)功能,通過激活或抑制QS系統(tǒng)功能進一步精細調(diào)控下游毒力基因的表達,實現(xiàn)銅綠假單胞菌對臨床急慢性感染環(huán)境的適應(yīng)性;另一方面慢性環(huán)境信號的選擇壓力還可以通過改變信號通路中看家基因的遺傳信息實現(xiàn)細菌對環(huán)境的定向適應(yīng)性調(diào)節(jié)。總之,感染環(huán)境誘導(dǎo)銅綠假單胞菌QS系統(tǒng)對毒力的調(diào)節(jié)作用使細菌在宿主中實現(xiàn)了 “費用-效益” 最優(yōu)化的種群生存法則。
4結(jié)語
綜上所述,諸多的環(huán)境選擇壓力可激活銅綠假單胞菌QS調(diào)節(jié)系統(tǒng),由其再進一步定向介導(dǎo)下游有效毒力基因表達,使銅綠假單胞菌出現(xiàn)強大“環(huán)境-細菌-宿主”的生存適應(yīng)表型,最終實現(xiàn)存活的“費用-效益”最優(yōu)化的種群生長法則。正是基于此,筆者認為銅綠假單胞菌在氦氧飽和高氣壓環(huán)境中出現(xiàn)快速增殖并對健康人群表現(xiàn)出高侵害表型,也可能是QS系統(tǒng)對該環(huán)境暴露的敏感響應(yīng)能力誘導(dǎo)調(diào)控下游基因所致[6]。如能準確詮釋這一調(diào)控機制,闡明銅綠假單胞菌潛水職業(yè)性高感染的原因,將對研究新的抗感染治療技術(shù)手段、控制該職業(yè)領(lǐng)域感染高發(fā)有重要意義。
[參考文獻]
[1]Hassett DJ, Sutton MD, Schurr MJ, et al. Pseudomonas aeruginosa hypoxic or anaerobic biofilm infections within cystic fibrosis airways[J]. Trends Microbiol, 2009, 17(3): 130-138.DOI:10.1016/j.tim.2008.12.003.
[2]Nguyen D, Singh PK. Evolving stealth: genetic adaptation of Pseudomonas aeruginosa during cystic fibrosis infections[J]. Proc Natl Aced Sci USA, 2006, 103(22): 8305-8306.DOI:10.1073/pnas.0602526103.
[3]Darch SE, West SA, Winzer K, et al. Density-dependent fitness benefits in quorum-sensing bacterial populations[J].Proc Natl Acad Sci USA, 2012, 109(21): 8259-8263.DOI: 10.1073/pnas.1118131109.
[4]Williams P, Cmara M. Quorum sensing and environmental adaptation in Pseudomonas aeruginosa: a tale of regulatory networks and multifunctional signal molecules[J]. Curr Opin Microbiol, 2009, 12(2): 182-191.DOI:10.1016/j.mib.2009.01.005.
[5]Verstraeten N, Braeken K, Debkumari B, et al. Living on a surface: swarming and biofilm formation[J]. Trends Microbiol, 2008, 16(10): 496-506.DOI:10.1016/j.tim.2008.07.004.
[6]Winstanley C, Fothergill JL. The role of quorum sensing in chronic cystic fibrosis Pseudomonas aeruginosa infections[J]. FEMS Microbiol Lett, 2009, 290(1): 1-9.DOI:10.1111/j.1574-6968.2008.01394.x.
[7]K?hler T, Buckling A, van Delden C. Cooperation and virulence of clinical Pseudomonas aeruginosa populations[J].Proc Natl Acad Sci USA, 2009, 106(15): 6339-6344.DOI:10.1073/pnas.0811741106.
[8]Hibbing ME, Fuqua C, Parsek MR, et al. Bacterial competition: surviving and thriving in the microbial jungle[J]. Nat Rev Microbiol, 2010, 8(1): 15-25.DOI:10.1038/nrmicro2259.
[9]Inglis RF, Gardner A, Cornelis P, et al. Spite and virulence in the bacterium Pseudomonas aeruginosa[J]. Proc Natl Acad Sci USA, 2009, 106(14): 5703-5707.DOI:10.1073/pnas.0810850106.
[10] Lee S, Hinz A, Bauerle E, et al. Targeting a bacterial stress response to enhance antibiotic action[J].Proc Natl Acad Sci USA, 2009, 106(34):14570-14575.DOI:10.1073/pnas.0903619106.
[11] Cornforth DM, Popat R, McNally L, et al. Combinatorial quorum sensing allows bacteria to resolve their social and physical environment[J]. Proc Natl Acad Sci USA, 2014, 111(11):4280-4284.DOI:10.1073/pnas.1319175111.
[12] Mathee K, Narasimhan G, Valdes C, et al. Dynamics of Pseudomonas aeruginosa genome evolution[J].Proc natl Acad Sci USA, 2008, 105(8): 3100-3105.DOI:10.1073/pnas.0711982105.
[13] Julou T, Mora T, Guillon L, et al. Cell-cell contacts confine public goods diffusion inside Pseudomonas aeruginosa clonal microcolonies[J]. Proc Natl Acad Sci USA, 2013, 110(31): 12577-12582.DOI:10.1073/pnas.1301428110.
[14] O′Loughlin CT, Miller LC, Siryaporn A, et al. A quorum-sensing inhibitor blocks Pseudomonas aeruginosa virulence and biofilm formation[J].Proc Natl Acad Sci USA, 2013, 110(44): 17981-17986.DOI:10.1073/pnas.1316981110.
(本文編輯:林永麗)
(收稿日期:2015-08-17)
[中圖分類號]R378.991
[文獻標識碼]B[DOI]10.3969/j.issn.1009-0754.2016.02.029
[基金項目]國家自然科學(xué)基金項目(NO:81271796);上海市自然科學(xué)基金項目(NO:09ZR1421000)
[作者單位]200433上海,海軍醫(yī)學(xué)研究所艦艇衛(wèi)生研究室(陳雙紅、徐雄利),高氣壓與潛水生理學(xué)全軍重點實驗室(陳銳勇、肖衛(wèi)兵)

