急性低壓缺氧大鼠腦組織中細胞紅蛋白、MDA、SOD、CAT的表達變化
楊碩,蘇暢,張永亮,3,李建宇,李靈芝,3(天津醫科大學藥學院,天津300070;武警后勤學院;3天津市職業與環境危害防制重點實驗室)
?
急性低壓缺氧大鼠腦組織中細胞紅蛋白、MDA、SOD、CAT的表達變化
楊碩1,蘇暢2,張永亮2,3,李建宇1,李靈芝2,3(1天津醫科大學藥學院,天津300070;2武警后勤學院;3天津市職業與環境危害防制重點實驗室)
摘要:目的觀察急性低壓缺氧不同時點大鼠腦海馬區細胞紅蛋白(Cygb)、丙二醛(MDA)及超氧化物歧化酶(SOD)、過氧化氫酶(CAT)表達的時序性變化特點。方法 將100只成年雄性SD大鼠隨機分為常氧對照組及低壓缺氧6、12、18、24 h組,每組20只。除常氧對照組外,其他各實驗組大鼠置于低壓缺氧艙內建立大鼠急性低壓缺氧模型。采用甲苯胺藍染色法觀察各組大鼠腦海馬區形態學改變;采用分光光度法檢測各組腦組織MDA、SOD、CAT活性。采用RT-PCR技術檢測各組腦海馬區Cygb mRNA表達。采用激光共聚焦顯微鏡觀察各組大鼠腦海馬中Cygb的熒光表達定位及時序性變化特點。結果甲苯胺藍染色顯示隨低壓缺氧時間的延長,各缺氧組大鼠腦海馬區神經細胞中胞核由藍色淡染變為藍色深染,胞質中Nissl體減少,變成粉狀或消失。與常氧對照組相比,各缺氧組大鼠腦組織中MDA水平上升,SOD、CAT活性均降低,P均<0.05。免疫熒光化學染色顯示各缺氧組大鼠海馬區神經細胞中Cygb熒光強度隨缺氧時間延長而逐漸增加。Cygb mRNA表達隨缺氧時間的延長逐漸增加(P均<0.05),且呈時間依賴性。結論 急性低壓缺氧大鼠腦海馬區Gygb表達、MDA水平升高,SOD、CAT活性降低,且隨缺氧時間的延長而變化。
關鍵詞:低壓缺氧;細胞紅蛋白;氧化應激;海馬組織;大鼠
研究[1,2]表明,急性缺氧或長期處于慢性缺氧環境均可能導致腦組織不可逆性損傷。缺氧可誘導大鼠腦組織中細胞紅蛋白(Cygb)應激性增加,對腦缺氧損傷起保護作用[3,4]。但目前尚未見關于急性低壓缺氧后腦海馬區Cygb的表達定位、時序性變化及其與損傷關系的研究報道。2015年2~9月,我們建立大鼠急性低壓缺氧模型,通過組織學觀察、大鼠腦組織丙二醛(MDA)水平及超氧化物歧化酶(SOD)、過氧化氫酶(CAT)活性及海馬區Cygb檢測,研究大鼠腦海馬組織的缺氧損傷情況及Cygb表達水平變化,探討Cygb與高原缺氧性腦損傷的關系。
1材料與方法
1.1材料藥品與儀器:考馬斯亮藍G250試劑盒、CAT試劑盒、SOD試劑盒、MDA試劑盒(南京建成生物工程公司);山羊抗Cygb多克隆抗體(santa cruz)、正常兔血清、TRITC標記兔抗山羊IgG(北京中杉生物有限公司);抗熒光衰減封片劑(北京Applygen公司);TaKaRa RNA PCR Kit (AMV) Ver.3.0試劑盒、DL-2000 Markers(寶生物工程有限公司);TRIzol Reagent(Invitrogen公司,美國)。數控低壓缺氧艙(煙臺宏遠氧業有限公司);高速低溫離心機(Eppendorf公司,德國);超低溫冰箱(Sanyo公司,日本);組織切片機(Leica公司,德國);E-510型多功能顯微鏡(Olympus公司,日本)。動物:體質量290~320 g清潔級成年雄性SD大鼠100只(軍事醫學科學院實驗動物中心)。
1.2急性低壓缺氧損傷模型的建立及分組運用隨機數字表法將100只大鼠隨機分為5組,分別設為常氧對照組、低壓缺氧6 h組、低壓缺氧12 h組、低壓缺氧18 h組和低壓缺氧24 h組,每組20只。飼養7 d適應環境。除常氧對照組外,各組大鼠均入艙進行低壓缺氧。調節艙內壓力在20 min內降至真空度-0.06 MPa(相當于海拔7 000 m大氣壓力)。實驗過程中維持氧水平為(10±2)%,溫度為(20±3)℃,濕度為(65±5)%。實驗結束后20 min內使缺氧艙內升至正常氣壓。常氧對照組大鼠相同溫度、濕度下于艙外正常飼養。
1.3各組大鼠腦海馬區形態學觀察各組大鼠出艙后迅速于冰浴下斷頭取腦組織,用4%多聚甲醛磷酸鹽緩沖液固定,取海馬區腦組織石蠟包埋,連續切片,甲苯胺藍染色,梯度乙醇溶液脫水,二甲苯透明,中性樹脂封片,光學顯微鏡下觀察。
1.4各組大鼠腦組織中SOD、CAT活性及MDA含量檢測各組大鼠出艙后迅速于冰浴下斷頭取腦,剝除腦膜并用預冷的PBS沖凈表面血液。吸干表面水分稱重,冰浴下加PBS勻漿,離心10 min(4 ℃、3 000 r/min),吸取上清,按試劑盒說明書方法檢測樣品SOD、CAT活性及MDA水平,同時測定樣品蛋白水平。
1.5各組大鼠海馬區神經細胞中Cygb熒光強度檢測采用免疫熒光染色。將石蠟切片常規脫蠟、脫水,PBS漂洗,加0.4%胃蛋白酶37 ℃下孵育30 min,0.01 mol/L PBS漂洗、吹干,滴加10%兔血清室溫孵育30 min,滴加50 μL兔抗大鼠Cygb IgG多克隆抗體(1∶100),4 ℃孵育過夜。室溫放置30 min后用0.01 mol/L PBS漂洗。避光下滴加TFITC標記的羊抗兔抗體50 μL(1∶100),于37 ℃孵育45 min,0.01 mol/L PBS漂洗。加抗熒光衰減封片劑封片,4 ℃避光保存。空白對照用PBS代替一抗,其他處理相同。以568 nm為激發波長,617 nm為發射波長,激光共聚焦顯微鏡下觀察并攝像。Cygb陽性細胞顯示紅色熒光。
1.6Cygb mRNA表達檢測采用RT-PCR法。取大鼠海馬區腦組織約100 mg,提取總RNA,分別采用分光光度法和瓊脂糖凝膠電泳法測定RNA水平和RNA完整性。按試劑盒說明合成cDNA,產物進行PCR反應,擴增產物長度為81 bp[5]。PCR產物經瓊脂糖凝膠電泳分離,凝膠成像分析系統分析,計算各組Cygb擴增帶的吸光度(Af)與β-actin擴增帶的吸光度(Ab)間的比值。
2結果
2.1各組甲苯胺藍染色組織形態學變化常氧對照組大鼠腦海馬各區細胞形態完整,胞核呈藍色淡染,胞質中可見大量深藍色的粗顆粒狀Nissl體。低壓缺氧6 h組大鼠腦海馬CA1區神經細胞呈藍色深染,CA2、CA3、CA4區神經細胞損傷逐漸減輕,呈藍色淡染,Nissl體減少或消失。缺氧12、18和24 h組:大鼠腦海馬各區神經細胞數量明顯減少,呈不規則狀稀疏排列,大部分細胞胞核破碎,細胞均藍色深染,且Nissl體幾乎全部消失;損傷隨著缺氧時間的延長逐漸加重,且海馬各區的損傷程度以CA1區最為嚴重,CA2、CA3及CA4區損傷逐漸減輕。
2.2各組SOD、CAT活性及MDA水平變化與常氧對照組相比,各低壓缺氧組大鼠腦組織中SOD、CAT活性均降低(P均<0.01),且隨低壓缺氧損傷時間的延長逐漸遞減。與常氧對照組相比,缺氧12 h組大鼠腦組織MDA水平開始明顯上升(P<0.05),缺氧18 h組和24 h組MDA水平升高更顯著(P均<0.01)。見表1。
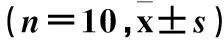
表1 各組大鼠腦組織中SOD、CAT活性及MDA水平
注:與常氧對照組相比,*P<0.05,**P<0.01;與低壓缺氧6 h組相比,#P<0.05,##P<0.01;與低壓缺氧12 h組相比,△△P<0.01;與低壓缺氧18 h組相比,▲▲P<0.01。
2.3各組免疫熒光染色結果在大鼠腦海馬組織中,Cygb免疫熒光陽性表達細胞呈紅色熒光。常氧對照組Cygb在大鼠腦海馬各區中均有微弱表達,部分海馬錐形細胞胞核和胞質中可見陽性信號出現,且主要集中于核膜和核仁周圍呈不規則分布;低壓缺氧6 h組Cygb表達增加,且在軸突及樹突中也有陽性信號出現;缺氧12 h組海馬區大部分神經細胞皺縮變形,胞核固縮或破裂,Cygb表達進一步增加;缺氧18 h和24 h組中大量錐形細胞壞死和凋亡,胞核破碎或溶解,但仍可見Cygb在胞質及胞核區表達顯著增加。
2.4各組Cygb mRNA表達比較隨低壓缺氧時間的延長,大鼠腦海馬組織中Cygb mRNA的表達逐漸增高,表現出時間依賴性;常氧對照組中Cygb mRNA呈低表達,與之相比,低壓缺氧損傷6 h組Cygb mRNA表達顯著升高(P<0.05),低壓缺氧12 h、18 h及24 h組Cygb mRNA表達進一步升高(P均<0.01)。見表2。
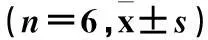
表2 各組大鼠腦海馬組織中Cygb mRNA表達
注:與常氧對照組相比,*P<0.05,**P<0.01;與低壓缺氧6 h組相比,##P<0.01;與低壓缺氧12 h組相比,△△P<0.01;與低壓缺氧18 h組相比,▲P<0.05。
3討論
Iswar等[6]研究表明,缺氧會影響大鼠腦學習和記憶功能。Mishra等[7]研究發現,負責學習和記憶等功能的海馬體對缺氧性損傷比腦皮質更為敏感。本研究發現缺氧6 h組神經細胞受損較輕,主要表現為Nissl體減少或消失。隨著缺氧時間的持續延長,海馬各區神經細胞損傷程度逐漸加重,均出現不同程度的細胞數量明顯減少,胞質藍色深染,Nissl體完全消失。且海馬各區損傷程度不同,以CA1區損傷最嚴重,CA2、CA3及CA4區損傷程度逐漸減輕,這可能是因為CA1區是海馬體對缺氧最為敏感的部位[8]。
正常細胞內存在自由基的清除系統,常見的自由基清除系統主要有SOD、CAT等。SOD是清除系統的第一道防線,可將O2-轉化為H2O2或其他氫過氧化物。CAT和其他酶共同組成第二道防線,其作用是清除過氧體系中產生的H2O2。因而測定腦組織中SOD、CAT活性可作為氧自由基生成量的間接指標[3]。當機體缺氧時,細胞中可產生大量氧自由基,過量的氧自由基可激發鏈式脂質過氧化反應,并形成脂質過氧化產物(如MDA),對細胞膜造成損傷。腦組織MDA的水平可間接反映低壓缺氧時腦組織受自由基攻擊的嚴重程度[9,10]。通過檢測腦組織中SOD、CAT活性和MDA水平可間接反映低壓缺氧導致的大鼠腦損傷程度。本研究證實,低壓缺氧可致大鼠腦組織SOD和CAT活性降低,且呈時間依賴性,與之相反,各缺氧組大鼠腦組織MDA水平與對照組相比均明顯升高,且隨缺氧時間的延長呈遞增趨勢,與腦組織病理學改變一致。提示急性低壓缺氧可引起腦組織氧自由基蓄積,破壞自由基清除系統,從而誘導大鼠腦損傷。
Cygb是攜氧球蛋白家族成員,具有儲存和傳遞氧氣的功能[11]。Schmidt 等[5]研究發現,缺氧時在腦組織某些特定區域中能觀察到Cygb表達,提示Cygb可能與腦缺氧密切相關。Avivi等[12]的研究證實了這一觀點,他們發現缺氧可誘導鼴形鼠腦組織Cygb表達上調,可能對腦缺氧損傷起到保護作用。本研究證實缺氧后大鼠腦組織Cygb mRNA水平明顯上調,與文獻結果相符,提示Cygb在保護低壓缺氧性腦損傷中起著重要作用。隨后通過免疫熒光染色法發現,常氧條件下,大鼠腦海馬組織神經細胞胞核和胞質內均有少量Cygb表達,且主要集中于核仁及核膜周圍;隨低壓缺氧時間的延長Cygb表達明顯增強,且遍布于細胞胞核、胞質及突起中,提示Cygb作為攜氧球蛋白不僅能在細胞胞質中發揮神經保護作用,亦可能作為一種核轉錄因子轉移入胞核,從而調控其他基因的表達。
綜上所述,低壓缺氧可誘導大鼠腦組織海馬各區神經細胞Nissl體減少或消失,破壞自由基清除系統,產生氧化應激損傷,最終導致低壓缺氧性腦損傷,且損傷程度隨缺氧時間的延長加劇;Cygb表達的時序性變化特點提示其可能對急性低壓缺氧性腦損傷起到保護作用。
參考文獻:
[1] Rupp T, Jubeau M, Lamalle L, et al. Cerebral volumetric changes induced by prolonged hypoxic exposure and whole-body exercise [J]. J Cereb Blood Flow Metab, 2014,34(11):1802-1809.
[2] Moore LG, Harrison GL, McCullough RE, et al. Low acute hypoxic ventilator response and hypoxic depression in acute altitude sickness[J]. J Appl Physiol, 1986,60(4):1407-1412.
[3] Fordel E, Geuens E, Dewilde S, et al. Hypoxia/ischemia and the regulation of neuroglobin and cytoglobin expression[J]. IUBMB Life, 2004,56(11-12):681-687.
[4] Geuens E, Brouns I, Flamez D, et al. A globin in the nucleus. J Biol Chem, 2003,278(33):30417-30420.
[5] Schmidt M, Gerlach F, Avivi A, et al. Cytoglobin is a respiratory protein in connective tissue and neurons, which is up-regulated by hypoxia[J]. J Biol Chem, 2004,279(9):8063-8069.
[6] Iswar B, Satya ND, Vishal J. Corticosterone synthesis inhibitor metyrapone ameliorates chronic hypobaric hypoxia induced memory impairment in rat [J]. Behavioural Brain Res, 2012, 228(1): 53-65.
[7] Mishra OP, Delivoria-Papadopoulos M. Cellular mechanisms of hypoxic injury in the developing brain[J]. Brain Res Bull, 1999,48(3):233-238.
[8] Kihara S, Shiraishi T, Nakagawa S, et al. Visualization of DNA double strand breaks in the gebil hippocampus CA1 following transient ischemia[J]. Neurosci Let, 1994,175(1-2):133-136.
[9] Chauhan N, Zhao ZH, Barber PA, et al. Lessons in experimental ischemia for clinical stroke medicine[J]. Curr Opin Neurol, 2003,16(1):65-71.
[10] Roesner A, Hankeln T, Burmester T. Hypoxia induces a complex response of globin expression in zebrafish (Danio rerio) [J]. J Exp Biol, 2006,209(11):2129-2137.
[11] Burmester T, Ebner B, Weich B, et al. Cytoglobin: A Novel Globin Type Ubiquitously Expressed inVertebrate Tissues[J]. Mol Biol Evol, 2002,19(4):416-421.
[12] Avivi A, Gerlach F, Joel A, et al. Neuroglobin, cytoglobin, and myoglobin contribute to hypoxia adaptation of the subterranean mole rat Spalax[J]. Proc Natl Acad Sci USA, 2010,107(50):21570-21575.
(收稿日期:2015-11-05)
中圖分類號:R651.15
文獻標志碼:A
文章編號:1002-266X(2016)13-0030-03
doi:10.3969/j.issn.1002-266X.2016.13.011
通信作者:李靈芝(E-mail:13682196000@163.com)
基金項目:國家自然科學基金資助項目(81471823);天津市重點基金資助項目(12JCZDJC34700);武警后勤學院創新團隊課題(WHTD201303)。

