化學平衡常數的應用分析
?
化學平衡常數的應用分析
◇陜西王明果
化學平衡常數是高中化學中十分重要的基礎理論,在近些年的高考試題中,對化學平衡常數相關知識的考查穩中有升,因此,需要加強化學平衡常數相關知識的教學,提升學生對“化學平衡常數”的實際應用能力.
1化學平衡常數相關知識
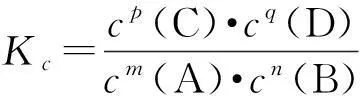
在利用化學平衡常數進行相關問題解答時,需要注意4個方面的問題.
1) 稀溶液中的水分子濃度可忽略不計,因為稀溶液的密度十分接近1 g·mL-1.在化學反應的發生過程中,水量多少的改變對溶液濃度變化影響并不大,因此可以將其看作常數.對于溶劑不是水的溶液,其溶劑濃度的處理方式和水溶液相同.
2) 如果化學反應有固體物質參與,主要是在固體表面進行,固體摩爾濃度對化學反應平衡和速率不會產生影響.所以,在化學反應中,固體濃度也是常數,在化學平衡常數方程中可以省略.
3) 化學方程式書寫不一樣,化學反應中各種物質的計量數也不一樣,這就會導致平衡常數發生變化.
4) 化學平衡體系不一樣,平衡常數是不一樣的.平衡常數越大,說明生成物的平衡濃度越大,化學反應越徹底.因此,可以根據化學平衡常數的大小判斷化學反應的程度.一般來說,若K>105,說明反應完全,且不可逆;若K<10-5,說明反應不進行.
2化學平衡常數的應用
2.1在基礎題目中的應用

2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),K1,ΔH<0;
2NO(g)+Cl2(g)?2ClNO(g),K2,ΔH<0.
試求: (1) 4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數K.
(2) 為了在不同條件下對第2個反應的影響進行研究,用2 L的容器進行反應,并向其加入0.1 mol Cl2, 以及0.2 mol NO,通過10 min反應達到平衡,測出v(ClNO)=7.5×10-3mol·L-1·min-1,在反應達到平衡之后Cl2的物質的量和NO的轉化率為多少?如果其他條件不變,該反應在恒壓條件下NO的轉化率與恒壓之前的轉化率相比孰大孰小?
分析對于第(1)問,將第1個反應乘以2,再減去第2個反應,就可以得出4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),因此可以求出其化學平衡常數為對于第(2)問,轉化的n(Cl2)=1/2×7.5×10-3mol·L-1·min-1×2 L×10 min=7.5×10-2mol,在反應達到平衡后,n(Cl2)=2.5×10-2mol;轉化的n(NO)=0.15 mol,則NO的轉化率為%;在恒壓條件下,由于分子數在不斷減少,因此需要不斷縮小反應體積,相當于對反應過程加壓,可以提升化學反應程度,即促使轉化率a2增大.此處可以更深入一步探究,在溫度不變的條件下,由于反應放熱,會促使反應左移,導致轉化率減小.
2.2在電離水解中的應用
在電離水解的相關題目中,對化學平衡常數的考查也比較深入.

A水電離程度不斷增大;
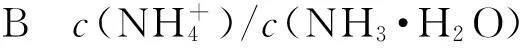
Cc(CH3COO-)和c(CH3COOH)的和一直為固定值;


(作者單位:陜西省咸陽中學)

