十字交叉法中基準物理量的選取方法
?
十字交叉法中基準物理量的選取方法
◇河北賈根堂
十字交叉法計算中易出現基準物理量選取錯誤的問題.基準物理量的選取方法有直接選取法和間接選取法,而間接選取法可以采用物理量轉化法和物質轉化法.
1問題與方法
十字交叉法是中學化學計算中的一種常用的方法,但在實際應用中存在有基準選擇不準的問題.現通過典例分析,來闡述基準的選擇方法.

分析這是我們非常熟悉的一種題型,會馬上聯想到用十字交叉法進行求解:

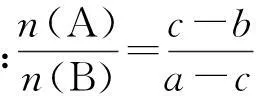
2概念的拓展與分析
1) 十字交叉法一般應用于求解二元混合物(A、B)中物質的比例關系.
2) 求解時,需知道A、B兩物質的某個物理量以及混合物中該物理量的平均值,例如摩爾質量(g·mol-1).
3) 該物理量不是國際單位制中的基本物理量,而是一個導出物理量.
4) 導出物理量是由變化的物理量(如:質量,單位是g)和基準物理量(如:物質的量,單位是mol)構成的.導出物理量等于變化物理量/基準物理量.
5) 基準物理量一般以一個單位為基準.
6) 基準物理量具有加合性(n=n(A)+n(B)),變化物理量也具有加合性(m=m(A)+m(B)).
7) A、B的導出物理量與混合物的導出物理量平均值的十字交叉之比為該導出物理量的基準物理量在A、B兩物質上產生分量的比.
3基準的物理量的選擇方法
3.1直接選擇基準物理量
一般情況是欲求A、B兩物質的哪種物理量的比值,就選擇該物理量作為基準物理量.

分析欲求H2和CO的體積比,則以氣體的體積作為基準物理量,且在相同的溫度和相同的壓強下具有加合性.氣體的質量也具有加合性,可以作為變化物理量,二者構成導出物理量即氣體的密度.
H2在標準狀況下的密度為
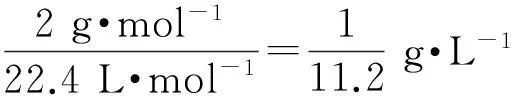
CO在標準狀況下的密度為

1 L H2、CO和混合氣體的質量為1 g,十字交叉如下:
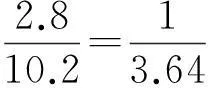
當二元混合物發生反應,有一共同的反應物或共同的變化量時,也可以用十字交叉法進行求解.

A2∶3;B1∶3;C1∶4;D1∶5
分析根據阿伏加德羅定律,“在同溫同壓同質量的情況下,氣體的體積和密度成反比”,則混合氣體燃燒后的體積為(1 L+5 L)×11/10=6.6 L.即反應后氣體體積增加了0.6 L.乙醇、乙硫醇的燃燒反應如下:
C2H5OH(g)+3 O2=2CO2+3 H2O(g)ΔV
1 L1 L
C2H5SH(g)+4.5O2=2CO2+SO2+3H2O(g)ΔV
0.5 L
0.5 L
分析以氣體的體積為基準物理量,氣體體積增加量為變化物理量,二者構成導出物理量,進行十字交叉求解.
1體積的氣體充分燃燒后,體積的變化:
故乙醇和乙硫醇的體積比為0.1/0.4=1/4.
如果變化物理量、基準物理量之一不具有加合性時,則不可用十字交叉法進行求解.

分析該題若也用十字交叉法進行求解,則就錯誤了.因為物質的量濃度這一導出物理量的基準物理量——溶液的體積不具有加合性.
3.2間接選取基準物理量
1) 物理量轉化法.

分析本題欲求Cu(NO3)2的質量分數,若能求得Cu和Cu(NO3)2的質量比即可.Cu和Cu(NO3)2的混合物在空氣中灼燒發生的反應如下:

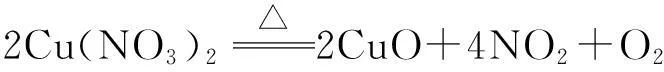
由以上反應可知,Cu和Cu(NO3)2的物質的量之和等于生成的CuO的物質的量,又因為反應前后固體的質量不變,故Cu和Cu(NO3)2的平均摩爾質量等于CuO的摩爾質量.可將求Cu和Cu(NO3)2的質量之比轉化成求Cu和Cu(NO3)2的物質的量之比.
故n(Cu)/n(Cu(NO3)2)=108/16=27/4.則
w(Cu(NO3)2)=
100%=30.32%.
2) 物質轉化法.

分析NaHCO3和Na2CO3與H2SO4的反應如下
2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O.
以NaHCO3和Na2CO3的質量為基準,H2SO4的物質的量為變化量,先求得NaHCO3和Na2CO3的質量之比進而求得其物質的量之比是可以的,但其數據計算較為煩瑣,且易出現計算錯誤.若轉化一下物質,以1 mol H2SO4為基準物理量,NaHCO3、Na2CO3的質量為變化物理量進行十字交叉計算就簡單多了.
此十字交叉的比值為H2SO4在與2種物質反應時所消耗的物質的量之比.則
n(NaHCO3)/n(Na2CO3)=(1×2)/1=2/1.


CO2+2NaOH=Na2CO3+H2O,
CO2+NaOH=NaHCO3.
在上述反應中,已知CO2和NaOH的物質的量,則CO2和NaOH的物質的量可以互為基準物理量和變化物理量.
若以1 mol CO2為基準物理量則有:
CO2在上述2個反應中消耗的物質的量之比為0.25/0.75=1/3,則
n(Na2CO3)=0.8 mol×1/4=0.2 mol,
n(NaHCO3)=0.8 mol×3/4=0.6 mol.
若以1 mol NaOH為基準物理量則有:
NaOH在上述2個反應中消耗的物質的量之比為0.2/0.3=2/3,
n(Na2CO3)=1 mol×2/5×1/2=0.2 mol,
n(NaHCO3)=1 mol×3/5=0.6 mol.
正確使用十字交叉法進行二元混合物中各成分的比例計算,首先要明確十字交叉法的有關概念,特別是基準物理量的含義.另外更為重要的是要把握基準物理量的選擇方法,只有正確地選取了基準物理量,才能快速、便捷而又準確求解所需之結果.
(作者單位:河北內丘中學)

