哮喘小鼠CD4+ CD25+調(diào)節(jié)性T細胞及相關(guān)細胞因子的變化研究*
馬祥 劉洪 梁宗安 李群英
(1.成都市第一人民醫(yī)院呼吸內(nèi)科, 四川 成都 610041;2.四川大學華西醫(yī)院呼吸內(nèi)科, 四川 成都 610041)
?
哮喘小鼠CD4+CD25+調(diào)節(jié)性T細胞及相關(guān)細胞因子的變化研究*
馬祥1劉洪1梁宗安2李群英1
(1.成都市第一人民醫(yī)院呼吸內(nèi)科, 四川 成都 610041;2.四川大學華西醫(yī)院呼吸內(nèi)科, 四川 成都 610041)
【摘要】目的探討哮喘小鼠 CD4+CD25+調(diào)節(jié)性 T 細胞(regulatory T cells,Treg) 及IL-10、TGF-β、IL-17水平的變化。方法30只雄性BALB/c小鼠被隨機分為三組:正常對照組、哮喘組及地塞米松組各10只;利用雞卵白蛋白腹腔注射、霧化吸入制備哮喘模型;取小鼠左肺組織作病理切片觀察炎癥改變;通過流式細胞儀檢測各組小鼠脾臟單個核細胞CD4+CD25+Treg細胞占CD4+T細胞的百分比;采用酶聯(lián)免疫吸附試驗檢測各組小鼠血清中細胞因子IL-1、TGF-β、IL-17表達水平。結(jié)果哮喘組小鼠的脾單個核細胞CD4+CD25+Treg細胞百分比以及IL-10、TGF-β的表達水平較正常對照組降低(P<0.05),哮喘組IL-17的表達水平較正常對照組增高(P<0.05),地塞米松組與正常對照組比較,差異無統(tǒng)計學意義(P>0.05)。結(jié)論哮喘小鼠體內(nèi)CD4+CD25+Treg數(shù)量的減少以及功能的下降、細胞因子IL-17表達的增加均參與了哮喘的發(fā)病過程。
【關(guān)鍵詞】哮喘; CD4+CD25+調(diào)節(jié)性 T 細胞; IL-10; TGF-β;IL-17
The expression of CD4+CD25+regulatory T cells,IL-10, TGF-β and IL-17 in asthmatic miceMA Xiang1, LIU Hong1,LIANG Zong’an2,etal
(1.DepartmentofRespiratory,TheFirstPeople’sHospitalofChengdu,Chengdu610041,China;
2.DepartmentofRespiratorydiseases,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
【Abstract】ObjectiveTo discuss the expression of CD4+CD25+regulatory T cells (Treg), IL-10, TGF-β and IL-17 in asthmatic mice. Methods30 male BALB/c mice were randomly assigned to the control group,the asthma group and the dexamethasone group. Tissues of left lung were obtained from mice to observe pathological changes.Flow cytometry was used to detect the percentage of CD4+CD25+Treg in CD4+T cells. The levels of serum IL-10,TGF-βand IL-17 were detected by ELISA. ResultsThe percentage of CD4+CD25+Treg, IL-10 and TGF-βin asthma group decreased significantly (P<0.05). The expression of IL-17 in asthma group increased significantly(P<0.05). The difference was not significant between the control group and the dexamethasone group (P>0.05).ConclusionThe number of CD4+CD25+Treg in asthmatic mice reduces, the function declines, and the increase of expression of IL-17 involves in the pathogenesis of asthma.
【Key words】Asthma; CD4+CD25+regulatory T cells; IL-10; TGF-β;IL-17
哮喘是一種復雜的氣道炎癥性疾病,以神經(jīng)遞質(zhì)、炎癥介質(zhì)和吸入的收縮性刺激物導致支氣管過度收縮為特征。在T淋巴細胞亞群中,調(diào)節(jié)性 T 淋巴細胞(regulatory T cells,Treg)是其中的一類,它具有免疫抑制功能,能維持機體對自身抗原的免疫耐受,能預防自身免疫性疾病,在過敏性疾病中,能調(diào)節(jié)并避免過度的免疫反應(yīng),對機體具有非常重要的作用[1]。其中,CD4+CD25+Treg是Treg細胞的主要組成部分,它是自然存在于人體內(nèi)的調(diào)節(jié)性T細胞, 在外周血CD4+T淋巴細胞中約占5%~10%。IL-10、TGF-β是由CD4+CD25+Treg分泌的兩種主要的細胞因子。Th17細胞是由CD4+初始T細胞經(jīng)抗原活化,繼而分化,形成的一類功能獨立的T輔助細胞亞群。Th17細胞產(chǎn)生很多的細胞因子,如IL- 17、IL-22、IL-6、腫瘤壞死因子-α(TNF-α)等,在一些自身免疫性疾病的發(fā)生發(fā)展中,這些細胞因子發(fā)揮著非常重要的作用[2]。近年來有研究發(fā)現(xiàn),CD4+CD25+Treg以及Th17細胞通過多種途徑,介導了哮喘的發(fā)生發(fā)展過程。本研究以哮喘小鼠為對象,通過檢測哮喘小鼠體內(nèi)CD4+CD25+Treg及IL-10、TGF-β、IL-17的表達情況,以探討哮喘發(fā)生過程中可能存在的免疫學機制。
1材料與方法
1.1實驗動物健康雄性BALB/c小鼠、體重20g左右、8周齡(四川大學華西醫(yī)學院動物實驗中心),隨機分成3組:正常對照組、哮喘組、地塞米松組,每組分別10只。
1.2方法
1.2.1儀器與試劑主要實驗儀器:低溫高速離心機(德國Heraeus公司);超聲霧化器(德國Boehringger Ingelhei);CYTOMICS- FC500流式細胞儀(美國 BACK MAN COULTER 公司提供)。主要實驗試劑:雞卵蛋白(美國 Sigma 公司); 氫氧化鋁(天津三廠); 小鼠淋巴細胞分離液(天津TDB生物技術(shù)發(fā)展中心);Anti-Mouse CD4 PE-Cy5、Anti-Mouse CD25 PE及相應(yīng)同型對照等(美國eBioscience公司)。
1.2.2動物模型制備通過參照J.C. Kips[4]和Matthew E等[5]提出的方法,并適當加以調(diào)整來制備哮喘模型。正常對照組:分別在第1、8、14天腹腔注射生理鹽水0.5ml,第15天開始將小鼠置于密閉空間內(nèi),霧化吸入生理鹽水,一天一次,一次30分鐘,連續(xù)7天。哮喘組:分別在第1、8、14天腹腔注射預先制備的抗原液0.5 ml (含20μg 卵白蛋白、2.25 mg 氫氧化鋁)以致敏,第15天開始將小鼠置于密閉空間內(nèi),予1%卵白蛋白(OVA)霧化吸入激發(fā),連續(xù)7天。地塞米松組:同樣使用腹腔注射抗原液使小鼠致敏,但在霧化吸入卵白蛋白前30分鐘腹腔注射地塞米松(2.5mg/kg)。
1.2.3分離脾單個核細胞在最后一次激發(fā)結(jié)束后,通過引頸的方式處死小鼠,取出脾臟,將其剪成多個小塊,并放在細胞篩上,進行研磨、過濾,制備脾單個核細胞的懸液,并調(diào)節(jié)細胞濃度為106個細胞/ml,最后使用流式細胞儀檢測各組CD4+CD25+Treg占CD4+T細胞的百分率。
1.2.4肺病理切片制備取出小鼠的左肺,使用10%中性甲醛固定24小時后,再進行常規(guī)脫水、透明、浸蠟、包埋、切片,在HE染色后使用顯微鏡觀察各組小鼠肺組織形態(tài)、結(jié)構(gòu)。
1.2.5血清IL-10、TGF-β、IL-17水平采用ELISA雙抗體夾心法測定IL-10、TGF-β、IL-17。嚴格按照試劑盒操作說明書進行檢測。
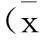
2結(jié)果
2.1各組肺組織病理哮喘組:在小鼠肺組織血管及氣管周圍,有大量淋巴細胞、嗜酸性細胞等炎性細胞浸潤,粘膜上皮存在不同程度的壞死、脫落。正常對照組:小鼠肺組織支氣管粘膜上皮、肌層完好,周圍無炎性細胞浸潤,支氣管管腔規(guī)則,形態(tài)基本正常。
2.2各組小脾單個核細胞CD4+CD25+Treg的百分率哮喘組小鼠脾單個核細CD4+CD25+Treg百分率,較正常對照組、地塞米松組明顯降低(P<0.05);地塞米松組小鼠CD4+CD25+Treg百分率較哮喘組升高(P<0.05);地塞米松組小鼠CD4+CD25+Treg百分率低于正常對照組小鼠,但兩組之間的差異無統(tǒng)計學意義(P>0.05),見表1。

表1 各組小鼠脾單個核細胞 CD4+CD25+Treg百分率比較
注:與哮喘組比較①P<0.05,與正常對照比較②P>0.05
2.3血清IL-10、TGF-β、IL-17水平與正常對照組相比,哮喘組IL-10、TGF-β水平明顯減少(P<0.05),IL-17水平明顯升高(P<0.05);地塞米松組IL-10、TGF-β水平較哮喘組升高(P<0.05)、IL-17水平較哮喘組降低(P<0.05);地塞米松組與正常對照組比較,IL-10、TGF-β水平稍低、IL-17水平稍高,但兩組之間的差異無統(tǒng)計學意義(P>0.05),見表2。

表2 各組小鼠血清中細胞因子的水平±s)
注:與哮喘組比較 ①P<0.05,與對照比較②P>0.05
2.4相關(guān)性分析相關(guān)性分析表明:CD4+CD25+/CD4+與血清IL-10、TGF-β水平呈明顯正相關(guān)(r為0.352,P<0.05);CD4+CD25+/CD4+與IL-17水平呈負相關(guān)(r為-0.279,P<0.05);IL-10、TGF-β水平與IL-17呈負相關(guān)(r為-0.162,P<0.05)。
3討論
支氣管哮喘是一類慢性肺部炎癥性疾病,其發(fā)生過程中以嗜酸性粒細胞浸潤為主,由多種免疫細胞和細胞因子參與其中。近年來的研究表明,在哮喘的發(fā)病機制中,CD4+CD25+Treg起著極為重要的作用。CD4+CD25+Treg通過多種途徑和方式實現(xiàn)其作用,可以通過細胞之間的直接接觸,也可以通過分泌細胞因子IL-10和TGF-β對局部免疫反應(yīng)產(chǎn)生抑制作用[5]。有研究認為,與哮喘的發(fā)生、發(fā)展可能與體內(nèi)CD4+CD25+Treg的數(shù)量或功能異常有關(guān)。但是,關(guān)于哮喘患者體內(nèi)外周血CD4+CD25+Treg水平是升高還是降低,報道是不一致的,大部分的意見是哮喘患者外周血CD4+CD25+Treg水平是降低的,這些研究認為,CD4+CD25+Treg數(shù)量的不足,會導致其免疫抑制功能的下降,從而,可能會出現(xiàn)對Th2細胞的抑制作用的減弱,使Th2類型的免疫反應(yīng)增強,以至產(chǎn)生的大量的致炎因子,如 IL-4,IL-5和IL-13等,導致哮喘的發(fā)作[6-8]。但是,也有少數(shù)研究發(fā)現(xiàn),哮喘患者外周血CD4+CD25+Treg水平與正常對照組比較,并沒有表現(xiàn)出明顯的差異,甚至其數(shù)量是升高的。
CD4+CD25+Treg分泌多種細胞因子,其中,IL-10和TGF-β是其發(fā)揮免疫抑制作用的主要細胞因子。IL-10可以阻止T細胞受體介導的CD4+T細胞的活化,抑制氣道內(nèi)的炎癥,抑制諸炎癥細胞,如嗜酸性粒細胞、肥大細胞等的激活,抑制炎性細胞因子的釋放,實現(xiàn)其調(diào)節(jié)機體免疫功能,因此,又稱為細胞因子合成抑制因子。當體內(nèi)IL-10的水平降低,機體的免疫抑制功能會減弱,在氣道,會出現(xiàn)過敏性炎癥反應(yīng),當接觸到外界的過敏原刺激時,氣道會出現(xiàn)反應(yīng)增強。有研究顯示,在哮喘小鼠體內(nèi),IL-10水平較正常小鼠低,提示IL-10可能在哮喘中發(fā)揮抑制作用。研究報道,CD4+CD25+Treg與活動性哮喘相關(guān),CD4+CD25+Treg可以通過分泌IL-10,減輕氣氣道急性過敏性炎癥,減輕氣道的高反應(yīng)性,并且延緩氣道的重塑[9]。TGF-β可通過抑制IL-1 和IL-2的釋放直接抑制T細胞的增殖和分化,也抑制B細胞增殖,抑制巨噬細胞的增殖及活性氧釋放功能,以抑制炎癥反應(yīng),減輕氣道的免疫反應(yīng),減輕氣道炎癥。而且,TGF-β可使Treg具有穩(wěn)定的免疫抑制功能,在維持Tregs的功能的同時也促進適當?shù)腡regs分化。Scherf W等研究者們發(fā)現(xiàn)[10],TGF-β基因敲除的小鼠,炎癥反應(yīng)明顯增強,對過敏原的刺激反應(yīng)強烈,而全部敲除了TGF-β基因的小鼠,會因強烈的炎癥反應(yīng)出現(xiàn)快速死亡。有研究顯示,在氣管中,TGF-β不僅能夠直接抑制抗原誘導的炎癥反應(yīng)以及氣道高反應(yīng)性,并且,在抗原刺激后,肺泡上皮細胞也可以通過TGF-β途徑,直接誘導Treg細胞上Foxp3+的表達,從而促進CD4+CD25-Treg細胞轉(zhuǎn)化為CD4+CD25+Treg,以調(diào)節(jié)肺黏膜的免疫應(yīng)答,實現(xiàn)對外界抗原產(chǎn)生免疫耐受[11]。在本研究中,哮喘組小鼠CD4+CD25+Treg百分率、IL-10、TGF-β水平均呈現(xiàn)顯著的降低,CD4+CD25+Treg與IL-10、TGF-β呈正相關(guān)的關(guān)系,與國內(nèi)外大多數(shù)的研究結(jié)果相一致,支持CD4+CD25+Treg可能通過分泌細胞因子IL-10、TGF-β來發(fā)揮其免疫抑制作用,IL-10、TGF-β水平的降低,可能促進了哮喘小鼠氣道內(nèi)過敏性炎癥反應(yīng),導致哮喘的發(fā)生。在地塞米松組,CD4+CD25+Treg百分率、IL-10、TGF-β明顯升高,提示地塞米松可能通過上調(diào)CD4+CD25+Treg數(shù)量、促進其分泌相關(guān)抑制性細胞因子以發(fā)揮其抗炎作用。
Th17細胞和Tregs都屬于T細胞亞群。近年來研究發(fā)現(xiàn),Th17細胞可以通過多種途徑來介導組織細胞的免疫損傷。Th17細胞主要分泌IL-17和IL-23等炎癥因子。IL-17是Thl7細胞的主要的效應(yīng)因子,它也是近年來新發(fā)現(xiàn)的諸多炎癥因子中的起始因子,它可以促進炎性細胞釋放炎性因子,可誘導T細胞的產(chǎn)生、增強炎癥反應(yīng),還可以在氣道炎性反應(yīng)的過程中,招募中性粒細胞的聚集,進一步促進多種炎癥細胞釋放出炎性因子,從而加重氣道的阻塞,增強氣道的高反應(yīng)性[12]。在過敏性哮喘患兒的肺組織、痰液、血清、肺泡灌洗液及外周血中,IL-17均顯著升高[13],并且,其表達水平的高低,與患者氣道高反應(yīng)的嚴重程度呈現(xiàn)密切的相關(guān)性[14]。在一系列針對IL-17和IL-17R基因敲除小鼠的研究中,發(fā)現(xiàn)在過敏性哮喘的致敏階段,IL-17能夠誘導Th2的活化,能夠使嗜酸性粒細胞聚集,促進IgE的產(chǎn)生,導致氣道的炎癥以及重塑[15]。近期的研究發(fā)現(xiàn),CD4+CD25+Treg與Th17細胞之間關(guān)系緊密,二組在分化上互相影響,在功能上有表現(xiàn)出相互拮抗,從而,使機體的免疫狀態(tài)呈現(xiàn)出相對穩(wěn)定,對機體免疫平衡狀態(tài)起著非常重要的作用。活化的CD4+T細胞在TGF-β作用下分化為抗炎的CD4+CD25+Treg,但是,活化的CD4+T細胞在TGF-β和高濃度IL-6 都存在的情況下,則分化為具有促炎作用的Th17細胞,表現(xiàn)出抑制CD4+CD25+Treg的分化。CD4+CD25+Treg能夠通過分泌TGF-β細胞因子,促進Th17細胞的發(fā)育。在缺乏外源性TGF-β,但是,有IL -6存在的情況下, CD4+CD25+Treg本身也可以分化為Th17細胞,反之,抑制Th17細胞的產(chǎn)生可促進CD4+CD25+Treg的發(fā)育[16]。本研究結(jié)果顯示,哮喘小鼠CD4+CD25+Treg百分率及其細胞因子IL-10、TGF-β較正常對照組顯著降低,同時,Th17細胞因子IL-17顯著增高,并且,CD4+CD25+Treg與IL-10、TGF-β表達水平呈正相關(guān),與IL-17之間呈負相關(guān)關(guān)系,提示在哮喘小鼠體內(nèi),在CD4+CD25+Treg數(shù)量和功能的下調(diào)的同時,也出現(xiàn)了IL-17表達增加,表現(xiàn)出免疫失衡狀態(tài)。地塞米松干預后的小鼠CD4+CD25+Treg數(shù)量及相關(guān)細胞因子IL-10、TGF-β明顯升高,而IL-17水平呈現(xiàn)明顯降低,提示地塞米松可能會促進CD4+CD25+Treg及相關(guān)因子的表達,能夠抑制TH17相關(guān)細胞因子的表達,以實現(xiàn)調(diào)節(jié)CD4+CD25+Treg/Th17之間的免疫失衡狀態(tài),從而抑制機體的炎癥反應(yīng),表現(xiàn)出其抗炎作用。
4結(jié)論
本研究結(jié)果顯示,哮喘小鼠體內(nèi)存在CD4+、CD25+Treg數(shù)量的減少以及IL-10、TGF-β表達水平的下降、細胞因子IL-17表達的增加。CD4+、CD25+Treg及其相關(guān)細胞因子IL-10、TGF-β、TH17類細胞因子IL-17,共同介導的免疫平衡參與了哮喘的發(fā)生、發(fā)展過程,地塞米松可能通過調(diào)節(jié)這些細胞及其細胞因子平衡來發(fā)揮其抗炎作用。引起支氣管哮喘的機制復雜,并且參與的因素眾多,糖皮質(zhì)激素及CD4+、CD25+Treg介導哮喘發(fā)病的具體作用機制卻并不清楚,還需要進一步的研究。對哮喘免疫機制的深入研究將有助于為哮喘的治療提供更有效的方法。
【參考文獻】
[1]McGuirk P, Higgins SC, MillsKH. The role of regulatory T cells in respiratory infections and allergy and asthma[J]. Curr Allergy Asthma Rep, 2010,10:21-28.
[2]Teixeira B,Bittencourt VC,F(xiàn)erreira TB,etal. Low sensi-tivity to glucocorticoid inhibition of in vitro Th17-related cytokine pro-duction in multiple sclerosis patients is related to elevated plasma li- popolysaccharide levels[J].Clin Immunol, 2013,148(2) :209-218.
[3]J.C. Kips, K.G. Tournoy, R.A. Pauwels. New anti-asthma therapies: suppression of the effect of interleukin (IL)-4 and IL-5[J]. Eur Respir J, 2006, 17: 499-506.
[4]Matthew E. Poynter, Charles G. Irvin, Yvonne M. W. Janssen-Heininger. Rapid Activation of Nuclear Factor-κB in Airway Epithelium in a Murine Model of Allergic Airway Inflammation[J]. American Journal of Pathology, 2007, 160: 1325-1334.
[5]周文超,李薇. CD4+CD25+調(diào)節(jié)性T細胞的研究現(xiàn)狀[J]. 臨床軍醫(yī)雜志, 2012, 40, 6, 1547-1549.
[6]Wilson SJ,Harmer MJ,Lee RL,etal. Recurring BALB/c mouse lung inflammatory responses to episodic allergen exposure [J]. J Toxicol Environ Health A,2013,76(3):176-191.
[7]Mamessier E,Nieves A,Lorec AM,etal. T-cell activation during exacerbations: a longitudinal study in refractory asthma[J]. Aller- gy,2008,63(9) :1202-1210.
[8]Hartl D,Koller B,Mehlhorn AT,etal. Quantitative and func- tional impairment of pulmonary CD4+CD25hi regulatory T cells in pediatric asthma [J]. Allergy Clin Immunol,2007,119(5):1258- 1266.
[9]Kearley J,Robinson DS,LIoyd CM. CD4+CD25+regulatory T cells reverse established allergic airway inflammation and prevent airway remodeling [J]. J Allergy Clin Immunol,2008,122(3): 617-624.
[10] Scherf W,Burdach S,Hansen G. Reduced expression of transforming growth factor beta 1 exacerbates pathology in an experimental asthma model[J]. Eur J Immunol,2005,35(1):198-206.
[11] Gereke M,Jung S,Buer J,etal. Alveolar type II epithelial cells present antigen to CD4+T cells and induce Foxp3+ regulatory T cells [J]. Am J Respir Crit Care Med,2009,179(5):344-355.
[12] 李麗, 李敏.白三烯受體拮抗劑對哮喘氣道重塑及 Th17 細胞 /CD4+CD25+調(diào)節(jié)性 T 細胞表達的影響[J].臨床兒科雜志, 2014, 8: 789-792.
[13] Morishima Y,Ano S,Ishii Y,etal. Th17-associated cytokines as a therapeutic target for steroid-insensitive asthma [J]. Clin Dev Immunol,2013,2013:609395.
[14] Hamzaoui A,Maalmi H,Berra?es A,etal. Transcriptional cha-racteristics of CD4+T cells in young asthmatic children:RORC and FOXP3 axis [J]. J Inflamm Res,2011,4(1):139-146.
[15] Schnyder-Candrian S,Togbe D,Couillin I,etal. Interleukin-17 is a negative regulator of established allergic asthma [J]. J Exp Med,2006,203(12):2715-2725.
[16] Hori S. Developmental plasticity of Foxp3 + regulatory T cells[J]. Curr Opin Immunol, 2010, 22(5): 575-582.
(收稿日期:2015-09-02; 編輯: 陳舟貴)
通訊作者:梁宗安,教授,本刊常務(wù)編委,E-mail:liang.zongan@163.com
基金項目:國家自然科學基金(30871119)
【中圖分類號】R 562.2+5
【文獻標志碼】A
doi:10.3969/j.issn.1672-3511.2016.01.004

