斑馬魚報警反應產生發育階段的研究
曹小龍,祖 堯,張慶華,賈 亮,李偉明
(上海海洋大學水產種質與資源發掘與利用教育部重點實驗室,上海 201306)
斑馬魚報警反應產生發育階段的研究
曹小龍,祖 堯,張慶華,賈 亮,李偉明
(上海海洋大學水產種質與資源發掘與利用教育部重點實驗室,上海 201306)
魚類在遭受捕食后,受損的表皮會釋放大量的化學信號物質,同種其它個體嗅到這些化學信號后會作出躲避反應,稱為報警反應(alarm response),報警反應通常出現在一定的發育階段。采用斑馬魚(Dinio rerio)同種碾碎提取物(處理組,質量濃度為10-6g·L-1)作為報警物質,并設3個對照組:羅非魚碾碎提取物組、雙蒸水組、空白對照組,通過暴露處理實驗,檢測沉底累積時間(time of bottom)、呆滯累積時間(time of freezing)兩項指標,研究了28 dpf(days post fertilization,受精后天數)、35 dpf、42 dpf 3個不同發育時期幼魚的報警反應。結果顯示:28 dpf時,處理組與3個對照組相比,在沉底累積時間、呆滯累積時間兩項指標上均無顯著差異,這個時期處理組有2 ind斑馬魚出現“沉底”,其中1 ind出現“呆滯”;35 dpf時,處理組與3個對照組相比,在沉底累積時間上有顯著差異(P<0.05),在呆滯累積時間上無顯著差異,這個時期有5 ind斑馬魚出現“沉底”,其中1 ind出現“呆滯”;42 dpf時,處理組與對照組相比,在沉底累積時間、呆滯累積時間兩項指標均有顯著差異(P<0.05),這個時期有8 ind斑馬魚出現“沉底”,且8 ind全部出現“呆滯”,與此對應的是這個時期大部分個體出現明顯的報警反應。研究表明,斑馬魚報警反應產生的發育階段為35~42 dfp之間,結合已知的野外斑馬魚生活史,推測斑馬魚在特定的階段產生報警反應可能與棲息地的遷移有關。
斑馬魚;報警反應;發育;棲息地
動物界中,當個體受到捕食者襲擊時,會主動或被動地向同種其它個體發出報警信號,以躲避潛在的危險[1-5]。生活在水環境中的魚類,當個體受傷時,破損的表皮會向周圍的環境中釋放化學信號物質,引發同種其它個體的反捕食行為[6-8],稱為報警反應(alarm response),引起報警反應的化學信號物質稱為報警物質(alarm substance)。1938年,VON FRISCH[9]最早在真鱥(Phoxinus phoxinus)中觀察到了魚類的報警反應,并對此做了詳盡的描述,由此開啟了魚類報警行為研究的先河[9-11]。半個多世紀以來,魚類的報警反應研究取得了長足的發展,涉及到的相關領域包括行為學、神經生物學、心理學、生物化學等。然而,關于魚類報警反應產生的時期卻鮮有報道。
生命個體在生活史的早期階段,自我保護能力較弱,容易受到捕食者的襲擊,因此從自然選擇壓力來講,報警反應應該越早出現越好。然而,令人困惑的是,事實并非如此。已有研究表明,魚類只有到了特定的發育階段才出現報警反應。例如,真鱥在受精后50 d左右才出現報警反應[11];斑馬魚(Danio rerio)可能在孵化后32~52 d才出現報警反應[12-13]。這些研究初步界定了報警反應出現的時間,然而,并沒有針對報警反應出現的特定行為(包括沉底、快速游動、呆滯等)進行定量分析。此外,前期研究中,實驗用的斑馬魚飼養條件各異,缺乏統一的標準。近年來,斑馬魚作為模式動物在行為神經科學及行為遺傳學領域得到廣泛應用,另外斑馬魚高度集中化養殖體系得到了進一步發展,形成了相對統一的規范和標準。在這樣的背景下,有必要進行特征性行為的定量分析從而對斑馬魚報警反應產生時間做進一步的研究。本文通過報警物質暴露處理實驗,比較檢測了28 dpf(days post fertilization,受精后天數)、35 dpf、42 dpf 3個不同時期的斑馬魚幼魚的沉底累積時間、呆滯累積時間兩項報警反應指標,界定了在目前實驗室養殖條件下的報警反應出現時間,以期為該研究領域提供基礎資料,并為進一步深入研究報警反應的機制提供有效模式。
1 材料與方法
1.1 實驗動物
AB品系的野生型斑馬魚購自國家斑馬魚模式動物中心(中國上海),在本實驗循環養殖系統中傳代馴化。孵化斑馬魚出膜后轉移到3 L魚缸中,每天早晚2次(9∶00,18∶00)喂食草履蟲(Paramecium),3周后,將幼魚轉移到循環系統中喂養,魚缸容積3 L,實驗魚總計40 ind,每天2次(9∶00,18∶00)喂食初孵鹵蟲(Artemia salina)。實驗室內養殖標準:光照條件為L∶D=14 h∶10 h;養殖用水由自來水經系統自帶的凈化設備處理后進入養殖系統,水溫(27±1)℃,鹽度4,pH值為7.0±0.5,24 h曝氣。實驗前24 h及實驗過程中停止喂食。
1.2 報警物質制備
本實驗中,報警物質制備參考WALDMAN的制備方法[13],采取整魚碾碎,具體流程如下:取2 ind健康斑馬魚(♀♂各1 ind),置于冰上麻醉,隨后將其轉移至2 mL離心管。用全自動組織勻漿機(MP Biomedicals,Fastprep-24)將斑馬魚均勻打碎30 s,以漿液均勻無顆粒為準。高速離心機(Eppendorf,5424R)4℃、12 000 r·s-1離心10 min,取上清液,按1 g體質量稀釋至1 L的標準稀釋,以此作為原液。實驗前制備新鮮報警物質,實驗過程中,將離心管置于冰盒中,可以有效減少報警物質效力的損失。同樣取2 ind健康羅非魚(Oreochromisspp.)(與斑馬魚等重)作為異種對照,按上述流程制備報警物質。
1.3 暴露實驗
前期實驗發現:30 dpf時,斑馬魚無報警反應出現;40 dpf時,普遍出現報警反應,因此將報警反應出現的時間初步界定在30~40 dpf之間。
正式實驗:實驗共檢測28 dpf、35 dpf、42 dpf 3個發育時期的斑馬魚(來源于同一親本),每個時期均設同種碾碎物提取物處理組,即Conspecific組和3個對照組:Heterospecific組(羅非魚碾碎提取物)、Water組(雙蒸水)、Blank組(空白對照),共計4組,每組10 ind斑馬魚。報警物質暴露處理時將原液按1∶1 000加入檢測缸。
檢測缸長12 cm、寬4 cm、高8 cm(28~42 dpf的幼魚個體小且游泳速率較慢,因此采用該規格小缸進行檢測)。報警物質暴露處理時,采取單尾檢測(每個檢測缸中1 ind斑馬魚)。
實驗前將待檢測斑馬魚轉移至檢測缸,適應20 min。實驗中采用攝像機(SONY,HDRPJ390)拍攝視頻記錄:Water組、Heterospecific組及Conspecific組在報警物質暴露處理后拍攝3 min,同時對Blank組拍攝3 min。
1.4 運動軌跡分析
斑馬魚的報警反應是一個較為復雜的行為過程,其中沉底和呆滯行為是報警反應的2個典型特征,本實驗采用SPEEDIE等[14]的行為定量方法,用以下兩項指標來表征斑馬魚報警行為響應:(1)缸底累積時間(time of bottom);(2)呆滯累積時間(time of freezing)。以水面高度為準,將魚缸垂直方向分為頂部、中部、底部3部分(等分),其中底部視為缸底。呆滯界定為:魚體靜止不動,只有眼動和鰓動。用小型動物行為活動軌跡記錄分析系統Ethovision XT 10.1(Noldus,Wageningen,The Netherlands)進行視頻信息采集,得到相應指標的數據。
1.5 數據統計分析
以上采集到的運動軌跡數據,采用SAS 8.1統計分析軟件,在0.05的置信水平對兩項指標進行單因素方差分析,用Duncan法檢驗。文章中所有圖形均使用Graphpad 5.0軟件繪制,實驗結果用平均值±標準誤的形式表示。
2 結果與分析
在28 dpf,Conspecific組與其余3組之間在缸底累積時間和呆滯累積時間兩項指標上,均無顯著性差異(圖1),這個時期有2 ind斑馬魚出現“沉底”,其中1 ind出現“呆滯”(圖2);在35 dpf,Conspecific組與其余3組之間在沉底累積時間上,有顯著性差異(P<0.05)(圖3),這個時期有5 ind斑馬魚出現“沉底”,其中1 ind出現“呆滯”(圖4);在42 dpf,Conspecific組與其余3組之間在缸底累積時間、呆滯累積時間上,均有顯著性差異(P<0.05)(圖5),這個時期有8 ind斑馬魚出現“沉底”,且8 ind全部出現“呆滯”(圖6)。
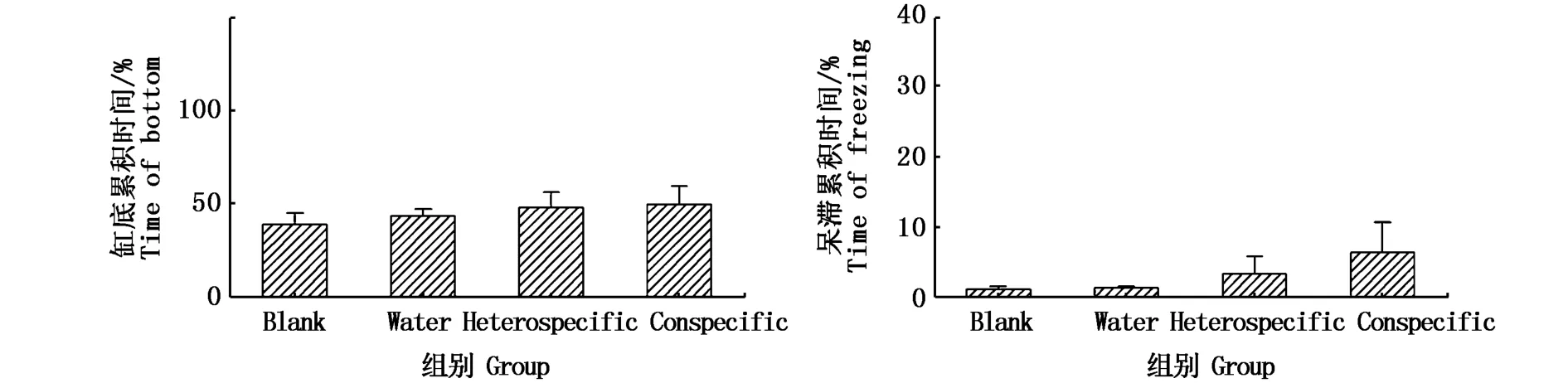
圖1 受精后28 d實驗斑馬魚的行為反應Fig.1 Behavioral response of 28 dpf Danio rerio
圖2 受精后28 d實驗斑馬魚(熱區圖)Fig.2 28 dpf Danio rerio(Heatmap)
圖3 受精后35 d實驗斑馬魚的行為反應Fig.3 Behavioral response of 35 dp f Danio rerio

圖4 受精后35 d實驗斑馬魚(熱區圖)Fig.4 35 dpf Danio rerio(Heatmap)
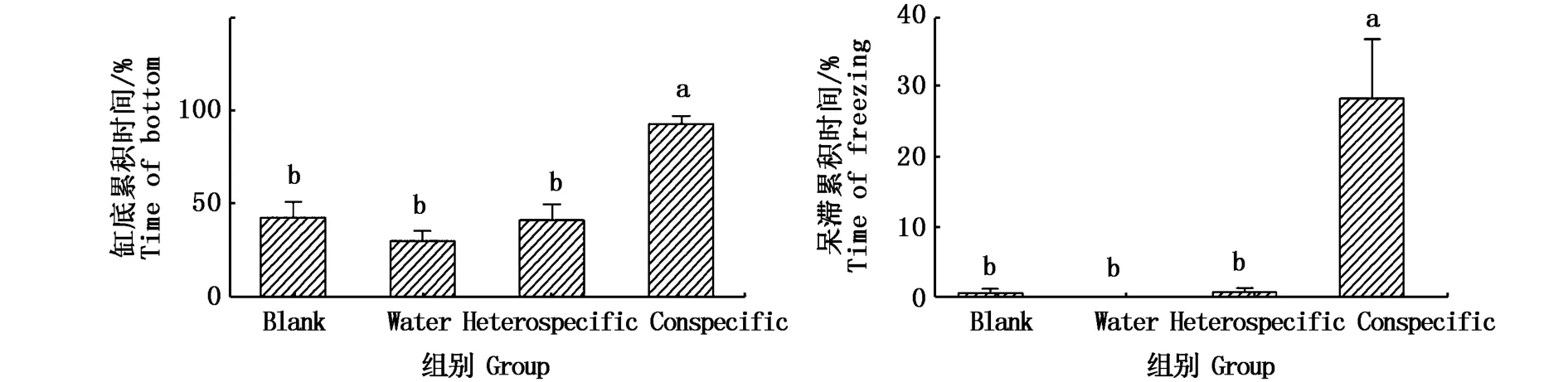
圖5 受精后42 d實驗斑馬魚的行為反應Fig.5 Behavioral response of 42 dpf Danio rerio
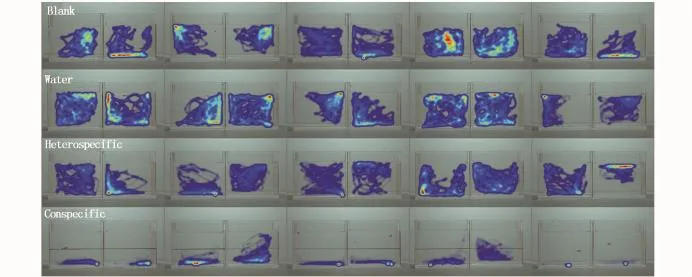
圖6 受精后42 d實驗斑馬魚(熱區圖)Fig.6 42 dpf Danio rerio(Heatmap)
3 討論
從結果分析來看,隨著發育時期的推移,Conspecific組中出現“沉底”和“呆滯”的個體數量呈現出遞增趨勢,即表明出現報警反應的個體數量增加;而對照組則沒有明顯變化。通常對于一個典型的報警反應可以作如下描述:受試個體出現報警反應,首先表現為快速潛入缸底,隨后在缸底沿著水平方向進行快速的往復游動,這個過程通常會持續十幾秒到幾十秒不等,常見的在15~30 s之間,之后一些個體會進入“呆滯”狀態,這個過程持續數秒到數分鐘不等,少數個體甚至持續數小時。而未進入“呆滯”狀態的個體則在隨后的數分鐘內逐漸恢復常態。值得注意的是,在35 dpf時,Conspecific組與3個對照組相比在“沉底累積時間”上有顯著性差異(P<0.05),而在“呆滯累積時間”這項指標上沒有顯著性差異,5 ind出現“沉底”的個體中,僅有1 ind出現“呆滯”。推測在報警反應過程中“沉底”可能是必然的過程,而“呆滯”則是可能發生的情況。長期以來報警反應被認為是一種恐懼反應,筆者認為“沉底”發生在報警反應的開始階段,是一種本能的避險行為,而“呆滯”則可能是一種重度恐懼的結果。在42 dpf時,Conspecific組中8 ind出現“沉底”的個體,全部出現“呆滯”狀態,與42 dpf的個體相比,35 dpf的個體沉底后更易恢復常態。
魚類的報警反應是先天性行為,并非后天習得[15-16]。本研究發現,受精后35~42 d的斑馬魚,在首次接受報警物質(成魚提取物)處理時即表現出報警反應,包括沉底、快速游動、呆滯等。在對其它魚類的研究中,也有類似現象,即報警行為均出現在一個特定的發育階段。例如,真鱥在受精后50 d開始出現報警反應[11]。在早期研究中,一些學者在斑馬魚中也做過類似實驗,如PFEIFFER[12]發現在喂食的同時給予報警物質刺激會導致孵化后32 d的斑馬魚逃避攝食區域;WALDMAN[13]發現在對孵化后48~52 d的斑馬魚給予成魚報警物質刺激后,會導致受試群體在檢測缸中的運動分布整體下移。這些研究顯示32~52 d的斑馬魚可能已經出現報警反應。然而,以往的研究主要是對行為特征的描述,并沒有針對報警反應出現的特定行為(包括沉底、快速游動、呆滯等)進行定量分析。此外,在早期的這些研究中,實驗用的斑馬魚飼養條件各異,缺乏統一的標準,如WALDMAN[13]的研究中,實驗斑馬魚每天僅喂食一次,導致斑馬魚發育延遲,這可能是導致報警反應出現時間較晚的原因,表明報警反應可能跟發育有關。
斑馬魚報警反應出現在特定的發育階段,推測原因可能有2種:一種可能是,到了一定的發育階段,幼魚行使復雜行為的能力才得到充分發展和完善;然而,MCHENEY等[17]的研究表明,受精后5 d的斑馬魚已經能夠根據水流波動判斷捕食者的存在,并作出逃避反應;此外,實驗過程中,筆者發現20 dpf的斑馬魚當移動魚缸時即可表現出類似報警反應的行為模式。由此說明,可能受精后20 d的斑馬魚實際上已經具備行使復雜行為的能力。因而,這第一種假設應被排除。另一種可能是,到了一定的發育階段,識別報警物質的嗅覺受體才表達,亦或是相關的神經通路才發展形成。已有研究在一定程度上支持了這一假設,LINDSAY等[18]發現,受精后3 d的斑馬魚幼魚在給予氨基酸氣味刺激后即表現出游泳活動增加;對報警物質或一些繁殖相關的信息素的反應則出現在較遲的發育階段[13,19]。剛孵化的斑馬魚嗅球中神經元的數量只占成年個體的5%,在此后的數周,數量逐漸增多[20],顯示嗅覺系統的發展是一個逐步完善的過程,而這一過程歷經數周,同時可能伴隨著嗅覺功能的發展和完善。這一點與本研究結果基本吻合。此外,已知的野外調查記錄顯示:在野生條件,斑馬魚棲息地,成年斑馬魚通常出現在植被覆蓋的淺灘區域,或者是溪流中有懸垂植被遮蔽的區域。在溪流中,成年斑馬魚不得不遭遇它們的捕食者,如一些鱧屬(Channa)的魚類。幼魚和小魚很少在溪流中出現,它們一般生活在淺灘,這些淺灘區域水流緩慢,或者形成凹形死角,但與溪流相通。在這些區域,沒有大型的捕食者出現[21-23]。一個可能的斑馬魚野外生活史:成年斑馬魚主要在溪流生存,雨季洪澇時節(每年4~8月,也是野生斑馬魚的產卵季節),溪流與淺灘連成一片,成魚游到淺灘區域產卵,這些卵孵化后,在淺灘生長,30~40 dpf時,這些小魚開始遷移到溪流中生活(可能是因為食物需求增大),此時它們將面臨溪流中的捕食者。綜上推測:到了某個特定的發育階段,斑馬魚需要適應新的棲息地,而那里生活著它們的捕食者,因而需要發展出更為有效的以化學信號為基礎的反捕食行為,以適應新的生存環境(這可以視為外界環境壓力),而與此對應的嗅覺受體的表達或者說相關神經環路的發展形成,則是環境壓力下生命個體自身潛在機能的發展完善。此外,早期研究一般都是剝取魚皮制備報警物質,本研究則是整魚制備。近年來有研究表明,營養狀況良好的個體與營養狀況稍差的個體相比,表皮中包含有更多的報警物質[10]。因而,與魚皮相比,用魚體質量來衡量報警物質的相對濃度可能更為精確。
本文通過比較檢測28、35、42 dpf 3個不同發育時期斑馬魚幼魚的報警反應,首次界定了實驗室高密度養殖體系中斑馬魚報警反應出現的發育時期,并結合已知的野外斑馬魚生活史,推測斑馬魚在特定的發育階段產生報警反應可能與棲息地遷移有關。這將有利于我們進一步理解自然環境下,報警反應對個體生存以及提升種群適合度的重要意義。后續工作將對報警物質的理化性質做進一步的研究,并同時開展報警物質的鑒定工作,報警物質對應的嗅覺受體也有待進一步的研究。
[1] MACEDONIA JM,EVANSCS.Essay on contemporary issues in ethology:Variation among mammalian alarm call systems and the problem of meaning in animal signals[J].Ethology,1993,93(3):177-197.
[2] SMITH R J F.Evolution of alarm signals:Role of benefits of retaining group members or territorial neighbors[J].American Naturalist,1986:604-610.
[3] SHERMAN PW.Nepotism and the evolution of alarm calls[J].Science,1977,197(4310):1246-1253.
[4] KLUMP G M,Shalter M D.Acoustic behaviour of birds and mammals in the predator context;I.Factors affecting the structure of alarm signals.II.The functional significance and evolution of alarm signals[J].Zeitschriftfür Tierpsychologie,1984,66(3):189-226.
[5] ROTTMAN S J,SNOWDOWN C T.Demonstration and analysis of an alarm pheromone in mice[J].Journal of Comparative and Physiological Psychology,1972,81(3):483.
[6] CHIVERS D P,SMITH R J F.Chemical alarm signalling in aquatic predator-prey systems:A review and prospectus[J].Ecoscience,1998:338-352.
[7] JACOBSEN H P,STABELL O B.Antipredator behaviour mediated by chemical cues:The role of conspecific alarm signalling and predator labelling in the avoidance response of a marine gastropod[J].Oikos,2004,104(1):43-50.
[8] HAY M E.Marine chemical ecology:Chemical signals and cues structuremarine populations,communities,and ecosystems[J].Annual Review of Marine Science,2009(1):193.
[9] VON FRISCH K.Zurpsychologie des fisch-schwarmes[J].Naturwissenschaften,1938,26(37):601-606.
[10] VON FRISCH K.über einen Schreckstoff der Fischhaut und seine biologische Bedeutung.Z[J].Journal of Comparative Physiology,1942,29(1):46-145.
[11] SMITH R JF.Alarm signals in fishes[J].Reviews in Fish Biology and Fisheries,1992,2(1):33-63.
[12] PFEIFFERW.The fright reaction in North American fish[J].Canadian Journal of Zoology,1963,41(1):69-77.
[13] WALDMAN B.Quantitative and developmental analyses of the alarm reaction in the zebra danio,Brachydanio rerio[J].Copeia,1982:1-9.
[14] SPEEDIE N,GERLAIR.Alarm substance induced behavioral responses in zebrafish(Danio rerio)[J].Behavioural Brain Research,2008,188(1):168-177.
[15] BASS S L S,GERLAIR.Zebrafish(Danio rerio)responds differentially to stimulus fish:The effects of sympatric and allopatric predators and harmless fish[J].Behavioural Brain Research,2008,186(1):107-117.
[16] BLANCHARD D C,GRIEBEL G,BLANCHARD R J.Conditioning and residual emotionality effects of predator stimuli:Some reflections on stress and emotion[J].Progress in Neuro-Psychopharmacology and Biological Psychiatry,2003,27(8):1177-1185.
[17] MCHENRY M J,FEUTL K E,STROTHER JA,etal.Larval zebrafish rapidly sense the water flow of a predator's strike[J].Biology Letters,2009:rsbl.2009.0048.
[18] LINDSAY SM,VOGTR G.Behavioral responses of newly hatched zebrafish(Danio rerio)to amino acid chemostimulants[J].Chemical Senses,2004,29(2):93-100.
[19] DARROW K O,HARRISW A.Characterization and development of courtship in zebrafish,Danio rerio[J].Zebrafish,2004,1(1):40-45.
[20] MACK-BUCHER J A,LI J,FRIEDRICH R W.Early functional development of interneurons in the zebrafish olfactory bulb[J].European Journal of Neuroscience,2007,25(2):460-470.
[21] SPENCE R,FATEMA M K,REICHARD M,et al.The distribution and habitat preferences of the zebrafish in Bangladesh[J].Journal of Fish Biology,2006,69(5):1435-1448.
[22] ENGESZER R E,PATTERSON L B,RAO A A,et al.Zebrafish in thewild:A review of natural history and new notes from the field[J].Zebrafish,2007,4(1):21-40.
[23] ARIMACHALAM M,RAJA M,VIJAYAKUMAR C,et al.Natural history of zebrafish(Danio rerio)in India[J].Zebrafish,2013,10(1):1-14.
Alarm response at specific developmental stage in zebrafish(Danio rerio)
CAO Xiao-long,ZU Yao,ZHANG Qing-hua,JIA Liang,LIWei-ming
(Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Ministry of Education,ShanghaiOcean University,Shanghai201306,China)
For many species the injured skin of fish under attack can release alarm substances that alert conspecifics of the presence of a predator and perform alarm response.The alarm substance is thought to be beneficial for the survival of the receiving individual,and to improve the inclusive fitness of releaser.Previous research showed that the alarm response usually appears in a specific developmental stage.In the present study,we tested behavioral response of zebrafish at three developmental stages(28 dpf,35 dpf and 42 dpf)to extracts of crushed conspecific individuals(10-6g body mass·L-1).Two indicators were measured:percent of time on bottom(time of bottom)and percentof time at freezing state(time of freezing).Our results showed that,at28 dpf,the responses of treatment group(extracts of crushed conspecific)did not differ from those of various control groups.In this stage,two individuals displayed“bottom”but only one displayed“freezing”.At 35 dpf,the treatment group showed a higher percentage of time spent on bottom than the control groups(P<0.05).At this stage,five individuals displayed“bottom”but only one displayed“freezing”.At 42 dpf,the treatment group showed higher percentages of time spent on both bottom and freezing state than control groups(P<0.05).At this stage,eight individuals displayed“bottom”and all of them displayed“freezing”.Themajority of individuals in the treatment group at this time started to show the alarm response.We conclude that zebrafish start to display alarm responses between 35-42 dpf.Considering the context of known wild zebrafish life history,we speculate that zebrafish alarm response appears at specific developmental stage when theymigrate to a different habitat.
zebrafish;alarm response;developmental stage;habitat
S 943
A
1004-2490(2016)03-0304-07
2015-10-23
中美海洋研究中心項目(A1-0209-13-0805);水產動物遺傳育種中心上海市協同創新中心項目(ZF1206);上海市科委揚帆計劃(15YF1405000)
曹小龍(1988-),男,碩士研究生,研究方向為魚類信息素通訊。E-mail:woin99@126.com
李偉明,教授。E-mail:liweim@shou.edu.cn

