福建連江海帶循環(huán)制冷育苗水體的浮游植物群落結(jié)構(gòu)分析
鐘晨輝,楊 芳,林 琪,郭書悅,黃瑞芳,林向陽,宋武林,陳德富
(1.福建省水產(chǎn)研究所,福建省海洋生物增養(yǎng)殖與高值化利用重點實驗室,福建廈門 361013;2.福建省海洋經(jīng)濟運行監(jiān)測與評估中心,福建福州 350003;3.福建省連江縣官塢海產(chǎn)開發(fā)有限公司,福建連江 350511)
福建連江海帶循環(huán)制冷育苗水體的浮游植物群落結(jié)構(gòu)分析
鐘晨輝1,楊 芳1,林 琪1,郭書悅1,黃瑞芳1,林向陽1,宋武林2,陳德富3
(1.福建省水產(chǎn)研究所,福建省海洋生物增養(yǎng)殖與高值化利用重點實驗室,福建廈門 361013;2.福建省海洋經(jīng)濟運行監(jiān)測與評估中心,福建福州 350003;3.福建省連江縣官塢海產(chǎn)開發(fā)有限公司,福建連江 350511)
為準確掌握海帶(Saccharina japonica)循環(huán)制冷育苗過程水體的浮游植物群落結(jié)構(gòu)變化特征,本研究于2014年9月下旬~11月中旬調(diào)查了福建省連江縣官塢海產(chǎn)開發(fā)有限公司海帶育苗車間循環(huán)水9個批次的浮游植物群落結(jié)構(gòu),對浮游植物種類組成、優(yōu)勢種和生態(tài)特征指數(shù)進行統(tǒng)計分析。結(jié)果顯示,共鑒定浮游植物43種,隸屬于5門31屬,以硅藻門出現(xiàn)的種類數(shù)最多,達22屬32種,占總種數(shù)的74.42%,其它為藍藻門、甲藻門、裸藻門和綠藻門。在整個育苗期間,第一優(yōu)勢種始終為奇異棍形藻(Bacillaria paradoxa),第二優(yōu)勢種為佛氏海毛藻(Thalassiothrix frauenfeldii)和新月細柱藻(Cylindrotheca closterium)交替,優(yōu)勢種組成較簡單,變化不明顯,單一種優(yōu)勢地位顯著。海帶幼苗生長期1~8 d階段的水體浮游植物種類較多,多樣性指數(shù)、均勻度和豐富度分別達到3.191~3.225、0.765~0.806和1.324~1.500,然而在生長期15~57 d階段的水體浮游植物種類數(shù)降低,多樣性指數(shù)為1.172~1.818,均勻度為0.370~0.570,豐富度為0.485~0.841,生態(tài)特征指標變化幅度較小,多樣性水平相對較低,群落結(jié)構(gòu)不勻稱,較適合海帶幼苗的生長。
海帶;浮游植物;循環(huán)制冷水體;種類組成;優(yōu)勢種
海帶(Saccharina japonica)是一種世界性的大型經(jīng)濟藻類,也是目前我國養(yǎng)殖規(guī)模最大和總產(chǎn)量最高的海藻栽培品種,主要養(yǎng)殖在遼寧、山東和福建的沿海地區(qū),總年產(chǎn)量(干品)達80× 104t以上,居世界第一位[1]。海帶原產(chǎn)于北太平洋與大西洋沿海地區(qū),引種到我國僅有80多年的歷史,但我國海帶人工育苗及養(yǎng)殖技術(shù)均處于世界領(lǐng)先。自上世紀60年代“海帶夏苗培育技術(shù)”和“海帶南移養(yǎng)殖技術(shù)”等難題被攻克后,福建省逐步成為我國南方主要的海帶育苗與養(yǎng)殖集群地[2]。據(jù)2012年的《中國漁業(yè)統(tǒng)計年鑒》數(shù)據(jù)顯示:福建省海帶年總育苗量達到207.3×108株,占全國育苗總量的69.5%;海帶養(yǎng)殖產(chǎn)量(干品)達到53.2×104t,占全國總產(chǎn)量的54.4%[1]。海洋浮游植物普遍存在于海洋生物繁育水體中,具有廣適性、廣溫性、繁殖力強的特點[3]。福建省海帶人工育苗采用夏季自然光人工育苗方法,整個育苗車間的循環(huán)制冷海水源于自然海區(qū),存在著雜藻(水云屬、滸苔屬和硅藻門等海洋浮游植物)污染情況[4]。雜藻與海帶配子體或幼孢子體呈生長競爭關(guān)系,雜藻大量增長將會阻礙海帶幼孢子體的生長,嚴重時造成育苗器上幼苗附著量稀少,不能用于養(yǎng)殖應(yīng)用。按現(xiàn)有的海帶育苗技術(shù)工藝,海帶孢子體幼苗被雜藻包圍后,一般情況下難以通過調(diào)節(jié)光照強度和溫度,控制營養(yǎng)鹽添加量等處理方法得以清除[5]。為了逐步建立優(yōu)勢性雜藻控制或防治技術(shù),需要準確掌握海帶人工育苗水體的浮游植物種類組成及主要優(yōu)勢種。因此,本試驗在海帶室內(nèi)自然光育苗期間連續(xù)監(jiān)測了循環(huán)制冷水體中浮游植物群落的多樣性指數(shù)、均勻度、豐富度及優(yōu)勢度等指標,初步探討了浮游植物種類組成和優(yōu)勢種變化趨勢,以期為將來開展雜藻防控技術(shù)研究提供基礎(chǔ)資料。
1 材料與方法
1.1 海帶循環(huán)水育苗車間采樣點設(shè)置
浮游植物的采集地在福建省連江縣官塢海產(chǎn)開發(fā)有限公司的海帶育苗車間內(nèi),采集時間為整個海帶育苗時期(2014年9月下旬~11月中旬),海帶育苗車間采用海水循環(huán)制冷系統(tǒng)(圖1-A所示)。采集點位于育苗車間的S1、S2、S3、S4、S5和S6位置(圖1-B所示)。
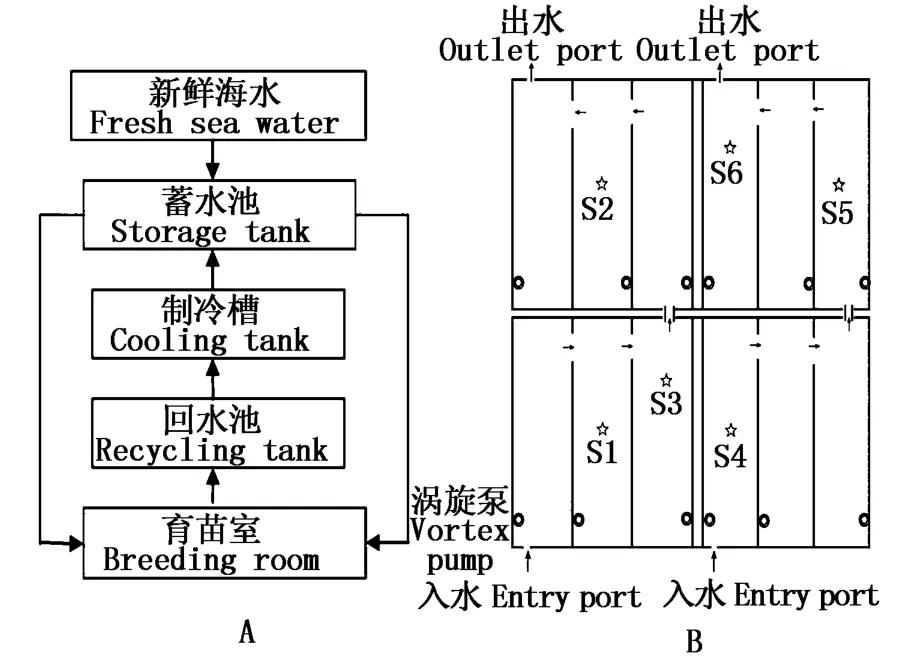
圖1 海水循環(huán)制冷系統(tǒng)模式(A)及海帶育苗車間水樣采樣點圖(B)Fig.1 Diagram of the circulating cold seawater system(A)and sam pling locations in the breeding room of Saccharina japonica(B)
1.2 樣品采集、處理和分析
從種海帶釋放游孢子附著維尼龍育苗器后開始采集水樣,隨后每隔7 d采集一次水樣直至海帶孢子體幼苗出庫。由于海帶循環(huán)制冷育苗系統(tǒng)的育苗池池內(nèi)水流交換通暢,同時工人每2 d采用高壓水槍沖刷育苗器表面附著的浮游植物,在同一時間采集育苗水體的浮游植物相對分布均勻。浮游植物樣品的采集依據(jù)GB17378.7-2007《海洋監(jiān)測規(guī)范》的生態(tài)調(diào)查方法。具體方法:正午時分等量采集海帶育苗車間的S1、S2、S3、S4、S5和S6站位的表層水體,用5%Lugos溶液固定樣品,帶回實驗室靜置24 h以上濃縮至適量體積,制成混合樣品。采用移液器移取定量藻液置于浮游植物計數(shù)框內(nèi),蓋上蓋玻片后移到Leica DM4500B生物顯微鏡下進行種類分析和計數(shù)。種類鑒定方法參照《中國海洋浮游生物圖譜》[6]和《中國海域常見浮游硅藻圖譜》[7]并進行數(shù)據(jù)統(tǒng)計分析。
1.3 數(shù)據(jù)分析
生態(tài)特征指數(shù)計算包括多樣性指數(shù)(H′)、均勻度(J)、豐富度(d)、優(yōu)勢度(D2)和物種優(yōu)勢度(Y),具體計算公式如下:
多樣性指數(shù)(Shannon-Wiener,1963):H′=-∑si=1Pilog2Pi
均勻度(Pielou,1966):J=H′/log2S
豐富度(Margalef,1958):d=(S-1)/log2N
優(yōu)勢度(Manauhton):D2=(N1+N2)/NT
物種優(yōu)勢度:Y=(ni/N)×fi
其中,ni為某樣品第i個物種的個體數(shù),N為樣品的總個體數(shù),S為樣品中物種總數(shù);Pi為第i種的個體數(shù)(ni)與總個體數(shù)(N)之比值;N1為樣品中第一優(yōu)勢種的個數(shù),N2為樣品中第二優(yōu)勢種的個數(shù),NT為所有樣品的總個體數(shù),fi為出現(xiàn)頻率,當物種優(yōu)勢度(Y)>0.02時,該種即為優(yōu)勢種。
2 結(jié)果與分析
2.1 種類組成
如表1和表2所示,經(jīng)鑒定,福建連江的海帶循環(huán)制冷育苗水體的浮游植物共5門31屬43種(包括變種和變型等),分屬于藍藻門、甲藻門、硅藻門、裸藻門和綠藻門,以廣溫種和暖水種為主。其中,以硅藻門出現(xiàn)的種類數(shù)最多,共22屬32種,占總種數(shù)的74.42%;其次是綠藻門共5屬7種,占總種數(shù)的16.28%;甲藻門種類數(shù)共2屬2種,占總種數(shù)的4.65%;藍藻門和裸藻門最少,均為1屬1種,各占總種數(shù)的2.33%。不同時期的海帶育苗水體中的浮游植物種類數(shù)在9~23種之間,其中第1天出現(xiàn)種類數(shù)最多為23種,其次是第8天出現(xiàn)的種類數(shù)為18種,第29天、36天和43天出現(xiàn)的種類數(shù)最少,均為9種。

表1 不同采集時間內(nèi)海帶循環(huán)制冷育苗水體的浮游植物種類數(shù)Tab.1 Species numbers of phytoplankton collected from circulated cold seawater in different sam p ling time of Saccharina japonica
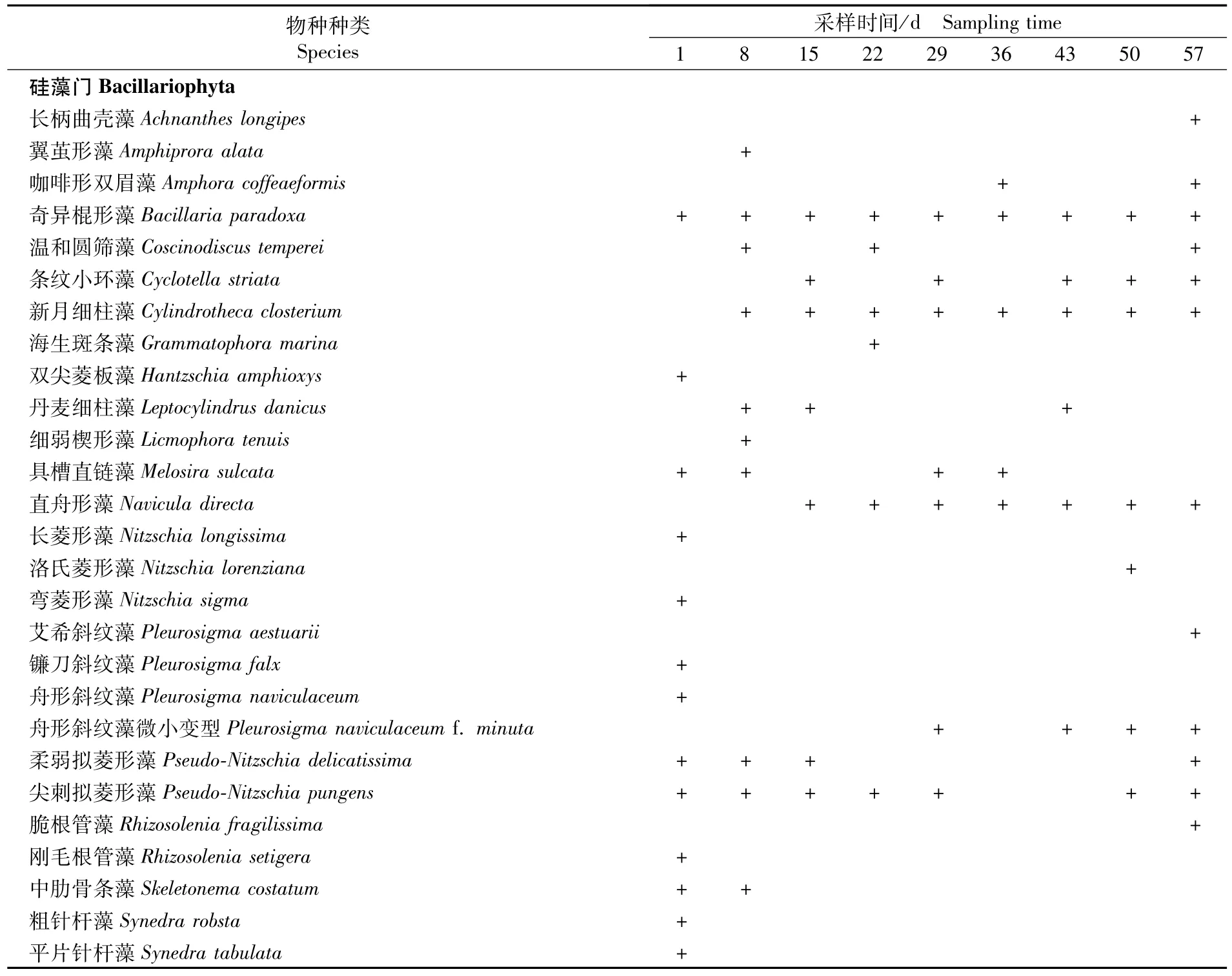
表2 不同采集時間內(nèi)海帶循環(huán)制冷育苗水體的浮游植物種類組成Tab.2 Species com position of phytop lankton collected from circulated cold seawater in different sam pling time of Saccharina japonica

續(xù)表2

表3 不同采集時間的海帶循環(huán)制冷育苗水體浮游植物優(yōu)勢種的數(shù)量比例Tab.3 Proportions of cell numbers of dom inate phytoplankton collected from circulated cold seawater in different sam pling time of Saccharina japonica
2.2 優(yōu)勢種及其變化
以物種優(yōu)勢度Y>0.02計算,整個海帶育苗水體浮游植物的優(yōu)勢種包括奇異棍形藻(Bacillaria paradoxa)、佛氏海毛藻(Thalassiothrix frauenfeldii)、新月細柱藻(Cylindrotheca closterium)、直舟形藻(Navicula directa)和菱形海線藻(Thalassionema nitzschioides)。硅藻門的優(yōu)勢地位較明顯。如表3所示,從各種類數(shù)量占浮游植物總數(shù)量的比例來看,整個海帶育苗期間水體內(nèi)的第一優(yōu)勢種均為奇異棍形藻(屬廣布性的赤潮生物),細胞數(shù)量占總細胞數(shù)量的比例在29.9%~77.5%之間。在育苗期的8 d、36 d和43 d水體內(nèi)的第二優(yōu)勢種為新月細柱藻,育苗期的22 d、29 d、50 d、57 d水體內(nèi)的第二優(yōu)勢種為佛氏海毛藻。所有樣本的第二優(yōu)勢種數(shù)量占總細胞數(shù)量的比例在8.3%~31.7%之間。整個海帶育苗水體的浮游植物優(yōu)勢種變化較簡單,第一優(yōu)勢種一直是奇異棍形藻,在29 d時的育苗水體和維尼龍附苗器上發(fā)現(xiàn)存在大量的奇異棍形藻(圖2-A,B),而第二優(yōu)勢種則由佛氏海毛藻和新月細柱藻兩者相互更替。
2.3 生態(tài)特征指數(shù)的變化
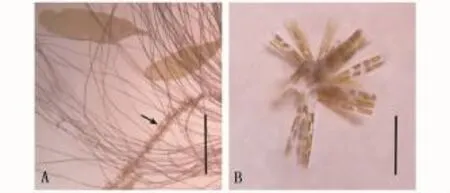
圖2 海帶循環(huán)制冷育苗水體中的奇異棍形藻Fig.2 Bacillaria paradoxa in circulated cold seawater of Saccharina japonica
從表4可以看出,本次調(diào)查浮游植物細胞數(shù)量(N)范圍為0.26×104~0.91×105cell·L-1,不同取樣時間的浮游植物的生態(tài)特征指數(shù)差異較大,22 d時育苗水體的細胞總數(shù)量上升一個數(shù)量級,細胞總數(shù)量呈現(xiàn)初期數(shù)量較低,隨后逐步增加后略有降低并再次稍微增加的變化過程。整個海帶循環(huán)制冷育苗水體中浮游植物的豐富度(d)在0.485~1.500之間,豐富度呈現(xiàn)逐步下降的態(tài)勢;群落多樣性指數(shù)(H′)分布范圍為1.172~3.225;均勻度(J)分布范圍為0.370~0.806;優(yōu)勢度(D2)分布范圍為0.486~0.867。15 d時的育苗水體多樣性指數(shù)、均勻度和豐富度都逐步降低,而優(yōu)勢度小幅度升高,在15~57 d階段趨于穩(wěn)定,變化幅度極小,優(yōu)勢種的優(yōu)勢地位明顯,群落結(jié)構(gòu)比較不均勻。
3 討論
3.1 浮游植物種類分析
海帶室內(nèi)自然光育苗系統(tǒng)是一個簡單的海水循環(huán)制冷育苗系統(tǒng),育苗期間水體溫度通常控制在9~11℃[8]。本試驗發(fā)現(xiàn)1 d的水樣中存在淡水型藻類,即銀灰平裂藻(Merismopedia glauca),該種藻類極大程度上是由靠近海帶育苗場的山澗溪流滲入啟用前的蓄水池,與后來的新鮮海水混合在一起進入循環(huán)制冷育苗車間。1 d的水樣中浮游植物種類最多,達23種,可能與來自開放性海域海水中的浮游植物種類較豐富且缺乏競爭性生物有關(guān)。海帶育苗車間的浮游植物主要以硅藻門為主,而甲藻門、藍藻門等表征富營養(yǎng)化浮游藻類比例極低,僅在抽檢的1 d和8 d水樣中有發(fā)現(xiàn)。15~43 d育苗水體的浮游植物種類數(shù)逐漸減少,這可能是海區(qū)環(huán)境與冷卻循環(huán)水環(huán)境差異較大,環(huán)境突變導致浮游植物種類數(shù)和細胞數(shù)量降低。然而,50 d和57 d時抽檢水體中浮游植物的種類增加,可能是部分環(huán)境適應(yīng)性強的藻類增加所引起的。另外,相關(guān)研究表明大型海藻可以通過感化作用來抑制微型浮游植物的生長與增殖[9-10]。在實際觀察時也發(fā)現(xiàn)大量的奇異棍形藻附著在海帶幼苗表面(圖2-A),推測優(yōu)勢種富集在海帶幼苗表面競爭到更多空間,一定程度上緩解了海帶幼苗對優(yōu)勢種生長的化感抑制作用,利于其它類型浮游植物增殖與生長。
3.2 浮游植物數(shù)量與優(yōu)勢種變化分析
浮游植物數(shù)量變化主要取決于水體中營養(yǎng)鹽含量的分布[11]。海帶循環(huán)制冷育苗系統(tǒng)的水體交換較頻繁,營養(yǎng)鹽分布均衡,因此在逐步添加營養(yǎng)鹽時浮游植物的數(shù)量在同一時期育苗水體中的分布相對較均勻。此外,福建連江海域沿岸主要以海水養(yǎng)殖業(yè)為主,無大型工業(yè)基地和生活區(qū),短時間內(nèi)浮游植物的分布相對均勻,引入海帶育苗系統(tǒng)的冷卻海水中的浮游植物數(shù)量也相對穩(wěn)定。15 d前的育苗水體中幾乎不添加任何營養(yǎng)鹽,而29 d后通常會向水體添加適量的營養(yǎng)鹽,既促進海帶幼孢子體的生長可能也促進了浮游植物增殖,尤其體現(xiàn)在育苗后期的浮游植物細胞數(shù)量明顯增多。在優(yōu)勢種方面,第一優(yōu)勢種一直是奇異棍形藻,第二優(yōu)勢種是佛氏海毛藻和新月細柱藻,3者都屬于廣溫種[3],可以在較低的水溫環(huán)境下生長,但是歷史記錄表明福建沿海夏季海水中以弱偽菱形藻(Pseudo-Nitzschiadelicatissima)、中肋骨條藻(Skeletonema costatum)和旋鏈角毛藻(Chaetoceros curvisetus)等適應(yīng)富營養(yǎng)化理化特征種類為主要優(yōu)勢種[12-13],自然海水進入循環(huán)制冷系統(tǒng)后,浮游植物優(yōu)勢種是如何發(fā)生演替的,與各營養(yǎng)鹽濃度的相關(guān)性如何,還需進一步研究。此外,越來越多的研究發(fā)現(xiàn)大型藻類可以分泌化感物質(zhì)來抑制浮游植物生長,海帶在生長過程中也能通過化學防御來阻礙中肋骨條藻等赤潮藻類的生長[9],因此不同生長期的海帶幼苗對優(yōu)勢種的化感抑制作用機制也有待研究。
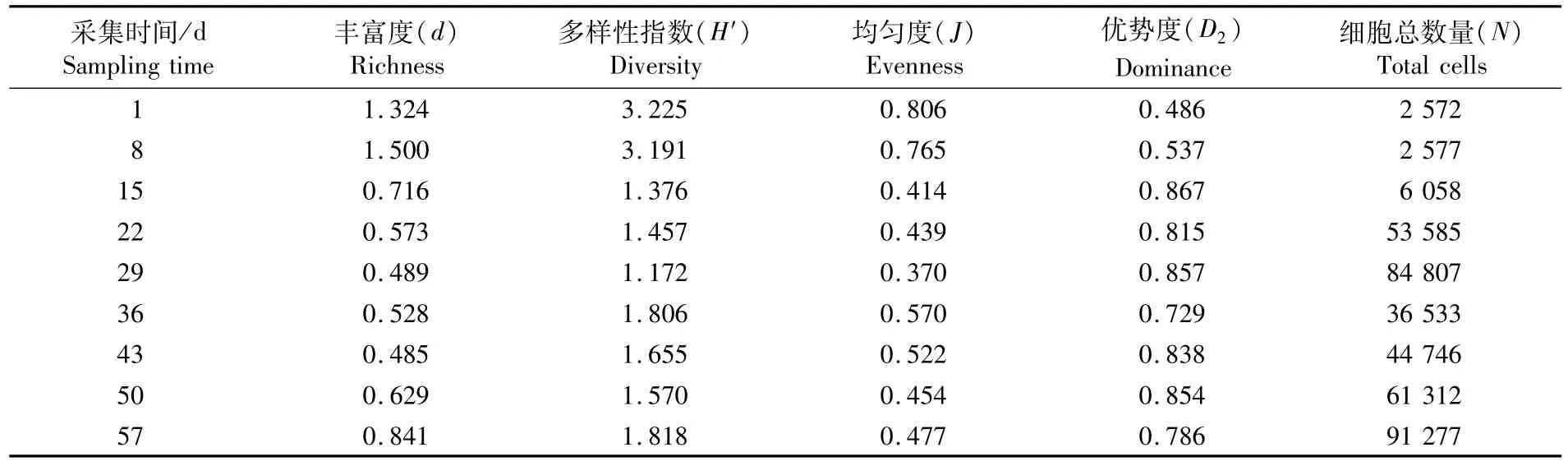
表4 不同采集時間海帶育苗水體的浮游植物生態(tài)群落特征參數(shù)Tab.4 Ecological characteristic indices of phytoplankton collected from circulated cold seawater in different sam pling time of Saccharina japonica
3.3 浮游植物多樣性分析
浮游植物的多樣性指數(shù)與水體生態(tài)環(huán)境因子的穩(wěn)定性相關(guān)[14]。海帶室內(nèi)人工育苗系統(tǒng)的光照、溫度和營養(yǎng)鹽供給較穩(wěn)定,那么造成浮游植物多樣性變化的因素可能與海帶幼苗的生長發(fā)育有關(guān)。通常情況下,富營養(yǎng)化水體中的浮游植物種類數(shù)相對較少,優(yōu)勢種的比例增加,多樣性指數(shù)和均勻度都會降低[15]。本次調(diào)查發(fā)現(xiàn)浮游植物的多樣性指數(shù)呈現(xiàn)遞減并趨于穩(wěn)定的態(tài)勢。在抽檢1 d和8 d的海水樣品中的浮游植物種類較多,多樣性指數(shù)也較高,這可能是海帶幼苗處在生長發(fā)育前期,個體較小,無生長競爭優(yōu)勢,較利于浮游植物的增殖。在育苗15 d時,抽檢水樣中的浮游植物多樣性指數(shù)降低,豐富度也逐漸降低,推測海帶幼苗逐步趨于快速生長,對浮游植物生長的化感抑制作用增強,易于競爭水體中的營養(yǎng)鹽,占據(jù)生長優(yōu)勢地位。在15~57 d的育苗階段,冷卻循環(huán)水育苗車間的浮游植物多樣性指數(shù)(H′)整體介于1.172~1.818之間,多樣性水平不高,群落結(jié)構(gòu)不勻稱,變化幅度較小,這說明在海帶幼苗生長發(fā)育過程的生態(tài)系統(tǒng)處于相對穩(wěn)定狀態(tài),較利于海帶幼苗的生長。
[1] 農(nóng)業(yè)部漁業(yè)局.中國漁業(yè)統(tǒng)計年鑒[M].北京:中國農(nóng)業(yè)出版社,2012:1-85.
Fisheries Bureau of Agriculture Ministry.China Fishery Statistical Yearbook[M].Beijing:China Agriculture Press,2012:1-85.
[2] 金振輝,劉 巖,張 靜,等.中國海帶養(yǎng)殖現(xiàn)狀與發(fā)展趨勢[J].海洋湖沼通報,2009(1):141-150.
JIN Z H,LIU Y,ZHANG J,et al.Breeding actuality and developing direction ofLaminariain China[J].Transactions of Oceanology and Limnology,2009(1):141-150.
[3] 林更銘,楊清良.臺灣海峽小型浮游植物的多樣性和分布特征[J].生物多樣性,2007,15(1):31-45.
LIN G M,YANG Q L.Species diversity and the distribution of micro-phytoplankton in the Taiwan Strait[J].Biodiversity Science,2007,15(1):31-45.
[4] 單體鋒,劉 峰,劉啟順,等.海帶幼苗低溫度夏技術(shù)的回顧與展望[J].中國農(nóng)業(yè)科技導報,2011,13(2):129-134.
SHAN T F,LIU F,LIU Q S,et al.Review and prospect of“Summer Sporing”technique ofSaccharina japonicain China[J].Journal of Agricultural Science and Technology,2011,13(2):129-134.
[5] 李 濤,王飛久,孫修濤,等.GeO2對海帶幼孢子體培育過程中硅藻污染的抑制效應(yīng)[J].漁業(yè)科學進展,2012,33(3):83-87.
LIT,WANG F J,SUN X T,et al.Suppressive effect of germanium dioxide on diatom contamination during cultivation ofSaccharina japonicayoung sporophytes[J].Progress in Fishery Sciences,2012,33(3):83-87.
[6] 束蘊芳,韓茂森.中國海洋浮游生物圖譜[M].北京:海洋出版社,1992:1-21.
SU Y F,HAN M S.Atlas of Marine Plankton in China[M].Beijing:China Ocean Press,1992:1-21.
[7] 楊世民,董樹剛.中國海域常見浮游硅藻圖譜[M].青島:中國海洋大學出版社,2006:1-267.
YANG S M,DONG S G.A common planktonic diatom map in Chinese waters[M].Qingdao:China Ocean University Press,2006:1-267.
[8] 曾呈奎,王素娟,劉思儉,等.海藻栽培學[M].上海:上海科學技術(shù)出版社,1985:55-121.
ZENG C K,WANG S J,LIU S J,et al.Cultivation of Seaweed[M].Shanghai:Shanghai Science and Technology Press,1985:55-121.
[9] 安 蓁.大型海藻及納米材料對赤潮中肋骨條藻的抑制作用研究[D].青島:中國海洋大學,2008.
AN Z.The research of inhibitory effect on red tideSkeletonema costatumby macroalgae and nanomaterials[D].Qingdao:Ocean University of China,2008.
[10] 李 斌.海洋大型藻類對微藻類的化感作用[D].大連:大連海事大學,2015.
LI B.The allelopathy on microalgaes caused by marine macroalgaes[D].Dalian:Dalian Maritime University,2015.
[11] BU-OLAYAN A H,AI-HASSAN R,THOMASB V,et al.Impact of tracemetals and nutrients levels on phytoplankton from the Kuwait coast[J].Environment International,2001,26(4):199-203.
[12] 王 雨,林 茂,林更銘.福建沿岸不同海區(qū)夏季浮游植物的組成與分布[J].臺灣海峽,2009,28(4):496-503.
WANG Y,LIN M,LIN G M.Study on the composition and distribution of phytoplankton on different waters of coastal Fujian in summer[J].Journal of Oceanography in Taiwan Strait.2009,28(4):496-503.
[13] 羅民波,陸健健,王云龍,等.東海浮游植物數(shù)量分布與優(yōu)勢種[J].生態(tài)學報,2007,27(12):5076-5085.
LUO M B,LU J J,WANG Y L,et al.Horizontal distribution and dominant species of phytoplankton in the East China Sea[J].Acta Ecologica Sinica,2007,27(12):5076-5085.
[14] ELTON C S.The Ecology of Invasions by Animals and Plants[M].London:Methuen and Co Ltd,1958.
[15] 韋昌用,王大鵬,張益峰,等.新村灣珍珠貝養(yǎng)殖區(qū)浮游植物現(xiàn)狀調(diào)查分析[J].南方農(nóng)業(yè)學報,2014,45(7):1286-1290.
WEI C Y,WANG D P,ZHANG Y F,et al.Investigation and analysis of phytoplankton in pearl oyster culture area of Xincun bay[J].Journal of Southern Agriculture,2014,45(7):1286-1290.
Analysis of phytoplankton community structure in circulated cold seawater from the breeding room of Saccharina japonica in Lianjiang,F(xiàn)ujian Province
ZHONG Chen-hui1,YANG Fang1,LIN Qi1,GUO Shu-yue1,HUANG Rui-fang1,LIN Xiang-yang1,SONGWu-lin2,CHEN De-fu3
(1.Fujian Fisheries Research Institute,F(xiàn)ujian Key Laboratory of Cultivation and High-value Utilization of Marine Organisms,Xiamen 361013,F(xiàn)ujian,China;2.Fujian Marine Economic Operation Monitoring and Assessment Center,F(xiàn)uzhou 350003,F(xiàn)ujian,China;3.Fujian Guanwu Marine Products and Development co.,LTD,Lianjiang350511,F(xiàn)ujian,China)
Characterization of phytoplankton community structure in circulated cold seawater from the whole breeding stages ofSaccharina japonicawas studied.We collected nine samples from circulated cold seawater in the breeding room of S.japonica in Guanwu Marine Products and Development Co.,LTD,from late September to middle November of 2014.The species composition,dominate species,and ecological characteristic of phytoplankton were analyzed.The results showed that a total of 43 species belonging to 5 phyla and 31 genera were indetified.The richest Bacillariophyta consisting of 32 species belonged to 22 genera,accounting for 74.42%,whereas the rest were Pyrrophyta,Chlorophyta,Cyanophyta and Euglenophyta.Furthermore,the first dominate species was alwaysBacillaria paradoxa,eitherThalassiothrixfrauenfeldii or Cylindrotheca closterium was the second dominate species,suggesting that simple composition and unconspicuous temporal changes of dominate specieswere involved in the circulated cold seawater.From 1d to 8d in the growth stages of S.japonica,the diversity indices,evenness indices and richness indices of the phytoplankton were 3.191-3.225,0.765-0.806 and 1.324-1.500,respectively.However,from 15 d to 57 d in the growth stages,the diversity indiceswere 1.172-1.818,the evenness indiceswere 0.370-0.570,and the richness indiceswere 0.485-0.841.Therefore,the circulated cold seawater was suitable to propagate young blades of S.japonica as a consequence of phytoplankton with small variations in ecological and diversity indices,and unstable community structure.
Saccharina japonica;phytoplankton;circulated cold seawater;species composition;dominate species
S 932.7
A
1004-2490(2016)03-0283-08
2015-11-04
福建省自然科學基金(2014J01095);福建省海洋高新產(chǎn)業(yè)發(fā)展專項(閩海洋高新2014-19);福建省屬公益類科研院所基本科研專項(閩海漁科2013R001-1);福建省種業(yè)創(chuàng)新與產(chǎn)業(yè)化工程(2014S1477-10);福建省海洋與漁業(yè)結(jié)構(gòu)調(diào)整專項
鐘晨輝(1984-),男,助理研究員,博士研究生,主要從事藻類生理生態(tài)與遺傳育種研究。E-mail:zhongchenhui@126.com

