新型四陽離子型1,2,3-三唑鎓環蕃的合成
段群鵬, 盧 奎
(1. 河南工程學院 材料與化學工程學院,河南 鄭州 451191;
2. 河南工業大學 化學化工學院,河南 鄭州 450052)
?
·快遞論文·
新型四陽離子型1,2,3-三唑鎓環蕃的合成
段群鵬1*, 盧奎1,2
(1. 河南工程學院 材料與化學工程學院,河南 鄭州451191;
2. 河南工業大學 化學化工學院,河南 鄭州450052)
摘要:以間苯二酚為原料,經5步反應制得中間體4,4′-[4,6-雙(己氧基)-1,3亞苯基]雙{1-[4-(疊氮甲基)苯基]-1H-1,2,3-三氮唑}(6); 6與1,5-二乙炔基-1,4-二(己氧基)苯在高度稀釋的條件下經Click反應環合制得1,2,3-三唑環蕃(7); 7與三甲基氧鎓四氟硼酸鹽反應合成了全甲基化的新型1,2,3-三唑鎓環蕃,其結構經1H NMR,13C NMR和HR-ESI-MS表征。
關鍵詞:四陽離子; 1,2,3-三唑鎓; 環蕃; 合成
環蕃是一類以平面芳環為構筑基元,通過脂肪鏈連接而形成的環狀分子[1]。環蕃不僅兼備冠(穴)醚、環糊精和多齒配體的特性和結構優勢,還具有合成方法與結構修飾的靈活多樣性,能更好的發揮氫鍵、疏水作用、靜電作用、π-π、陽離子-π的協同效應,故在主-客體化學、超分子化學、模擬酶、仿生化學、分子自組裝及材料科學領域受到廣泛關注[2]。
三唑蕃是一類由一個或多個三唑環通過各種分子模塊連接而成的新型環蕃[3]。三唑蕃因其三唑環的π-π共軛體系,環上2個碳原子上的電子云密度較低,5-位碳原子上的氫原子可與各種陰離子形成氫鍵,這種非共價鍵相互作用具有方向性,與多種陰離子親和力較好[4]。更為重要的是,三唑環可與含有氫原子的苯環、吡咯等芳香環形成環狀空腔結構,并包結陰離子形成超分子絡合物。此外,三唑環作為陰離子受體,對鹵素離子和焦磷酸根離子等陰離子均有較好的識別作用[5-7]。三唑蕃中三唑環上的氮原子易季銨化形成三唑鎓蕃。三唑鎓蕃因三唑鎓提供的正電荷,可以更好的適應客體的結構與電學特性,從而成為一種良好的主體分子[8-9]。但在環蕃主體中引入三唑鎓越多,其合成和分離的難度越大。因此近年來鮮有關于這種包含四個三唑鎓組分的大環蕃的報道。
基于此,本文以間苯二酚為原料,經5步反應制得中間體4,4′-[4,6-雙(己氧基)-1,3-亞苯基]雙{1-[4-(疊氮甲基)苯基]-1H-1,2,3-三氮唑]}(6); 6與1,5-二乙炔基-1,4-二(己氧基)苯在高度稀釋的條件下經Click反應環合制得1,2,3-三唑環蕃(7); 7與三甲基氧鎓四氟硼酸鹽反應合成了全甲基化的新型1,2,3-三唑鎓環蕃(8, Scheme 1),其結構經1H NMR,13C NMR和LR-ESI-MS表征。
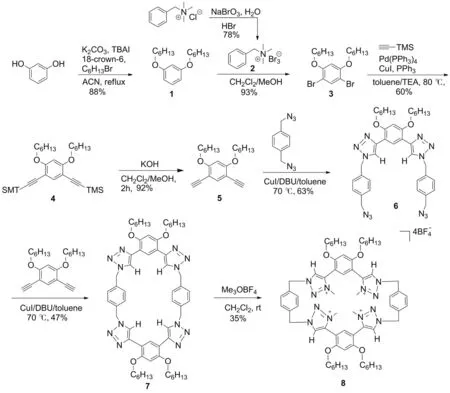
Scheme 1
1實驗部分
1.1儀器與試劑
X-4型熔點儀(溫度未校正);Bruker AVANCE DMX 400 MHz型核磁共振儀(CDCl3或DMSO-d6為溶劑,TMS為內標);Finnigan Mat TSQ 7000 型質譜儀。
1,4-二疊氮甲基苯按文獻[10]方法合成;1,8-二氮雜雙環[5.4.0]十一碳-7-烯(DBU),上海阿拉丁生化科技股份有限公司;其余所用試劑均為分析純,使用前按標準方法純化。
1.2合成
(1) 1,3-二(己氧基)苯(1)的合成[11]
氬氣保護下,在三口燒瓶中依次加入間苯二酚16.6 g(150.0 mmol), K2CO362.2 g, 18-冠-6 1.98 g,四丁基碘化銨(TBAI)5.54 g和脫氣乙腈200 mL,攪拌使其溶解;加入溴己烷42.6 mL(300 mmol),回流反應過夜(TLC檢測)。冷卻至室溫,過濾,濾液旋蒸濃縮后經硅膠柱層析[洗脫劑:A=V(石油醚) ∶V(乙酸乙酯)=8 ∶1]純化得紅色油狀液體1 36.7 g,收率88%;1H NMRδ: 7.15(t,J=8.1 Hz, 1H), 6.48(m, 3H), 3.93(t,J=6.6 Hz, 4H), 1.81~1.72(m, 4H), 1.45~1.26(m, 12H), 0.90(t,J=6.6 Hz, 6H)。
(2) 芐基三甲基三溴化銨(2)的合成[12]
在單口燒瓶中依次加入芐基三甲基氯化銨34.1 g(180.0 mmol),溴酸鈉13.6 g (90.0 mmol)和水300 mL,攪拌使其溶解;加入40%氫溴酸73.3 mL,于室溫反應1 h(TLC檢測)。抽濾,濾餅用二氯甲烷(4×150 mL)洗滌,合并濾液和洗液,用無水硫酸鎂干燥;過濾,濾液真空濃縮后用混合溶劑[V(二氯甲烷) ∶V(乙醚)=10 ∶1]重結晶得橙色晶體2 55.4 g,收率79%, m.p.100~102 ℃。
(3) 1,5-二溴-2,4-二(己氧基)苯(3)的合成[12]
在單口燒瓶中加入1 36.7 g(132.0 mmol), 2 53.02 g(136.0 mmol),二氯甲烷500 mL和甲醇200 mL,攪拌下于室溫反應10 h(TLC檢測)。旋蒸除溶,殘余物加水200 mL,用乙醚萃取,合并有機相,用無水硫酸鎂干燥;過濾,濾液經真空濃縮后經硅膠柱層析(洗脫劑:A= 8 ∶1)純化得橙色固體3 26.14 g,收率93%;1H NMRδ: 7.64(s, 1H), 6.46(s, 1H), 3.99(t,J=6.4 Hz, 4H), 1.87~1.78(m, 4H), 1.56~1.48(m, 4H), 1.36~1.26(m, 8H), 0.91(t,J=6.3 Hz, 6H)。
(4) 2,4-二(己氧基)-1,5-二(三甲基硅-乙炔基)苯(4)的合成[11]
氬氣保護下,在三口燒瓶中依次加入3 6.0 g(13.76 mmol),碘化亞銅210 mg,四(三苯基膦)鈀1.27 mg,三苯基膦362 mg,脫氣甲苯100 mL和干燥三乙胺70 mL,攪拌使其溶解;加入三甲基乙炔基硅5.9 mL(41.28 mmol),攪拌下于80 ℃反應3 d(TLC檢測)。冷卻至室溫,過濾,濾液濃縮,殘余物用二氯甲烷溶解,依次用水和飽和食鹽水洗滌,無水硫酸鎂干燥;過濾,濾液濃縮后經硅膠柱層析(洗脫劑:石油醚)純化得淡黃色固體4 3.85 g,收率60%;1H NMRδ: 7.50(s, 1H), 6.30(s, 1H), 3.99(t,J=6.3 Hz, 4H), 1.87~1.78(m, 5H), 1.55~1.48(m, 8H), 1.37~1.31(m, 12H), 0.93~0.83(m, 6H), 0.23(s, 18H)。
(5) 1,5-二乙炔基-2,4-二(己氧基)苯(5)的合成[13]
在單口燒瓶中依次加入4 2.29 g(4.87 mmol),脫氣甲醇40 mL, 0.1 mol·L-1氫氧化鉀溶液1.4 mL和二氯甲烷5 mL,攪拌下于室溫反應2 h(TLC檢測)。旋蒸除溶,殘余物用二氯甲烷100 mL溶解,用水(2×100 mL)洗滌,無水硫酸鎂干燥;過濾,濾液濃縮得淡黃色固體5 1.46 g,收率92%;1H NMRδ: 7.53(s, 1H), 6.37(s, 1H), 4.03(t,J=6.5 Hz, 4H), 3.16(s, 2H), 1.89~1.80(m, 4H), 1.55~1.45(m, 4H), 1.35(m, 8H), 0.93~0.83(m, 6H)。
(6) 6的合成[14]
氬氣保護下,在三口燒瓶中依次加入1,4-二疊氮甲基苯376.0 mg(2.0 mmol),碘化亞銅90.0 mg, DBU 0.6 mL和脫氣甲苯20 mL,攪拌下于70 ℃緩慢滴加5 163.0 mg(0.5 mmol)的甲苯(30 mL)溶液,滴畢(12 h內),反應2 h(TLC檢測)。冷卻至室溫,旋蒸除溶,殘余物經硅膠柱層析[洗脫劑:B=V(二氯甲烷) ∶V(甲醇) =100 ∶1]純化得黑色晶狀固體6 220 mg,收率63%, m.p.109~111 ℃;1H NMRδ: 9.13(s, 1H), 7.87(s, 2H), 7.33(s, 8H), 6.49(s, 1H), 5.59(s, 4H), 4.35(s, 4H), 4.03(t,J=6.4 Hz, 4H), 1.82~1.70(m, 4H), 1.44~1.26(m, 12H), 0.90(t,J=6.8 Hz, 6H);13C NMRδ: 156.2, 143.9, 135.9, 135.4, 128.9, 128.5, 127.4, 122.2, 112.5, 96.4, 68.6, 54.4, 53.7, 31.6, 29.3, 25.9, 22.7, 14.2; LR-ESI-MSm/z: 703.35{[M+H]+}, 725.30{[M+Na]+}。
(7) 7的合成[14]
氬氣保護下,在三口燒瓶中依次加入DBU 1.6 mL,脫氣甲苯200 mL和碘化亞銅52 mg,攪拌下用恒流注射泵于70 ℃滴加5 89.0 mg(0.3 mmol)和6 190.0 mg(0.3 mmol)的甲苯(50 mL)溶液,滴畢(24 h內),反應4 h(TLC檢測)。冷卻至室溫,旋蒸除溶,殘余物經硅膠柱層析(洗脫劑:B=60 ∶1)純化得白色固體7 130 mg,收率47%, m.p.>250 ℃;1H NMRδ: 8.40(s, 2H), 8.17(s, 4H), 7.24(s, 8H), 6.71(s, 2H), 5.61(s, 8H), 4.10(t,J=5.4 Hz, 8H), 1.86~1.77(m, 8H), 1.41~1.28(m, 24H), 0.84(t,J=6.6 Hz, 12H);13C NMRδ: 155.4, 142.4, 136.6, 128.2, 126.7, 122.6, 111.8, 97.3, 68.3, 52.4, 30.9, 28.4, 25.2, 22.1, 13.8; LR-ESI-MSm/z: 1 029.50{[M+H]+}。
(8) 8的合成[9,15]
氬氣保護下,在兩口燒瓶中加入7 70 mg(0.07 mmol),三甲基氧鎓四氟硼酸49.7 mg(0.34 mmol)和干燥二氯甲烷20 mL,攪拌下于室溫反應3 d(TLC檢測)。滴加甲醇10滴淬滅反應,旋蒸除溶,殘余物經硅膠柱層析(洗脫劑:B=20 ∶1)純化得淡黃色固體8 35 mg,收率35%;1H NMRδ: 8.45(s, 4H), 7.55(s, 8H), 7.39(s, 2H), 6.63(s, 2H), 5.75(s, 8H), 4.12~4.09(m, 20H), 1.77~1.72(m, 8H), 1.30(m, 26H), 0.86~0.84(m, 14H);13C NMRδ: 154.7, 137.1, 133.2, 127.2, 126.6, 123.0, 114.3, 99.6, 69.0, 62.0, 33.2, 31.8, 29.6, 25.6, 22.7, 14.1; HR-ESI-MSm/z: Calcd for C64H88N12O4B2F8{[M-2BF4]2+} 631.54, found 631.50; Calcd for C64H88N12O4BF4{[M-3BF4]3+} 392.09, found 392.00。
2結果與討論
合成.5時,文獻[16]方法使用K2CO3,四丁基氟化銨(TBAF)或KOH均可脫除炔基保護基TMS。本實驗中單獨使用K2CO3并未得到5,換用TBAF或KOH則成功脫去TMS。實驗中最終采用KOH脫除TMS,反應在2 h內結束,5純度較高,無需純化。
合成6時,由于疊氮化物光分解或熱裂解容易放出氮氣生成氮烯,6經柱層析純化時可能會因室溫較高及柱層析時使用CH2Cl2(CH2Cl2和硅膠的吸附均為放熱過程)導致6部分分解放出氮氣形成氮烯結構,故6純化時需使用快速柱層析分離。
合成7時采用了高度稀釋法。該方法是在大量溶劑中,通過控制反應物的滴加速度,減少副反應發生,從而提高收率。實驗中使用恒流注射泵精確控制反應物滴加速度,使收率由5%(恒壓滴液漏斗)提高至47%。
合成8的反應涉及三氮唑甲基化反應。最初是以MeI作甲基化試劑,但反應較長時間后TLC仍可檢測到7, 其原因可能是7的大環具有較強的空間位阻,導致該反應需要較高的能量和較好的甲基化試劑。因此停止反應,旋蒸除去MeI,加入米爾文鹽——三甲基氧鎓四氟硼酸作甲基化試劑[9,15],繼續反應3 d, TLC檢測反應完全。
參考文獻
[1]宗婷,孫小強,席海濤. 新型含硫代乙酸酯缺電子環蕃的合成[J].合成化學,2014,22(6):778-780.
[2]席海濤,孫小強,孟啟,等.缺電子聯吡啶環蕃的研究[J].化學進展,2008, 20(1):88-90.
[3]Mohan A, Sankararaman S. 1,2,3-Triazolophanes—cyclophanes with an array of molecular structures and supramolecular architectures [J].Isr J Chem,2012,52(1-2):92-104.
[4]常娟娟,王艷,張慧珍,等. 三唑類超分子化學與藥物研究新進展[J].高等學校化學學報,2011,32(9):1970-1985.
[5]Li Y J, Flood A H. Pure C-H hydrogen bonding to chloride ions:A preorganized and rigid macrocyclic receptor [J].Angew Chem Int Ed,2008,47(14):2649-2652.
[6]Li Y J, Flood A H. Strong,size-selective,and electronically tunable C-H┉halide binding with steric control over aggregation from synthetically modular,shape-persistent [34]triazolophanes [J].J Am Chem Soc,2008,130(36):12111-12222.
[7]Sessler J L, Cai J, Gong H Y,etal. A pyrrolyl-based triazolophane:A macrocyclic receptor with CH and NH donor groups that exhibits a preference for pyrophosphate anions [J].J Am Chem Soc,2010,132(40):14058-14060.
[8]White N G, Carvalho S, Félix V,etal. Anion binding in aqueous media by a tetra-triazolium macrocycle [J].Org Biomol Chem,2012,10(34):6951-6959.
[9]Cai J J, Hay B P, Young N J,etal. A pyrrole-based triazolium-phane with NH and cationic CH donor groups as a receptor for tetrahedral oxyanions that functions in polar media [J].Chem Sci,2013,4:1560-1567.
[10]Demko ZP, Sharpless K B. A click chemistry approach to tetrazoles by Huisgen 1,3-dipolar cycloaddition:Synthesis of 5-sulfonyl tetrazoles from azides and sulfonyl cyanides [J].Angew Chem Int Ed,2002,41(12):2110-2113.
[11]Zornik D, Meudtner, R K, Malah T E,etal. Designing structural motifs for clickamers:Exploiting the 1,2,3-triazole moiety to generate conformationally restricted molecular architectures [J].Chem Eur J,2011,17(5):1473-1484.
[12]Kajigaeshi S, Kakinami T, Tokiyama H,etal. Synthesis of dibromoacetyl derivatives by use of benzyltrimethylammonium tribromide [J].Bull Chem Soc Jpn,1987,60(7):2667-2668.
[13]Neenan TX, Whitesides G M. Synthesis of high carbon materials from acetylenic precursors:Preparation of aromatic monomers bearing multiple ethynyl groups [J].J Org Chem,1988,53(11):2489-2496.
[14]Duan QP, Xia W, Lin C,etal. Two new triazolophanes:Synthesis,structures,self-assembling,and anion complexation properties [J].Tetrahedron Lett,2015,56(26):4002-4006.
[15]Mullen KM, Mercurio J, Serpell C J,etal. Exploiting the 1,2,3-triazolium motif in anion-templated formation of a bromide-selective rotaxane host assembly [J].Angew Chem Int Ed,2009,48:4781-4784.
[16]Jenny NM, Mayor M, Eaton T R. Phenyl-acetylene bond assembly:A powerful tool for the construction of nanoscale architectures [J].Eur J Org Chem,2011,(26):4965-4983.
Synthesis of A Novel
Tetracationic 1,2,3-Triazolium Cyclophane
DUAN Qun-peng1*,LU Kui1,2
(1. College of Material and Chemistry Engineering, Henan Institute of Engineering, Zhengzhou 451191, China
2. School of Chemistry and Chemical Engineering, Henan University of Technology, Zhengzhou 450052, China)
Abstract:An intermediate, 4,4′-[4,6-bis(hexyloxy)-1,3-phenylene]bis{1-[4-(azidomethyl)benzyl]- 1H-1,2,3-triazole}(6), was prepared by a five-step reaction from resorcinol. 1,2,3-Triazolophane(7) was obtained by Click reaction of 6 with 1,5-diethynyl-2,4-bis(hexyloxy)benzene under pseudo-high dilution conditions. A novel tetramethylated 1,2,3-triazolium-phane was synthesized by the reaction of trimethyloxonium tetrafluoroborate with 7. The structure was characterized by1H NMR,13C NMR and HR-ESI-MS.
Keywords:tetracationic; 1,2,3-triazolium; cyclophane; synthesis
作者簡介:段群鵬(1981-),男,漢族,河南鹿邑人,博士,講師,主要從事大環超分子的研究。 E-mail: dqp117@163.com
基金項目:國家自然科學基金資助項目(21402040, 21172054)
收稿日期:2015-11-05;
修訂日期:2015-12-22
中圖分類號:O621.3; O626.26
文獻標志碼:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.02.15371

