17α,21-二羥基孕甾-4-烯-3,20-二酮-17-戊酸酯的合成
吳慶安, 吳紅衛, 柏 挺
(1. 浙江工業大學 化學工程學院,浙江 杭州 310014; 2. 上海新華聯制藥有限公司,上海 201400)
?
·制藥技術·

通信聯系人: 吳紅衛,碩士研究生, E-mail: heyc27@sina.cn
17α,21-二羥基孕甾-4-烯-3,20-二酮-17-戊酸酯的合成
吳慶安1,2, 吳紅衛1*, 柏挺2
(1. 浙江工業大學 化學工程學院,浙江 杭州310014; 2. 上海新華聯制藥有限公司,上海201400)
摘要:以雄烯二酮為起始原料,經加成、硅醚化、環加成-質子脫硅基化及置換等7步反應合成了氫化可的松的中間體——17α,21-二羥基孕甾-4-烯-3,20-二酮-17-戊酸酯,總收率75%,純度>96%,其結構經1H NMR和ESI-MS確證。
關鍵詞:雄烯二酮; 氫化可的松中間體; 17α,21-二羥基孕甾-4-烯-3, 20-二酮-17-戊酸酯; 合成
氫化可的松,化學名為11β,17α,2l-三羥基孕甾-4-烯-3,20-二酮,是腎上腺糖皮質激素藥物,在激素類藥物中占有重要地位。氫化可的松能夠影響糖代謝,具有抗病毒、消炎、抗過敏及抗休克等作用[1-4]。其傳統合成方法存在的主要問題有:(1)薯蕷資源的日漸枯竭;(2)鉻廢水的處理;(3)碘化反應成本高;(4)利用微生物氧化法引入11β-OH的選擇性較低。
鑒于薯蕷資源的緊缺及傳統合成路線的缺陷,本文通過對多種皮質激素甾體側鏈引入方法的研究比較[5-12],借鑒了Livingston的合成理念,以植物甾醇發酵物雄烯二酮(4-AD)為起始原料,經加成、硅醚化、環加成-質子脫硅基化及置換等7步反應合成了氫化可的松關鍵中間體——17α,21-二羥基孕甾-4-烯-3,20-二酮-17-戊酸酯(1, Scheme 1),總收率75%,純度>96%,其結構經1H NMR和ESI-MS確證。
1實驗部分
1.1 儀器與試劑
YRT-3型熔點儀(溫度未校正);Anance Ⅲ-500MHz型核磁共振儀(CDCl3為溶劑,TMS為內標);Decax-60000 LCQ Deca XP型液相色譜-離子阱質譜聯用儀;Agilent 1100型高效液相色譜儀。
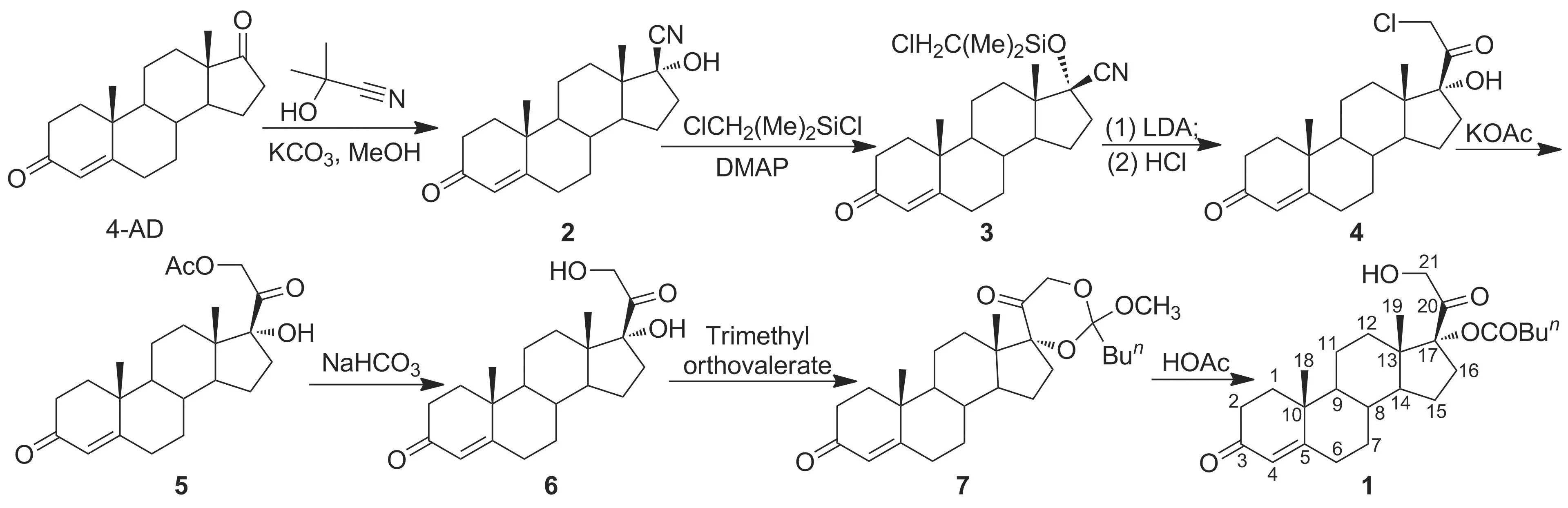
Scheme 1
4-AD,純度98%,上海新華聯制藥有限公司;其余所用試劑均為分析純,上海邁瑞爾化學技術有限公司。
1.2 合成
(1) 17β-氰基-17α-羥基雄甾-4-烯-3-酮(2)的合成[13-15]
氮氣保護下,在反應瓶中依次加入4-AD 5.01 g(17.49 mmol)和甲醇10 mL,攪拌使其溶解;加入丙酮氰醇2.50 mL(27.38 mmol),緩慢滴加K2CO30.45 g的水(10 mL)溶液,滴畢,于30 ℃反應25 h。冷卻至0 ℃,加入冰水10 mL,過濾,濾餅用飽和食鹽水洗至中性,用甲醇重結晶,干燥得白色粉末2 5.28 g,收率96.30%,純度99.07%(HPLC,下同), m.p.158.6~159.3 ℃(159.0~160.5 ℃[16]);1H NMR(DMSO-d6)δ:0.87(s, 3H, 18-H), 1.16(s, 3H, 19-H), 2.41(m, 2H, 2-H), 5.63(s, 1H, 4-H); ESI-MSm/z: 314.2{[M+H]+}。
(2) 17β-氰基-17α-羥基雄甾-4-烯-3-酮-17-(二甲基氯甲基)硅醚(3)的合成[12]
在反應瓶中依次加入2 5.18 g(16.53 mmol), 4-二甲氨基吡啶(DMAP)0.10 g,二氯甲烷75 mL和Et3N 4.78 mL,冷卻至0 ℃,加入氯甲基二甲基氯硅烷3.20 mL(24.29 mmol),于5~10 ℃反應2 h。冷卻至0 ℃,加入冰水15 mL淬滅反應,用10%鹽酸調至pH 3,靜置分層,水相用二氯甲烷(2×15 mL)萃取,合并有機相和萃取液,依次用飽和NaHCO3溶液和飽和NaCl溶液洗滌,無水硫酸鈉干燥,減壓濃縮,干燥得米白色固體3 6.85 g,收率98.67%,純度99.07%, m.p.143.7~145.9 ℃(143~146 ℃)[17];1H NMRδ: 0.38(s, 6H, SiCH3), 0.97(s, 3H, 18-H), 1.22(s, 3H, 19-H), 2.88(m, 2H, 2-H), 5.75(s, 1H, 4-H); ESI-MSm/z: 420.2[M+]。
(3) 17α-羥基-21-氯孕甾-4-烯-3,20-二酮(4)的合成[12]
氮氣保護下,將3 5.15 g(12.26 mmol)溶于無水THF(75 mL)中,冷卻至-72 ℃,攪拌下緩慢滴加2 mol· L-1LDA的THF(15.33 mL)溶液,滴畢;于-40~-35 ℃反應4 h;于-20~-30 ℃緩慢滴加濃鹽酸25 mL,滴畢,加入水60 mL,于室溫反應12 h。于35 ℃減壓蒸餾(析出土黃色固體),抽濾,濾餅用水洗滌,用二氯甲烷/乙醇(V/V=1/10)11 mL精制,干燥得淡黃色固體4 4.10 g,收率91.64%,純度95.23%, m.p.228.2~230.4 ℃(234~235 ℃[18]);1H NMR(DMSO-d6)δ: 0.55(s, 3H, 18-H), 1.14(s, 3H, 19-H), 2.57(m, 2H, 2-H), 4.47(d,J=12.0 Hz, 1H, 21-CH), 4.77(d,J=9.0 Hz, 1H, 21-H), 5.55(s, 1H, 17-OH), 5.64(s, 1H, 4-H); ESI-MSm/z: 365.2[M+]。
(4) 17α,21-二羥基-孕甾-4-烯-3,20-二酮-21-乙酸酯(5)的合成[19-20]
將4 6.95 g (19.05 mmol)溶于DMSO(70 mL)中,攪拌下加入KOAc 17.38 g(177.09 mmol),緩慢升溫至60 ℃,保溫反應3 h。冷卻至室溫,緩慢倒入1.5 L冰水中(析出沉淀),靜置4~6 h,過濾,濾餅用水洗滌,用乙醇14 mL精制,干燥得白色粉末5 7.14 g,收率96.50%,純度98.29%, m.p. 223.3~226.4 ℃(225~226 ℃[11]);1H NMRδ: 0.73(s, 3H, 18-H), 1.20(s, 3H, 19-H), 2.19(s, 3H, OCH3), 4.87(d,J=9.0 Hz, 1H, 21-H), 5.09(d,J=9.0 Hz, 1H, 21-H), 5.75(s, 1H, 4-H); ESI-MSm/z: 389.2{[M+H]+}。
(5) 17α, 21-二羥基-孕甾-4-烯-3, 20-二酮(6)的合成[19-20]
將5 5.06 g(13.03 mmol)溶于甲醇(250 mL)中,攪拌下升溫至50 ℃,加入飽和碳酸氫鈉溶液25 mL,保溫反應2 h。用2%鹽酸調pH至7,于55 ℃減壓濃縮至無溶劑蒸出,加入水100 mL,攪拌2 h,于冰箱中靜置1 h,過濾,濾餅用乙酸乙酯重結晶,干燥得乳白色固體6 4.08 g,收率90.41%,純度97.58%, m.p.202.1~204.4 ℃(207~208 ℃[21]);1H NMRδ: 0.68(s, 3H, 18-H), 1.16(s, 3H, 19-H), 2.66(s, 1H, 17-OH), 3.13(s, 1H, 21-OH), 4.28(d,J=15.0 Hz, 1H, 21-H), 4.64(d,J=15.0 Hz, 1H, 21-H), 5.71(s, 1H, 4-H); ESI-MSm/z: 347.4{[M+H]+}。
(6) 1的合成[22]
在反應瓶中依次加入THF 50 mL, 6 5.05 g(14.58 mmol)和對甲苯磺酸0.15 g(0.87 mmol),氮氣保護,攪拌下升溫至60 ℃,加入原戊酸三甲酯4.80 mL(26.69 mmol),保溫反應3 h。冷卻至-10 ℃,滴加冰醋酸/水(V/V=3/1)混合溶液20 mL,滴畢;于0 ℃反應12 h。用2%氫氧化鈉溶液調至pH≈7,加水50 mL,于80 ℃常壓蒸餾至無液體蒸出,冷卻,靜置,抽濾,濾餅用水洗滌,干燥得白色片狀固體1 6.16 g,收率98.15%,純度96.76%, m.p.118.7~121.9 ℃(115~118 ℃[22]);1H NMRδ: 0.69(s, 3H, 18-H), 0.90(t,J=6.0 Hz, 3H, CH3in Bu), 1.16(s, 3H, 19-H), 2.41(s, 1H, 21-OH), 4.81(d,J=15.0 Hz, 1H, 21-H), 5.07(d,J=15.0 Hz, 1H, 21-H), 5.71(s, H, 14-H); ESI-MSm/z: 431.4{[M+H]+}。
2結果與討論
在2的合成中,用丙酮氰醇代替文獻[15]方法中用到的劇毒品氰化鉀時,反應的立體選擇性不高。但當反應體系中含有鉀離子時,立體選擇性有明顯提高,收率也較高(96.32%),純度99.07%,異構體含量<1%。
在3的合成中,以氯甲基二甲基氯硅烷為硅醚化試劑,不需要對C-3位羰基進行保護,即可在強堿作用下發生分子內的環加成反應。隨后,3在酸性條件下水解生成4。該反應不需要引入碘再置換,即可在C-21位引入一個氯原子。
在5的合成中,傳統方法中C-21位碘被AcO-置換時[19-20],需要加入冰醋酸與I-形成離子氛,從而阻止I-的親核性,促進反應的進行。而由4合成5時,因Cl-親核性比I-小,所以不需要加入冰醋酸,反應就能順利進行。如加入冰醋酸反而會阻礙反應的發生,使反應時間大大延長,雜質增大。
在6的合成中,水解所用堿的選擇很重要,當所用堿的堿性較強(如氫氧化鈉、氫氧化鉀、碳酸鉀、碳酸鈉)時,反應中產生的雜質較多,而選用降溫或降低堿濃度的方法均不能降低雜質的含量。當選用飽和碳酸氫鈉為堿時,則能夠很好的解決這一問題。
在1的合成中, 7水解生成17-單酯,主要副產物為17α,21-二羥基-孕甾-4-烯-3,20-二酮-21-戊酸酯。當采用冰醋酸代替無機強酸進行水解時,則大大提高了水解的選擇性(>96%)。原因可能是C-17位的酯基與C-21位酯基相比,較易水解。當酸性較強時,主要生成副產物21-位單酯。
3結論
以植物甾醇發酵物雄烯二酮為起始原料,經加成、硅醚化、環加成-質子脫硅基化及置換等7步反應合成了17α,21-二羥基孕甾-4-烯-3,20-二酮-17-戊酸酯(1),總收率75%,純度96%。1可通過微生物氧化、水解制備氫化可的松。
該合成路線與傳統的由薯蕷皂素為原料制備氫化可的松的合成路線相比具有以下優點:原料廉價易得,儲量豐富;引入側鏈合理,C-3的羰基無需加以保護;縮短了合成路線,并通過對影響因素的研究確定了反應的最優條件;整個合成過程中沒有用到重金屬,符合綠色環保的要求;沒有經過21-H的碘代反應,降低了生產成本,適合工業化生產。
參考文獻
[1]Neeck G. Fifty years of experience with cortisone therapy in the study and treatment of rheumatoid arthritis[J].Ann N Y Acad Sci,2002,966:28-38.
[2]Sakuma E, Soji T, Herbert D C. Effects of hydrocortisone on the formation of gap junctions and the abnormal growth of cilia within the rat anterior pituitary gland[J].Anatomical Record,2001,262(2):169-175.
[3]Florio S, Ciarcia R, Crispino L,etal. Hydrocortisone has a protective effect on cyelosporineA-induced cardiotoxieity[J].J Cell Phys,2003,195(1): 2l-26.
[4]Gloor B, Uhl W, Tcholakov O,etal. Hydrocortisone treatment of early SIRS in acute experimental pancreatitis[J].Dig Dis Sci,2001,46(10):2154-2161.
[5]Murahashi S, Saito T, Hanaoka H,etal. Ruthenium-catalyzed oxidative transformation of alkenes to alpha-ketols with peracetic acid. Simple synthesis of cortisone acetate[J].J Org Chem,1993,58(11):2929-2930.
[6]Nitta I, Fujimori S, Haruyama T,etal. The synthesis of the corticoid side chain.Ⅲ.a new synthesis of 17α,21-dihydroxypregna-1,4-diene-3,20-dione-17,21-diacetate from androsta-1,4-diene-3,17-dione[J].Bull Chem Soc Jpn,1985,58(3): 981-986.
[7]Carruthers N I, Garshasb S, McPhail A T. Synthesis of corticoids from 9.alpha-hydroxyandrost-4-ene-3,17-dione[J].J Org Chem, 1992,57(3):961-965.
[8]Barton D H R, Motherwell W B, Zard S Z. A simple construction of the hydroxyl-ketone side chain of corticosteroids from 17-oxo-steroids via nitro-olefins[J].J Chem Soc Chem Commun,1982,10:551-552.
[9]Daniewshi A R, Wojciechowska W. An improved synthesis of the corticoid side chain[J].Synthesis,1984,2:132-133.
[10]Hanna I, Fetizon M, Goulaouic P. 1,4-Dioxene(2,3-dihydro-1,4-dioxine)in organic synthesis.Part 9.preparation of biologically active side-chains from 17-oxosteroids[J]. J Chem Soc Perkin. Trans I,1990,15(4):1107-1110.
[11]何明華, 廖清江. 氫化可的松中間體孕甾-4-烯-17α,21-二醇-3,20-二酮-21-醋酸酯的合成[J].Chinese Journal of New Drugs,2010, 19(3):233-235.
[12]Livingston D A, Petre J E, Bergh C L. Intramolecular cyanohydrin elaboration. Construction of corticosteroids from 17-ketosteroids[J].J Am Chem Soc,1990,112:6449-6450.
[13]Schwede W, Fritzemeier K H, Halfbrodt W,etal. Synthesis and biological activity of 11,19-bridged progestins[J].Steroids,1998,63:166-177.
[14]Miyashita M, Hara S, Yoshikoshi A. Regiospecific synthesis ofb-Thujaplicin(Hinokitiol) from 2-isopropylphenol[J].J Org Chem,1987,52:2602-2604.
[15]Nitta I, Fujimori S, Ueno H. The synthesis of the corticoid side chain.Ⅰ.An improved method for the preparation of 17α-hydroxyprogesterone form androst-4-ene-3,17-dione[J].Bull Chem Soc Jpn,1985,58(3):978-980.
[16]VanRheenen V H. Cyanohydrin transformation of steroids:US 4 500 461[P].1985.
[17]Livingston D A, Pearlman B A, Denmark S,etal. 17β-cyano-9α,17α-dihydroxyandrost-4-en-3-one:US 4 921 638[P].1990.
[18]Borrevang P. 21-Derivatives of compound S,cortisone,and hydrocortisone[J].Acta Chem Scand,1955,9(4):587-594.
[19]盧彥昌, 丁麗. 氫化可的松及其衍生物的制備:CN 101 397 321[P].2009.
[20]方偉明, 唐蘇杭. 一種氫化可的松的制備方法:CN 102 367 262[P].2012.
[21]Julian P L, Meyer E W, Karpe W J,etal. Sterols. XI.l7α-Hydroxy-11-desoxycorticosterone[J].J Am Chem Soc,1950,72(11):5145-5147.
[22]Ercoli A, Gardi R, Brinaza C,etal. 17-Monoesters of 17α,21-dihydroxy steroids:BE 619 180[P].1962.
Synthesis of 17α,21-Dihydroxypregn-4-ene-3,20-dione-17-valerate
WU Qing-an1,2,WU Hong-wei1*,BAI Ting2
(1. College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014, China;
2. Shanghai New Hualian Pharmaceutical Company Limited, Shanghai 201400, China)
Abstract:The intermediate of hydrocortisone, 17α,21-dihydroxypregn-4-ene-3,20-dione-17-valerate, was synthesized by a seven-step reaction of addition, silicon etherification, cycloaddition-protiodesilylation and so on, using androstendione as the starting material. The total yield was about 75% and purity was more than 96%. The structure was confirmed by1H NMR and ESI-MS.
Keywords:androstendione; hydrocortisone intermediate; 17α,21-dihydroxypregn-4-ene-3,20-dione-17-valerate; synthesis
中圖分類號:O629.8; O621.3
文獻標志碼:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.01.15009
作者簡介:吳慶安(1962-),男,漢族,湖南新田人,博士,副研究員,主要從事有機合成和天然生物活性物質的化學修飾研究。 E-mail: wuqa@nhl-pharm.com
基金項目:上海市2014年度“科技創新行動計劃”生物醫藥領域產學研醫合作項目(14DZ1930100)
收稿日期:2015-01-07;
修訂日期:2015-11-16

