胰島素樣生長因子-1基因修飾骨髓基質細胞對大鼠腦缺血的神經保護作用▲
支東一 李 偲 吳 嵐 劉開祥 李 浩
(桂林醫學院附屬醫院神經內科,桂林市541001,E-mail:272740179@qq.com)
論著·基礎研究
胰島素樣生長因子-1基因修飾骨髓基質細胞對大鼠腦缺血的神經保護作用▲
支東一 李 偲 吳 嵐 劉開祥 李 浩
(桂林醫學院附屬醫院神經內科,桂林市541001,E-mail:272740179@qq.com)
目的 探討胰島素樣生長因子-1(IGF-1)基因修飾的骨髓基質細胞(MSCs)對大鼠腦缺血的神經保護作用及其機制。方法 健康雄性Wistar大鼠48只分為假手術組、缺血模型組、 MSCs組、MSCs-IGF-1組,每組12只。除假手術組外,其余組采用改良線栓法建立左側大腦中動脈缺血再灌注模型。再灌注24 h后MSCs組、MSCs-IGF-1組分別采用MSCs、IGF-1修飾的MSCs干預治療。每組于再灌注后3 d和14 d行神經功能缺損評分,采用免疫組化法測BrdU陽細胞數量,TUNEL法測大鼠神經細胞凋亡數量,分光光度計測腦組織超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。結果 再灌注14 d后MSCs組與MSCs-IGF-1組的神經功能缺損評分較缺血模型組明顯降低(P<0.05),而MSCs-IGF-1組神經功能缺損評分低于MSCs組(P<0.05)。再灌注后3 d及14 d,假手術組與缺血模型組未見明顯BrdU陽性細胞,MSCs-IGF-1組BrdU陽性細胞數較MSCs組明顯增多(P<0.05)。再灌注后3 d及14 d,MSCs組與MSCs-IGF-1 組梗死半球神經細胞凋亡數目較缺血模型組相比明顯減少(P<0.05),MSCs-IGF-1組比MSCs組凋亡細胞明顯減少(P<0.05)。在灌注后3 d及14 d,與缺血模型組相比,MSCs組腦組織中SOD活性明顯升高(P<0.05),MDA含量明顯下降(P<0.05),且MSCs-IGF-1組SOD活性較MSCs組更高(P<0.05),MDA含量更低(P<0.05)。結論 IGF-1基因修飾骨髓基質細胞治療干預比單純骨髓基質細胞干預對腦缺血具有更好的神經保護作用,其機制可能與增強骨髓基質細胞的抗氧化應激能力、減少神經細胞凋亡有關。
腦缺血;骨髓基質細胞;胰島素樣生長因子1;大鼠;神經保護;基因修飾
骨髓基質細胞(marrow stromal cells,MSCs)是目前應用較多的外源性神經干細胞之一,其數量相對較多,較易采集,分化能力較強,整合性較好;具有潛在較強的多向分化性,其可分化為永久性的神經元和神經膠質細胞;將其移植入機體受損部位,可有效改善神經功能[1-2]。MSCs移植是已知的治療大鼠局灶性腦缺血的有效方法。胰島素樣生長因子-1(insulin-like growth factor-1,IGF-1)參與機體多種生理功能,是機體細胞增殖、分化和成熟過程中重要的一種細胞因子,不但對大腦生長、發育有重要的作用,而且能夠誘導細胞分裂分化,調節細胞在體內的存活及遷移,并促進神經元和血管內皮細胞的增殖。本研究應用IGF-1 基因轉染MSCs治療大鼠局灶性腦缺血,采用5-溴脫氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU)標記MSCs行經尾靜脈注射法移植,以探討該療法對移植細胞的存活及遷移、缺血腦組織中細胞凋亡的影響,以及對腦缺血的神經保護作用,為MSCs移植法治療人類腦缺血疾病提供新的實驗依據。
1 材料與方法
1.1 實驗動物、主要試劑與儀器
1.1.1 主要試劑:胎牛血清(Gibco公司,批號16000-044),5-溴脫氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU;Sigma公司,批號B-5002),單克隆小鼠BrdU抗體(Sigma公司,批號B8434),Trizol試劑(美國Invitrogen公司,批號15596-026),載體DNA3.1(美國Invitrogen公司,批號5108),反轉錄試劑盒 (美國Invitrogen公司,批號18080-051),PCR引物 (美國Invitrogen公司,批號AM1005),大腸桿菌DH5α(上海生工公司,批號AY2022-1),限制性內切酶BamHⅠ及HindⅢ(Promega公司,批號R6041),質粒提取試劑盒(Omega biotek公司,批號D2156),LipofectAmine 2000 脂質體(美國Invitrogen公司,批號11668019),脫氧核苷酸末端轉移酶介導的dUTP缺口末端標記[terminal deoxynucleotidyl transferase(TdT)-mediated dUTP nick end labeling,TUNEL]細胞凋亡檢測試劑盒(德國Roche公司,批號11684817910),二喹啉甲酸(bicinchonininc acid,BCA)蛋白質濃度測定試劑盒(碧云天生物科技有限公司,批號P0010),鏈霉親和素-生物素復合物(strept avidin-biotin complex,SABC)免疫組化試劑盒(Boster公司,批號SA1074)。
1.1.2 主要儀器:動物手術器械包(上海金鐘醫療器械有限公司),雙極電凝器(北京東方紅劍醫療器械公司,型號CHR-V),CO2恒溫培養箱(德國Heraeus公司,型號BB15),可調式微量移液器(德國Eppendorf 公司,型號3111),Labofuge 400R高速低溫離心機(德國Heraeus公司),臺式干燥箱[上海躍進醫用光學器械廠,型號GZX-GF-MBS-Z(9123A)],電熱恒溫水浴箱(上海躍進醫用光學器械廠,型號HH.WZ1.600S),-80℃超低溫冰箱(德國SIEMENS公司,型號MYZNJ),雙目顯微鏡(日本Olympus公司,型號IX70-SIFZ),2400型PCR擴增儀(Perkin-Elmer公司),蛋白垂直電泳系統 (美國Bio-Red公司,型號165-8001Mini-PROTEAN4),轉移脫色搖床(海門其林貝爾儀器有限公司,型號TS-8),BIO-RAD iMARK酶標儀(美國Bio-Red公司,型號iMARK)。1.1.3 實驗動物:(1)雄性Wistar大鼠10只,周齡6周,清潔級,體質量(180±20)g,購自桂林醫學院實驗動物中心,動物許可證:SCXK(桂)2009-0002。用于MSCs的提取。(2)雄性Wistar大鼠48只,周齡7~8周,清潔級,體質量(250±30)g,購自桂林醫學院實驗動物中心,動物許可證:SCXK(桂)2009-0002。采用顆粒型鼠糧喂養,飲用自來水,室溫20℃左右。用于動物模型實驗。
1.2 MSCs的提取、培養與標記 取雄性Wistar大鼠10只,術前稱重,用10%水合氯醛(3 ml/kg)腹腔注射麻醉,無菌條件下取大鼠脛骨和股骨,去其干骺端。用含有15%胎牛血清的DMEM培養液沖洗骨髓,將沖洗出的骨髓輕輕吹打均勻。 按細胞懸液 ∶細胞分離液=3 ∶1比例2 500 r/min離心15 min,然后重懸為單細胞懸液。在37℃、5% CO2、飽和濕度、充足培養基條件下培養、擴增。待原代培養細胞鋪滿瓶底,達到80%融合時,用0.25%胰蛋白酶消化,按1 ∶2比例傳代,傳代細胞用含有10%胎牛血清的DMEM培養液繼續培養,由于骨髓基質細胞容易老化,本實驗經行尾靜脈移植細胞選用第3~5 代傳代細胞。在移植前,將MSCs 1 000 r/min離心5 min,制成單細胞懸液,按1×106個/ml接種于培養瓶,并加入BrdU進行標記。
1.3 基因工程MSCs-IGF-1的生成及鑒定 (1)從周齡6周的雄性Wistar大鼠肝臟組織中抽提總RNA:取新鮮組織100 mg,剪碎后加入1 ml Trizol溶液,孵育5 min,低溫12 000 r/min離心15 min,去上清,加入75%乙醇,低溫7 500 r/min離心5 min,干燥RNA沉淀,-20℃保存。(2)利用RT-PCR獲取目的基因IGF-1互補DNA:總RNA反轉錄后得互補DNA,具體按反轉錄試劑盒說明書操作。經PCR擴增后凝膠電泳,割膠純化。然后將該目的基因與質粒pcDNA3.1連接構建為重組質粒pcDNA3.1-IGF-1。(3)用氯化鈣溶液制備大腸桿菌DH5α感受態細胞:挑取大腸桿菌DH5α菌落于37℃液體培養基中,待生長至對數期將菌液置于冰上,4℃ 8 000 r/min離心30 s,棄上清。用100 mmol/L的氯化鈣溶液400 μl懸浮菌體10 min,4℃ 4 000 r/min離心5 min,棄上清。再把菌體懸浮在冰上預冷的氯化鈣溶液中,此菌液即為感受態細菌。(4)將制備好的重組質粒加入感受態細胞進行轉化。期間避免培養基溫度過高,影響轉化率。(5)先用氨芐西林抗性菌落初步培養,制備小量存活的轉化體,采用BamHI與HindIII雙酶切對轉化體進行初步鑒定,酶切后進行測序鑒定:挑取菌株接種于5 ml含有50 μg/ml的氨芐西林的培養液中,37℃搖床中培養過夜,將培養后的菌液按照質粒提取試劑盒提取質粒,對含有目的片段的重組質粒進行全序列測定,測序結果通過Advanced BLAST2.0軟件與GenBank中的大鼠IGF-1互補DNA系列進行分析。(6)然后搖菌大量擴增含有目的基因的重組質粒,SDS裂解法進行提取。構建重組質粒 p-EGFP-N1-IGF-1,分別利用酶切、PCR、測序等方法驗證,以確定 IGF-1的真核表達載體是否構建成功。(7)基因轉染時嚴格按照LipofectAm-ine2000脂質體使用說明書,將重組質粒pcDNA3.1-IGF-1轉染骨髓基質細胞。
1.4 實驗動物分組 術前12 h禁食不禁水。實驗動物按隨機數字表法分為假手術組、缺血模型組、MSCs組及MSCs-IGF-1組,每組12只。
1.5 大鼠局灶性腦缺血再灌注模型的建立 采用頸外動脈插入石蠟線栓栓塞法,建立大鼠局灶性大腦中動脈腦缺血再灌注模型。術前大鼠用10%水合氯醛(3 ml/kg)腹腔注射麻醉,取頸部正中皮膚切開,鈍性分離左側頸總動脈、左側頸外動脈和左側頸內動脈,此過程小心誤傷迷走神經。用眼科剪在頸外動脈剪一“V”形小口,線栓由頸外動脈進入然后折向頸內動脈,緩慢插入線栓,直至遇到阻力不能插入為止,此時,線栓插入深度至頸動脈分叉處距離18~20 mm,線栓頭達到左側大腦中動脈起始部。2 h后拔線栓至頸外動脈實現再灌注。假手術組只分離血管,不行“V”形小口,不插入線栓。再灌注24 h后,MSCs組及MSCs-IGF-1組按1.0 ml/100 g體重行尾靜脈注入法行MSCs移植,其中MSCs組行MSCs移植,MSCs-IGF-1組行等量IGF-1基因修飾的MSCs移植。缺血模型組再灌注24 h后經尾靜脈注射等量生理鹽水做對照。
1.6 觀測指標及方法 分別在再灌注后7 d、14 d,每組選取6只大鼠進行指標的檢測,其中3只用于BrdU陽性細胞檢測及TUNEL法檢測細胞凋亡,另3只用于超氧化物歧化酶(superoxide dismutase,SOD)活性與丙二醛(methane dicarboxylic aldehyde,MDA)含量測定。
1.6.1 神經功能缺損評分:按照 Longa等[3]評分標準,各組分別于再灌注3 d和14 d后行神經功能缺損評分。0分:正常,無神經功能缺損癥狀;1分:動物不能完全伸展右前肢;2分:動物右側肢體癱瘓,行走時向右側轉圈,出現“追尾現象”;3分:動物行走跌倒或動物站立不能;4分:無自發活動,出現意識障礙。神經功能缺損評分為1~3分視為局灶性腦缺血再灌注模型成功建立,除假手術組外,評分為0分、4分及蛛網膜下腔出血大鼠予以剔除。
1.6.2 免疫組化測BrdU陽性細胞表達:每組于再灌注后3 d、14 d各取3只大鼠,10% 水合氯醛腹腔注射麻醉,打開老鼠的胸腔,充分顯露心臟。然后依次用生理鹽水及4%多聚甲醛心內快速滴注,待四肢伸直變硬后迅速斷頭取腦,切取以視交叉為中心、前后±2 mm的冠狀面腦組織,用4%多聚甲醛固定。常規脫水包埋制片,冠狀位切片。按照即用型SABC免疫組化試劑盒說明書,對標本進行免疫組化染色。光鏡下觀察,細胞核顯示出特異性棕黃色即為BrdU陽性細胞。
1.6.3 TUNEL檢測神經細胞凋亡:通過TUNEL法檢測神經細胞凋亡情況。再灌注后3 d、14 d制作厚5 μm腦冠狀面石蠟切片,步驟同“1.6.2”處免疫組化法,然后根據TUNEL試劑盒說明書,對標本進行神經凋亡細胞染色。其中細胞核內顯示有棕黃色顆粒者為陽性凋亡細胞,每張切片于高倍鏡視野(400×)下選取5個不重疊視野行凋亡細胞計數,其平均數即視為每張切片的陽性細胞數。
1.6.4 分光光度計測SOD活性、MDA含量:大鼠腦缺血再灌注模型制備成功后,每組隨機選3只大鼠深度麻醉迅速斷頭取腦,取梗死側(左側)大腦半球,加入冰生理鹽水,制成10%腦組織勻漿,低溫3 000 r/min離心10 min、取上清液,BCA法測定蛋白質濃度,以上過程均在冰上操作。按照試劑盒說明書采用黃嘌呤氧化酶法行腦組織中SOD活性測定,硫代巴比妥酸法行MDA含量測定。
1.7 統計學分析 采用SPSS 17.0軟件進行統計學分析,計量資料采用(x±s)表示,組間比較采用t檢驗,多樣本均數比較采用單因素方差分析,以P<0.05為差異具有統計學意義。
2 結 果
2.1 MSCs的培養形態 MSCs接種初期,細胞種類較多,懸浮于培養基中,表面光滑、透亮,呈圓形或不規則形。3 d后即可出現細胞分裂現象,約1周細胞可鋪滿瓶底。傳代至第2代細胞呈類似于成纖維細胞的長梭形,第3代以后細胞呈寬大扁平狀。見圖1、圖2。
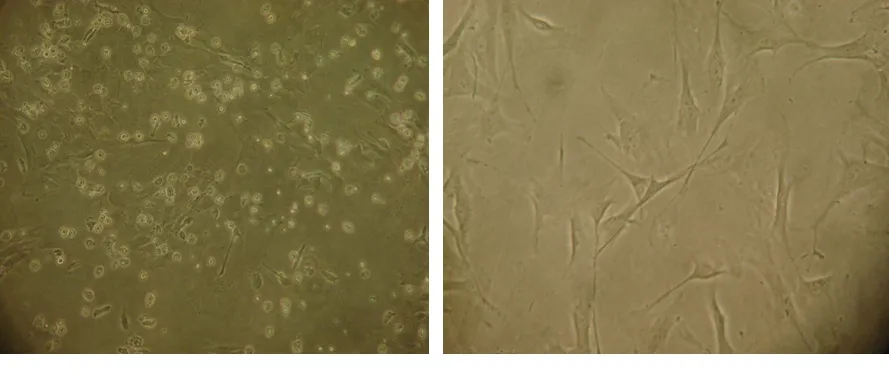
圖1 原代MSCs(100×) 圖2 第5代MSCs(100×)
2.2 神經功能缺損評分結果 與缺血模型組比較,再灌注3 d后MSCs組和MSCs-IGF-1組的神經功能缺損評分無明顯差異(P>0.05);再灌注14 d后MSCs組與MSCs-IGF-1組的神經功能缺損評分較缺血模型明顯降低(P<0.05),而MSCs-IGF-1組神經功能缺損評分低于MSCs組(P<0.05)。見表1。

表1 神經功能缺損評分結果(x±s,分)
注:與缺血模型組比較,*P<0.05;與MSCs組比較,#P<0.05。
2.3 免疫組化測BrdU陽性細胞結果 假手術組與腦缺血模型組未見明顯BrdU陽性細胞,MSC 組與MSCs-IGF-1組在大鼠梗死側可見大量BrdU 陽性細胞,且在灌注后3 d及14 d,MSCs-IGF-1組BrdU 陽性細胞數目較MSCs 組明顯增多(P<0.05)。見表2及圖3、圖4。

表2 BrdU陽性細胞數(x±s,個/HP)


A MSCs組 B MSCs-IGF-1組圖3 再灌注3 d后大鼠腦組織BrdU陽性細胞數(SABC染色,400×) A MSCs組 B MSCs-IGF-1組圖4 再灌注14 d后大鼠腦組織BrdU陽性細胞數(SABC染色,400×)
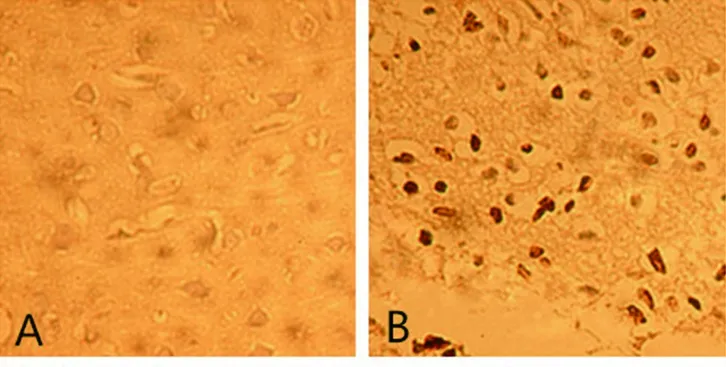
2.4 TUNEL法測腦細胞凋亡結果 在灌注后3 d及14 d,缺血模型組大鼠病灶側可見大量陽性凋亡腦細胞,較MSCs組、MSCs-IGF-1組明顯增多(P<0.05);而MSCs-IGF-1組的腦細胞凋亡數量較MSCs 組明顯減少(P<0.05)。見表3及圖5、圖6。
表3 各組腦組織凋亡細胞數量(x±s,個/HP)
注:各時間點,組間兩兩比較,P<0.05。
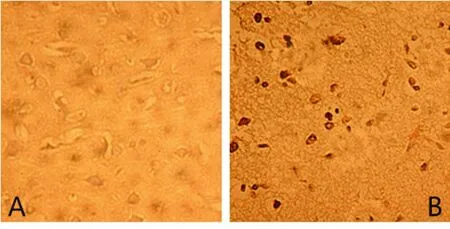
A 假手術組 B 缺血模型組
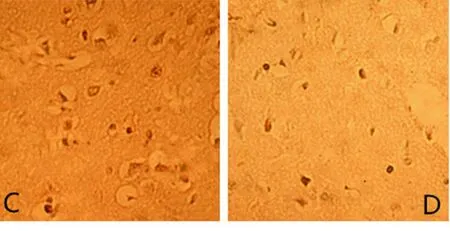
C MSCs組 D MSCs-IGF-1組
圖5 再灌注3 d后大鼠腦細胞凋亡的結果(TUNEL,400×)
A 假手術組 B 缺血模型組
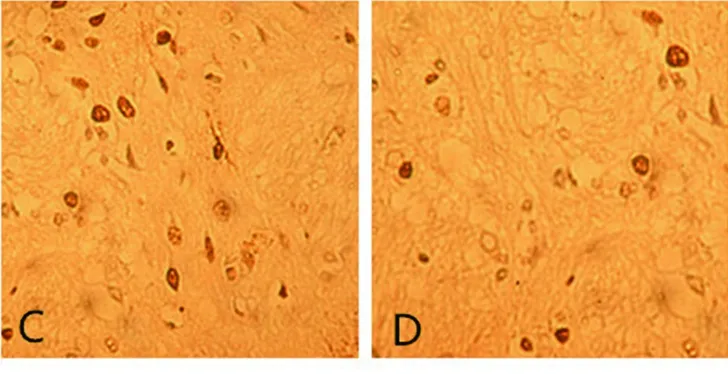
C MSCs組 D MSCs-IGF-1組
圖6 再灌注14 d后大鼠腦細胞凋亡的結果(TUNEL,400×)
2.5 MDA和SOD檢測結果 在灌注后各時間點,與假手術組比較,缺血模型組腦組織中SOD活性明顯降低(P<0.05),MDA含量明顯增加(P<0.05);與缺血模型組比較,MSCs組與MSCs-IGF-1組的SOD活性顯著升高、MDA含量明顯減少(P<0.05);與MSCs組比較,MSCs-IGF-1組腦組織中SOD活性更高(P<0.05),MDA含量更低(P<0.05)。見表4。

表4 各組MDA 與SOD檢測結果(x±s)
注:與假手術組比較,*P>0.05,余各組間兩兩比較,P均<0.05。
3 討 論
缺血性腦血管病是一種嚴重影響人類健康的常見病、多發病,其高致殘率和致死率給家庭及社會帶來沉重的負擔[4]。改善腦缺血后的神經功能缺損、提高患者生活質量是目前神經病學研究的重點方面。本課題組前期實驗表明,缺血組織再灌注主要通過釋放大量炎性因子、引發神經細胞凋亡等方面造成神經功能缺損[5]。且應用遠端肢體缺血后處理[6]的實驗方法調動體內內源性保護通路來改善神經功能缺損取到了不錯的效果。近年來,隨著分子克隆和基因重組技術的逐漸成熟,神經干細胞治療、基因工程治療等新方法的出現,又為腦血管病的治療提供了新思路。
MSCs是成體骨髓中的一類多能干細胞,具有分化成骨細胞、軟骨細胞、脂肪細胞的潛能,亦可轉分化成心肌細胞、神經細胞,從而替代損傷組織,修復機體功能缺損。相關研究表明,直接將MSCs移植入顱內,可明顯促進治療組神經功能的恢復,且病灶處的細胞存活、遷移及分化情況較對照組好[7-8]。另外,MSCs還可以促進血管再生[9],改善神經細胞生存環境,進一步加快神經功能恢復。因此,MSCs迅速成為臨床研究重點。研究發現,單純進行MSCs移植雖然有效,但是效果并不是十分理想[10]。目前,有研究采用基因工程技術,通過基因修飾使MSCs表達外源性基因,即在體外將編碼神經營養因子、促生長因子、抗凋亡因子等的基因片段導入MSCs 中,并將基因修飾后的MSCs移植到受損部位,利用MSCs可在腦缺血的微環境中向神經細胞分化,促進各種神經營養因子分泌的特點[11-12],有效改善神經功能缺損。IGF是生長激素發揮生理作用過程中必需的一種活性蛋白多肽物質。現在已知的IGF包括IGF-1和IGF-2。IGF1是一類促進細胞生長、具有胰島素樣代謝效應的因子,可促進骨合成代謝,促進細胞有絲分裂、分化,并參與創傷修復等重要的生命過程。IGF-1同樣存在于腦組織,是影響出生后大腦生長發育的一個重要調節因子[13]。相關研究表明,腦缺血后腦內IGF-1mRNA的表達增高,游離的IGF-1濃度上升,提示IGF-1可能有神經元保護作用[14]。不僅如此,IGF-1還能對神經細胞和血管內皮細胞的增殖、分化起到一定的誘導作用,并促進細胞的存活。這些研究結果提示IGF-1對神經系統的生長發育有重要作用。由于IGF-1分子量大,且血腦屏障的存在使常規靜脈注射治療效果不明顯,采用腦內定向移植又加大了腦組織受損的風險,對技術操作要求較高。而基因治療的方法可有效避免這些弊端,經基因修飾的干細胞移植,可使IGF-1在腦部持續表達,對于神經損傷的修復非常有利。本實驗選用IGF-1基因修飾MSCs來治療局灶性腦缺血模型大鼠,結果顯示,再灌注14 d后MSCs組與MSCs-IGF-1組的神經功能缺損評分較缺血模型明顯降低(P<0.05),而MSCs-IGF-1組神經功能缺損評分低于MSCs組(P<0.05),提示與MSCs組比較,IGF-1轉染MSCs治療組大鼠可顯著改善大鼠神經功能,表明IGF-1 基因轉染MSCs治療腦缺血的療效明顯優越于單純MSCs治療。
氧化應激反應是腦缺血造成神經損傷的主要病理生理學機制之一。腦組織缺血后,可產生大量氧自由基,引起線粒體損害和細胞水腫,促進蛋白質DNA鏈斷裂,引起神經細胞功能、結構等一系列改變[15]。因此,本研究從氧化應激反應方面探討了MSCs移植發揮神經保護功能的作用機制。MDA是脂質過氧化代謝的最終產物,其含量可反映組織過氧化程度及細胞損傷的程度。SOD是超氧陰離子的天然殺手,能及時修復受損細胞,復原因自由基造成的細胞損害,SOD在生物體內的水平是機體抗氧化能力的直觀指標之一。Valle-Prieto等[16]的研究發現體外MSCs可以增強SOD和谷胱甘肽過氧化物酶的活性,有效清除體內活性氧和活性氮物質,限制氧化應激造成的組織損傷。本實驗結果顯示,與缺血模型組比較,MSCs組SOD活性明顯升高,MDA含量明顯下降(P<0.05),說明MSCs具有一定的抗氧化應激作用,從而可減輕神經功能損害。此外,本文結果亦顯示MSCs-IGF-1組在MSCs基礎上,SOD活性進一步增加(P<0.05),MDA含量進一步減少(P<0.05),說明了MSCs經基因修飾后增強了其單獨移植的抗氧化應激能力。本研究還檢測了標記MSCs BrdU陽性細胞數,結果顯示,再灌注后3 d和14 d,MSCs-IGF-1組BrdU陽性細胞數均較MSCs組明顯升高(P<0.05),說明了IGF-1基因具有促進MSCs移植后的存活及遷移的作用。神經細胞凋亡是繼發神經系統受損后的一個常見轉歸,也是造成神經功能缺損的一個重要因素。本文結果顯示,再灌注后3 d和14 d,MSCs-IGF-1組的神經細胞凋亡數量均較MSCs組明顯減少,原因可能是IGF-1基因本身具有一定的抗凋亡作用,也可能是MSCs經IGF-1基因修飾后促進了其在腦內的遷移及分化,從而加強了自身的抗細胞凋亡能力。
綜上所述,經IGF-1基因轉染后MSCs比其單獨移植對腦缺血后的神經恢復具有更好的療效。其機制可能是因為IGF-1基因修飾可促進MSCs的存活及遷移分化,并增強其抗氧化應激和抗細胞凋亡能力,從而發揮神經保護作用。
[1] Penny J,Harris P,Shakesheff KM,et al.The biology of equine mesenchymal stem cells:phenotypic characterization,cell surface markers and multilineage differentiation[J].Front Biosci(Landmark Ed),2012,17:892-908.
[2] Wakabayashi K,Nagai A,Sheikh AM,et al.Transplantation of human mesenchymal stem cells promotes functional improvement and increased expression of neurotrophic factors in a rat focal cerebral ischemia model[J].J Neurosci Res,2010,88(5):1 017-1 025.
[3] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[4] Smith WS,Sung G,Starkman S,et al.Safety and efficacy of mechanical embolectomy in acute ischemic stroke:results of the MERCI trial[J].Stroke,2005,36(7):1 432-1 438.
[5] 李 浩,張多斌,吳 嵐,等.丹參酮ⅡA對腦缺血再灌注損傷大鼠磷酸化p38MAPK和MMP-9表達及細胞凋亡的影響[J].中風與神經疾病雜志,2013,30(3):229-233.
[6] Li H,Zhou S,Wang L,et al.The role of p38MAPK signal pathway in the neuroprotective mechanism of limb postconditioning against rat cerebral ischemia-reperfusion injury[J].J Neurol Sci,2015,357(1-2):270-275.
[7] Chen C,Cheng Y,Chen J.Transfection of Noggin in bone marrow stromal cells(BMSCs) enhances BMSC-induced functional outcome after stroke in rats[J].J Neurosci Res,2011,89(8):1 194-1 202.
[8] Lu H,Liu X,Zhang N,et al.Neuroprotective effects of brain-derived neurotrophic factor and noggin-modified bone mesenchymal stem cells in focal cerebral ischemia in rats[J].J Stroke Cerebrovasc Dis,2016,25(2):410-418.
[9] Shinozuka K,Dailey T,Tajiri N,et al.Stem Cells for Neurovascular Repair in Stroke[J].J Stem Cell Res Ther,2013,4(4):12 912.
[10]Hanabusa K,Nagaya N,Iwase T,et al.Adrenomedullin enhances therapeutic potency of mesenchymal stem cells after experimental stroke in rats[J].Stroke,2005,36(4):853-858.
[11]Ding J,Cheng Y,Gao S,et al.Effects of nerve growth factor and Noggin-modified bone marrow stromal cells on stroke in rats[J].J Neurosci Res,2011,89:222-230.
[12]Jablonska A,Lukomska B.Stroke induced brain changes:Implications for stem cell transplantation[J].Acta Neurobiol Exp (Wars),2011,71(1):74-85.
[13]Carlson SW,Madathil SK,Sama DM,et al.Conditional overexpression of insulin-like growth factor-1 enhances hippocampal neurogenesis and restores immature neuron dendritic processes after traumatic brain injury[J].J Neuropathol Exp Neurol,2014,73(8):734-746.
[14]Dentil,Banchini A,Caporotundo S,et al.IGF system in acute ischemic stroke [ J ].J Endocrinal Invest,2002,25(10):55-56.
[15]Yoo SJ,Nakra NK,Ronnett GV,et al.Protective Effects of Inducible HO-1 on Oxygen Toxicity in Rat Brain Endothelial Microvessel Cells[J].Endocrinol Metab(Seoul),2014,29(3):356-362.
[16]Valle-Prieto A,Conget PA.Human mesenchymal stem cells ffciently manage oxidative stress[J].Stem Cells Dev,2010,19:1 885-1 893.
Effect of insulin-like growth factor-1 gene-modified marrow stromal cells on neurological protection in rats with cerebral ischemia
ZHIDong-yi,LICai,WULan,LIUKai-xiang,LIHao
(DepartmentofNeurology,theAffiliatedHospitalofGuilinMedicalCollege,Guilin541001,China)
Objective To explore the effect of insulin-like growth factor-1(IGF-1)gene-modified marrow stromal cells(MSCs) on the neurological protection in rats with cerebral ischemia,and to investigate the mechanism.Methods Forty-eight healthy male Wistar rats were divided into sham group,ischemia model group,MSCs group,MSCs-IGF-1 group,with 12 rats in each group.The ischemia-reperfusion model of left middle cerebral artery was established by using the modified embolism line methods in all groups except for the sham group.MSCs group and MSCs-IGF-1 group were treated with MSCs and IGF-1-modified MSCs respectively after 24 hours of reperfusion.At 3 and 14 days after reperfusion,neurological deficit scores were assessed,the amount of BrdU-positive cells was detected by immunohistochemistry,the apoptosis neural cells were detected by TUNEL method,and the superoxide dismutase(SOD) activity and methane dicarboxylic aldehyde(MDA) level of brain tissues were measured by spectrophotometer.Results At 14 days after reperfusion,the neurological scores of MSCs group and MSCs-IGF-1 group were significantly lower than that of ischemia model group(P<0.05),and the score of MSCs-IGF-1 group was significantly lower than that of MSCs group(P<0.05).At 3 and 14 days after reperfusion,the cells with significantly positive BrdU were not observed in the sham group and ischemia model group,and the cells with positive BrdU of MSCs-IGF-1 group were significantly more than those of MSCs group(P<0.05).At 3 and 14 days after reperfusion,the amount of nerve cell apoptosis in the infarct hemisphere was significantly lower in MSCs group or MSCs-IGF-1 group compared to that in the ischemia model group(P<0.05),and the amount in the MSCs-IGF-1 group was significantly lower than that in the MSCs group(P<0.05).At 3 and 14 days after reperfusion,MSCs group obtained significantly higher SOD activity and lower MDA level in the brain tissues compared to ischemia model group(P<0.05).And MSCs-IGF-1 group had higher SOD activity and lower MDA level compared to MSCs group(P<0.05).Conclusion IGF-1 gene-modified MSCs has a superior neurological protection effect on cerebral ischemia compared to MSCs alone,and the mechanism might be related to strengthening the ability of resisting oxidative stress of MSCs and reducing the number of apoptosis cells.
Cerebral ischemia,Marrow stromal cells,Insulin-like growth factor-1,Rat,Neurological protection,Gene-modified
廣西自然科學基金(2013GXNSFAA019190);廣西研究生教育創新計劃資助項目(YCSZ2014207);廣西醫藥衛生科研課題(Z2013480)
支東一(1989~),女,在讀碩士研究生,研究方向:腦血管病。
李浩(1975~),男,在讀博士研究生,教授,研究方向:腦血管病,E-mail:1871412324@qq.com。
R 743.31
A
0253-4304(2015)01-0001-06
10.11675/j.issn.0253-4304.2015.01.01
2015-10-21
2016-01-07)

