NDRG2通過抑制β-catenin表達和入核調控乳腺癌細胞增殖
河北科技大學生物實驗中心,河北 石家莊 050018
NDRG2通過抑制β-catenin表達和入核調控乳腺癌細胞增殖
周曉雷,朱重悅,張世光,周志艷,李海潮,鄒 衛
河北科技大學生物實驗中心,河北 石家莊 050018
背景與目的:乳腺癌是女性發病率最高的惡性腫瘤之一,腫瘤細胞的惡性增殖是造成患者死亡的重要原因。本研究利用具有相同遺傳背景但不同增殖能力的乳腺癌細胞模型,研究N-myc下游調節基因2(N-myc downstream regulated gene 2,NDRG2)調控乳腺癌細胞增殖的作用及分子機制。方法:通過蛋白[質]印跡法(Western blot)檢測MCF-7/LM-MCF-7細胞中NDRG2蛋白表達水平;構建NDRG2真核表達載體及siRNA干擾片段,通過轉染上調或沉默NDRG2表達,流式細胞實驗檢測細胞增殖能力,Western blot檢測β-連環蛋白(β-catenin)表達,免疫熒光染色檢測β-catenin細胞定位;共轉染MCF-7細胞NDRG2 siRNA和pCMV-Tcfδ,流式細胞實驗檢測細胞增殖能力。結果:NDRG2的蛋白表達水平同乳腺癌細胞增殖能力負相關;在增殖的LMMCF-7細胞中上調NDRG2表達,細胞增殖指數(proliferation index,PI)由47.18%下降至31.78%(P<0.001);在低增殖的MCF-7細胞中沉默NDRG2表達,PI由32.00%上升至52.59%(P<0.001);Western blot及免疫熒光結果顯示,NDRG2可抑制β-catenin表達,并抑制其聚集入核;流式細胞檢測結果顯示,共轉染siRNA和pCMV-Tcfδ的MCF-7細胞增殖能力未增強,進一步說明NDRG2是通過抑制β-catenin的轉錄調節作用抑制腫瘤細胞增殖。結論:在乳腺癌細胞中,NDRG2的表達水平下調,導致β-catenin聚集入核,并激活下游靶基因,促進乳腺癌細胞增殖。此分子機制對闡明乳腺癌細胞增殖調控機制具有重要意義。
乳腺腫瘤;N-myc下游調節基因2;β-連環蛋白;細胞增殖
乳腺癌是女性常見的惡性腫瘤,全球每年約有138萬女性被診斷為乳腺癌,占全部新發腫瘤的23%。我國每年女性乳腺癌發病16.9萬例,居女性常見腫瘤首位。有研究表明,腫瘤細胞的惡性增殖和分裂失調是腫瘤發生、發展的基礎[1]。癌細胞獲得高增殖能力是乳腺癌后期轉移的重要條件之一,研究癌細胞增殖調控機制對乳腺癌的診斷和治療具有重要價值。
N-myc下游調節基因2(N-myc downstream regulated gene 2,NDRG2)是NDRG家族的重要成員,其基因染色體定位于14q11.2,含有16個外顯子和15個內含子,表達蛋白含357個氨基酸殘基,相對分子質量約41×103。NDRG2具有APC樣結構域,受原癌基因N-Myc的表達調控。近年研究發現,NDGR2基因除參與胚胎組織發育、細胞分化及血液免疫外,還與腫瘤進展具有密切關系[2]。NDRG2在腫瘤的發生、發展中起到抑癌基因的作用[3]。在腫瘤細胞中,NDRG2啟動子常發生甲基化[4-5],因此在多種腫瘤中,如消化系統腫瘤、甲狀腺癌、肺癌、和中樞神經腫瘤中呈顯著低表達,且與腫瘤的淋巴轉移呈負相關[4,6-10]。但NDRG2是否可抑制乳腺癌細胞增殖及其分子機制目前尚不清楚。
β-連環蛋白(β-catenin)作為Wnt信號通路中的關鍵因子,通過T細胞特異性轉錄因子(T cellspecific transcription factor,Tcf)或其他轉錄因子與特定的DNA序列相結合,激活靶基因的轉錄[11],在乳腺癌的發生、發展中發揮重要調控作用。腫瘤細胞可通過上調Dsh蛋白或下調Frp1蛋白表達激活經典的Wnt途徑,并上調β-catenin表達[12-13]。腫瘤細胞也可通過非Wnt通路機制穩定β-catenin表達,如通過調控PTEN、ILK、IKKA、Pin1及P53等因子的表達進而調節β-catenin[14]。前期研究發現,ERK1/2信號通路的激活可上調β-catenin表達,并促進其轉移入核,發揮轉錄調節作用,促進乳腺癌細胞增殖和遷移[15-16],但β-catenin是否受到NDRG2的調控需要進一步研究。
在前期研究中,我們應用嚴重聯合免疫缺陷小鼠從人乳腺癌細胞系MCF-7中篩選和建立了具有高轉移能力的轉移亞克隆LM-MCF-7。與MCF-7細胞相比,LM-MCF-7細胞具有更強的增殖和遷移能力,動物實驗顯示,其具有成瘤早、轉移快和轉移部位廣泛等特點。基因芯片研究結果顯示,在人的21 329種基因中,有67種基因的表達水平在LM-MCF-7細胞中和MCF-7細胞中差異有統計學意義[15]。本研究應用MCF-7和LM-MCF-7細胞模型研究NDRG2對乳腺癌細胞增殖的調控作用。
1 材料和方法
1.1 細胞株及主要試劑
人乳腺癌細胞系MCF-7、LM-MCF-7、pCMV-tag2b質粒和pCMV-Tcfδ質粒(表達的Tcfδ具有蛋白結合位點但缺少DNA結合位點,可競爭性抑制Tcf的轉錄調控功能)為本實驗室儲備;RPMI1640培養基、胎牛血清和LipofectamineTM2000購自美國Invitrogen公司;兔抗人NDRG2多克隆抗體、鼠抗人β-actin單克隆抗體和碘化丙啶購自美國Sigma-Aldrich公司;兔抗人β-catenin多克隆抗體購自美國Santacruz公司;小量總RNA提取試劑盒購自德國Qiagen公司;QuantScript RT試劑盒購自天根公司。靶向NDRG2的小RNA干擾片段由廣州市銳博生物科技有限公司合成,NDRG2 siRNA正義序列:5’-ACAUCCUGGCGAGAUAUGCUCUUAA-3’,反義序列:5’-UUAAGAGCAUAUCUCGCCAGGA UGU-3’;對照siRNA正義序列:5’-UUCUCCGA A C G U G U C A C G U T T-3’,反義序列:5’-ACGUGACACGUUCGGAGAATT-3’。其余試劑為國產分析純。
1.2 細胞培養
MCF-7和LM-MCF-7細胞采用含10%胎牛血清、100 U/mL青霉素和100 U/mL硫酸鏈霉素的RPMI1640培養基,于37 ℃、CO2體積分數為5%的條件下培養。
1.3 pCMV-NDRG2真核表達載體構建
用小量總RNA提取試劑盒提取MCF-7細胞總RNA,利用QuantScript RT試劑盒制備cDNA。根據NDRG2(GENEBANK:NM_201535.1)mRNA CDS序列設計引物:上游加入EcoRⅠ酶切位點,下游加入SalⅠ酶切位點。上、下游引物序列分別為5’-GAATTCATGGCGGAGCTGCAGGA GGTG-3’和5’-GTCGACTCAACAGGAGACCTCC ATGGT-3’。以反轉錄的cDNA為模板。用上述引物PCR擴增,獲得目的基因片段(PCR反應參數:94 ℃變性5 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸90 s,共20個循環,72 ℃延伸7 min)。
擴增產物經EcoRⅠ/SalⅠ雙酶切純化后,與pCMV重組,轉化DH5α菌。提取轉化菌質粒,經雙酶切和DNA測序分析,對NDRG2序列進行鑒定,得到重組真核表達載體pCMVNDRG2。
1.4 細胞轉染
將培養至覆蓋率達80%的MCF-7和LMMCF-7細胞用于轉染實驗。將8 μg質粒(或80 nmol/L siRNA)和24 μL LipofectamineTM2000分別加入到500 μL的OMEM培養基中,室溫靜置5 min,然后將二者混勻并于37 ℃靜置15 min。隨后將質粒(或siRNA)/LipofectamineTM2000/OMEM混合物加入細胞中,37 ℃溫育6 h后換成無抗生素的完全培養基,繼續培養72 h后進行蛋白[質]印跡法(Western blot)或流式細胞實驗。
1.5 流式細胞實驗檢測乳腺癌細胞增殖
用胰蛋白酶消化收集正常培養及轉染后的乳腺癌細胞,PBS洗2遍,1 000×g離心5 min,70%的冰乙醇固定,4 ℃過夜。上機檢測前細胞用PBS洗2遍后重懸在含50 mg/L RNA酶和25 mg/L碘化丙錠的PBS中,室溫避光溫育15 min后用FACS Calibur流式細胞儀進行單色熒光細胞流式檢測。每個樣本采集1×104個細胞,用ModFit軟件(購自美國Verity Software House公司)分析結果。每組實驗重復3次。
1.6 免疫熒光檢測β-catenin細胞定位
將正常培養及轉染后的細胞接種在放有蓋玻片的六孔板中,37 ℃過夜培養。隨后用-20 ℃預冷的無水甲醇于4 ℃固定15 min,用含5%Triton X-100的PBS洗細胞,5 min×2次。加入10%血清,室溫封閉20 min。加入兔抗人β-catenin抗體,室溫溫育2 h。PBS洗細胞,5 min×3次。滴加FITC標記的羊抗兔熒光二抗,室溫溫育1 h。PBS洗細胞,5 min×3次。用DAPI對細胞核進行染色,室溫溫育1 h,PBS洗細胞,5 min×3次。封片后,置于熒光顯微鏡下觀察結果。
1.7 Western blot
收獲正常培養和轉染后的細胞,用預冷的PBS洗細胞2次,隨后加入細胞裂解液(10 mmol/L Tris-HCl,pH=8.0,0.1 mmol/L EDTA,150mmol/L NaCl,1%NP-40,1 mmol/L PMSF,1%SDS)冰上放置20 min,4 ℃,12 000×g離心20 min,收集上清定量分析,取30 μg總蛋白進行12%SDS-PAGE電泳,隨后電轉印至PVDF膜上,5%脫脂奶粉封閉2 h,加入相應一抗,室溫溫育2 h,TBS-T洗膜后加入相應二抗室溫溫育1 h,TBS-T洗膜后,應用增強型ECL顯色試劑盒于暗室曝光顯影,實驗均重復3次。
1.8 統計學處理
2 結 果
2.1 過表達NDRG2抑制乳腺癌細胞增殖
Western blot結果顯示,與高增殖能力的LM-MCF-7細胞相比,NDRG2在低增殖能力的MCF-7中表達較高(如圖1A)。NDRG2表達同腫瘤細胞增殖能力負相關。轉染MCF-7細胞NDRG2 siRNA,沉默NDRG2表達,流式細胞實驗檢測結果顯示,與轉染對照siRNA組相比,細胞增殖指數(proliferation index,PI)由32.00%上升至52.59%(P<0.01)。利用pCMV-tag2b真核表達載體,構建pCMV-NDRG2載體(圖1B)。轉染LM-MCF-7細胞pCMV-NDRG2質粒,過表達NDRG2(圖1C),流式細胞實驗檢測結果顯示,與轉染對照pCMV-tag2b組相比,PI由47.18%下降至31.78%(P<0.01,圖1D)。以上結果說明,NDRG2表達水平同細胞增殖能力負相關,NDRG2表達下調是乳腺癌細胞獲得高增殖能力的重要原因。
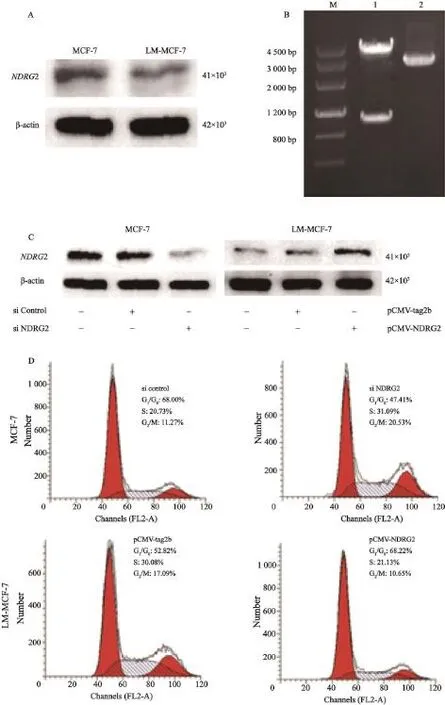
圖 1 過表達NDRG2抑制乳腺癌細胞增殖Fig. 1 The proliferation of breast cancer cells was inhibited by over-expressing NDRG2
2.2 NDRG2抑制β-catenin表達并促進其磷酸化
本研究通過Western blot檢測改變NDRG2表達水平后,β-catenin的表達水平及磷酸化水平變化。轉染MCF-7細胞siRNA,沉默NDRG2表達,Western blot結果顯示,同轉染對照siRNA組相比,β-catenin表達水平顯著上調,且磷酸化的p-β-catenin水平下降(圖2A)。轉染LM-MCF-7細胞pCMV-NDRG2表達載體,上調NDRG2表達水平。Western blot結果顯示,β-catenin表達水平下降,并且磷酸化的p-β-catenin表達水平上調(圖2B)。以上結果說明,NDRG2能夠抑制β-catenin表達,并且促進β-catenin磷酸化,促使其進入泛素化降解途徑。
2.3 NDRG2抑制β-catenin進入細胞核
β-catenin發揮促增殖作用主要依賴其在細胞質中聚集并進入細胞核,與Tcf/LEF結合形成Tcf/LEF/β-catenin復合體,特異性啟動和激活下游靶基因的轉錄[17]。利用β-catenin特異性抗體,通過免疫熒光技術對MCF-7和LM-MCF-7中β-catenin在細胞中的定位進行分析。結果發現,β-catenin在高增殖能力的LM-MCF-7細胞中存在明顯的核定位,而在低增殖能力的MCF-7細胞中主要存在于細胞質。利用RNA干擾方法沉默MCF-7細胞中的NDRG2表達后,免疫熒光結果發現,β-catenin由細胞質轉移進入細胞核(圖3A)。在LM-MCF-7細胞中過表達NDRG2后,β-catenin主要定位于細胞質,而核定位的β-catenin接近消失(圖3A)。免疫熒光結果說明,NDRG2能夠抑制β-catenin聚集入核。為進一步驗證NDRG2抑制β-catenin的轉錄調節作用,進而抑制乳腺癌細胞增殖,我們共轉染MCF-7細胞NDRG2 siRNA和pCMV-Tcfδ,在降低NDRG2表達的同時,過表達Tcfδ(具有蛋白結合位點,但缺失DNA結合位點的Tcf突變體,能夠同野生型Tcf競爭性結合β-catenin,抑制下游基因的轉錄激活[15])。流式細胞檢測結果顯示,干擾NDRG2表達后,與對照組相比,MCF-7細胞PI明顯上升至53.25%(P<0.01);干擾NDRG2的同時過表達Tcfδ,與pCMV-tag2b相比,細胞PI下降至40.78%(P<0.05%,圖3B)。流式細胞結果表明,在乳腺癌細胞中,NDRG2表達下降,促進了β-catenin入核,并與Tcf結合促進下游因子轉錄。此分子機制是乳腺癌細胞獲得高增殖能力的重要原因。
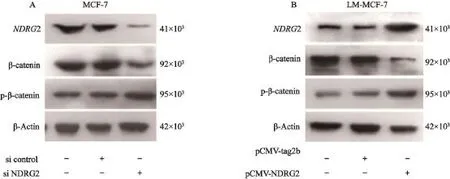
圖 2 NDRG2調控β-catenin表達及其磷酸化Fig. 2 NDRG2 regulated the expression and phosphorylation of β-catenin
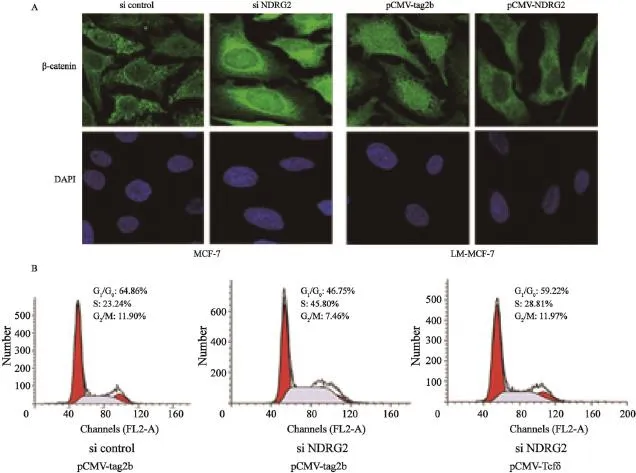
圖 3 NDRG2抑制β-catenin進入細胞核Fig. 3 Translocation of β-catenin into the nucleus was inhibited by NDRG2
3 討 論
細胞增殖和分裂失調是乳腺腫瘤發生、發展的基礎,深入研究癌細胞的增殖調控機制對腫瘤的診斷和治療具有重要意義。目前研究已證實,NDRG2除參與正常細胞的生長、分化以及應激反應外,還與腫瘤的發生、發展和轉歸密切相關。腫瘤組織的NDRG2表達顯著低于癌旁及正常組織,表達水平隨腫瘤TNM分期增加或惡性度增加而降低[2]。本研究利用具有相同遺傳背景但具有不同增殖能力的乳腺癌細胞系MCF-7和LM-MCF-7[15]探明NDRG2在調控乳腺癌細胞增殖中的作用,發現NDRG2的表達水平與乳腺癌細胞的增殖能力呈負相關,提高NDRG2的表達水平可顯著抑制乳腺癌細胞增殖;相反,RNAi沉默NDRG2表達后,細胞增殖能力顯著增強。目前已有多項研究證實,NDRG2在乳腺腫瘤中起到抑癌基因的作用,通過多種分子機制抑制乳腺腫瘤生長、細胞增殖及轉移。在乳腺癌細胞SKBR-3和MCF-7中過表達NDRG2能夠抑制細胞增殖,下調促血管生成因子VEGF和HIF-1α的表達并抑制血管新生,進而抑制裸鼠移植瘤生長[18-19]。在MDA-MB-231細胞中過表達NDRG2,能夠激活BMP-4通路,并通過抑制MMP-9活性抑制細胞侵襲[20]。Kim等[21]研究發現,在乳腺癌細胞中過表達NDRG2能夠抑制NF-κB信號通路的激活,進而下調COX-2表達,抑制腫瘤細胞遷移和侵襲。NDRG2還可通過激活p38 MAPK途徑,抑制細胞因子信號轉導抑制因子1磷酸化,進而抑制細胞增殖和遷移[22]。在乳腺癌細胞中過表達NDRG2可促進SAPK和JNK磷酸化,促進腫瘤細胞凋亡[22]。除乳腺腫瘤外,NDRG2對多種腫瘤生長、腫瘤細胞的增殖、遷移和侵襲具有抑制作用。在大腸癌SW620細胞中,上調NDRG2表達可降低c-Jun磷酸化水平,減弱轉錄調節因子AP-1活性,進而抑制cyclinD1表達,抑制細胞增殖[23]。在肝癌細胞中,NDRG2還可通過上調p38磷酸化水平抑制細胞增殖[24];通過下調CD24的表達抑制細胞黏附、遷移和侵襲[25]。NDRG2還可通過促進葡萄糖轉運蛋白GLUT1降解阻斷腫瘤細胞能量代謝,抑制腫瘤生長[26]。過表達NDRG2可增強GSK-3β活性,促進Snail降解,進而上調E-cadherin抑制腫瘤細胞侵襲[27]。NDRG2還可通過抑制MMP2和laminin332信號通路并同時降低Rho GTPase活性,抑制由TGFβ1介導的腫瘤細胞侵襲[28]。
β-catenin蛋白是介導Wnt信號傳導的關鍵分子,其在細胞內的表達水平決定著Wnt信號通路的開放或關閉,在乳腺癌發生、發展過程中起到關鍵作用[29]。β-catenin在細胞內的水平受到嚴格調控,由GSK-3β、Axin及APC組成的復合體能夠使β-catenin磷酸化,并進入泛素化降解途徑。當磷酸化被抑制時,β-catenin在細胞質中聚集并進入細胞核,形成Tcf/LEF/β-catenin復合體,特異性啟動和激活下游靶基因[30]。本研究發現,在乳腺癌細胞中上調NDRG2水平可促進β-catenin磷酸化,下調細胞內β-catenin水平;免疫熒光發現,NDRG2可抑制細胞質的β-catenin轉移入核,阻礙其發揮轉錄激活作用。近年來多項相關研究均證實,乳腺癌的發生與β-catenin表達異常有關。β-catenin的表達激活可增強cyclinD1表達,進而促進腫瘤細胞異常增殖[29];C-myc基因啟動子上有Tcf結合位點,β-catenin/TCF復合物可促進其基因表達,從而導致腫瘤細胞增殖[14]。乳腺癌細胞中有多種途徑可穩定調節β-catenin,如Pin1蛋白在80%的乳腺癌中上調,Pin1能夠抑制APC蛋白作用,從而穩定β-catenin處于高表達水平[31]。PTEN基因的丟失及異常激活Akt蛋白能夠激活β-catenin,引起乳腺癌細胞增殖[32]。腫瘤細胞中p53蛋白能夠通過GSK-3β依賴性和Siah依賴性機制穩定β-catenin表達,促進腫瘤細胞增殖[33]。我們的前期研究還發現,在乳腺癌細胞中,激活的MLCK-ERK1/2正反饋信號途徑通過促進β-catenin高表達及轉移入核,激活cyclin D1和Survivin表達,維持乳腺癌細胞高增殖和高遷移能力[15]。在腫瘤細胞中,β-catenin作為信號因子受到多種信號途徑調控,對腫瘤細胞增殖發揮著關鍵調控作用。
綜上所述,NDRG2作為腫瘤抑制因子,在調控乳腺癌細胞增殖中發揮重要的抑制作用。NDRG2抑制β-catenin表達,阻礙其轉移入核發揮抑制轉錄調節作用是乳腺癌細胞獲得高增殖能力的重要原因。此分子調控機制的闡明為乳腺癌的診斷和治療提供了重要理論依據。
[1]CHEN X, DUAN N, ZHANG C, et al. Survivin and tumorigenesis: molecular mechanisms and therapeutic strategies[J]. J Cancer, 2016, 7(3): 314-323.
[2]HU W, FAN C, JIANG P, et al. Emerging role of N-myc downstream-regulated gene 2 (NDRG2) in cancer[J]. Oncotarget, 2016, 7(1): 209-223.
[3]GOLESTAN A M, MOJTAHEDI Z P, GHALAMFARSA G P, et al. The effects of NDRG2 overexpression on cell proliferation and invasiveness of SW48 colorectal cancer cell line[J]. Iran J Med Sci, 2015, 40(5): 430-439.
[4]PIEPOLI A, COTUGNO R, MERLA G, et al. Promoter methylation correlates with reduced NDRG2 expression in advanced colon tumour[J]. BMC Med Genomics, 2009, 2: 11.
[5]FENG L, XIE Y, ZHANG H, et al. Down-regulation of NDRG2 gene expression in human colorectal cancer involves promoter methylation and microRNA-650[J]. Biochem Biophys Res Commun, 2011, 406(4): 534-538.
[6]LORENTZEN A, LEWINSKY R H, BORNHOLDT J, et al. Expression profile of the N-myc downstream regulated gene 2 (NDRG2) in human cancers with focus on breast cancer[J]. BMC Cancer, 2011, 11: 14.
[7]MORDALSKA A, LATEK J, FERENC T, et al. Evaluation of NDRG2 gene expression in primary papillary thyroid carcinoma and in metastases of this neoplasm to regional lymph nodes[J]. Thyroid Res, 2010, 3(1): 6.
[8]PARK M Y, CHOI S C, LEE H S, et al. A quantitative analysis of N-myc downstream regulated gene 2 (NDRG2) in humantissues and cell lysates by reverse-phase protein microarray[J]. Clin Chim Acta, 2008, 387(1-2): 84-89.
[9]SHI H, LI N, LI S, et al. Expression of NDRG2 in esophageal squamous cell carcinoma[J]. Cancer Sci, 2010, 101(5): 1292-1299.
[10]SKIRIUTE D, TAMASAUSKAS S, ASMONIENE V, et al. Tumor grade-related NDRG2 gene expression in primary and recurrent intracranial meningiomas[J]. J Neurooncol, 2011, 102(1): 89-94.
[11]DING Y, SU S, TANG W, et al. Enrichment of the betacatenin-TCF complex at the S and G2phases ensures cell survival and cell cycle progression[J]. J Cell Sci, 2014, 127(Pt 22): 4833-4845.
[12]NAGAHATA T, SHIMADA T, HARADA A, et al. Amplification, up-regulation and over-expression of DVL-1, the human counterpart of the drosophila disheveled gene, in primary breast cancers[J]. Cancer Sci, 2003, 94(6): 515-518.
[13]UGOLINI F, CHARAFE-JAUFFRET E, BARDOU V J, et al. WNT pathway and mammary carcinogenesis: loss of expression of candidate tumor suppressor gene SFRP1 in most invasive carcinomas except of the medullary type[J]. Oncogene, 2001, 20(41): 5810-5817.
[14]HATSELL S, ROWLANDS T, HIREMATH M, et al. Betacatenin and Tcfs in mammary development and cancer[J]. J Mammary Gland Biol Neoplasia, 2003, 8(2): 145-158.
[15]ZHOU X, LIU Y, YOU J, et al. Myosin light-chain kinase contributes to the proliferation and migration of breast cancer cells through cross-talk with activated ERK1/2[J]. Cancer Lett, 2008, 270(2): 312-327.
[16]ZHOU X L, QIN X R, ZHANG X D, et al. Downregulation of Dickkopf-1 is responsible for high proliferation of breast cancer cells via losing control of Wnt/beta-catenin signaling[J]. Acta Pharmacol Sin, 2010, 31(2): 202-210.
[17]CUELLO-CARRION F D, SHORTREDE J E, ALVAREZOLMEDO D, et al. HER2 and beta-catenin protein location: importance in the prognosis of breast cancer patients and their correlation when breast cancer cells suffer stressful situations[J]. Clin Exp Metastasis, 2015, 32(2): 151-168.
[18]朱財林, 李南林, 王 廷, 等. NDRG2對乳腺癌細胞增殖的影響[J]. 醫學爭鳴, 2009, 30(11): 961-963.
[19]MA J, LIU W, YAN X, et al. Inhibition of endothelial cell proliferation and tumor angiogenesis by up-regulating NDRG2 expression in breast cancer cells[J]. PLoS One, 2012, 7(2): e32368.
[20]SHON S K, KIM A, KIM J Y, et al. Bone morphogenetic protein-4 induced by NDRG2 expression inhibits MMP-9 activity in breast cancer cells[J]. Biochem Biophys Res Commun, 2009, 385(2): 198-203.
[21]KIM M J, KIM H S, LEE S H, et al. NDRG2 controls COX-2/ PGE(2)-mediated breast cancer cell migration and invasion[J]. Mol Cells, 2014, 37(10): 759-765.
[22]PARK Y, SHON S K, KIM A, et al. SOCS1 induced by NDRG2 expression negatively regulates STAT3 activation in breast cancer cells[J]. Biochem Biophys Res Commun, 2007, 363(2): 361-367.
[23]KIM Y J, YOON S Y, KIM J T, et al. NDRG2 suppresses cell proliferation through down-regulation of AP-1 activity in human colon carcinoma cells[J]. Int J Cancer, 2009, 124(1): 7-15.
[24]LIU X, NIU T, LIU X, et al. Microarray profiling of HepG2 cells ectopically expressing NDRG2[J]. Gene, 2012, 503(1): 48-55.
[25]ZHENG J, LI Y, YANG J, et al. NDRG2 inhibits hepatocellular carcinoma adhesion, migration and invasion by regulating CD24 expression[J]. BMC Cancer, 2011, 11: 251-259.
[26]MA J, LIU W, GUO H, et al. N-myc downstream-regulated gene 2 expression is associated with glucose transport and correlated with prognosis in breast carcinoma[J]. Breast Cancer Res, 2014, 16(2): R27.
[27]KIM Y J, KANG H B, YIM H S, et al. NDRG2 positively regulates E-cadherin expression and prolongs overall survival in colon cancer patients[J]. Oncol Rep, 2013, 30(4): 1890-1898.
[28]LEE D C, KANG Y K, KIM W H, et al. Functional and clinical evidence for NDRG2 as a candidate suppressor of liver cancer metastasis[J]. Cancer Res, 2008, 68(11): 4210-4220.
[29]JAMIESON C, SHARMA M, HENDERSON B R. Targeting the beta-catenin nuclear transport pathway in cancer[J]. Semin Cancer Biol, 2014, 27: 20-29.
[30]MORGAN R G, RIDSDALE J, TONKS A, et al. Factors affecting the nuclear localization of beta-catenin in normal and malignant tissue[J]. J Cell Biochem, 2014, 115(8): 1351-1361.
[31]RYO A, NAKAMURA M, WULF G, et al. Pin1 regulates turnover and subcellular localization of beta-catenin by inhibiting its interaction with APC[J]. Nat Cell Biol, 2001, 3(9): 793-801.
[32]DEPOWSKI P L, ROSENTHAL S I, ROSS J S. Loss of expression of the PTEN gene protein product is associated with poor outcome in breast cancer[J]. Mod Pathol, 2001, 14(7): 672-676.
[33]WANG D, WANG Y, KONG T, et al. Hypoxia-induced betacatenin downregulation involves p53-dependent activation of Siah-1[J]. Cancer Sci, 2011, 102(7): 1322-1328.
NDRG2 inhibits the proliferation of breast cancer cells via regulating β-catenin expression and nuclear translocation
ZHOU Xiaolei, ZHU Chongyue, ZHANG Shiguang, ZHOU Zhiyan, LI Haichao, ZOU Wei (Public R&D Center of Bio-Manufacture, Hebei University of Science & Technology, Shijiazhuang 050018, Hebei Province, China)
Background and purpose:Breast cancer is one of the most common malignant diseases in women and its malignant proliferation is the major cause of death. To investigate the effects of N-myc downstream regulated gene 2 (NDRG2) on proliferation of breast cancer cells by using two parallel cell lines (MCF-7 and LM-MCF-7) with different metastatic abilities.Methods:The expression level of NDRG2 in breast cancer cells was detected by Western blot. The effects of overexpressing (or down-regulating) NDRG2 on proliferation of breast cancer cells were investigated by flow cytometry. The expression and location of β-catenin were detected by Western blot and immunofluorescence respectively. NDRG2 blocking the transcription activity of β-catenin was investigated via co-transfecting MCF-7 cells with NDRG2 siRNA and pCMV-Tcfδ (lacking the portion responsible for the protein binding to DNA).Results:The expression level of NDRG2 was negatively related to the proliferation ability of breast cancer cells. Over-expressing NDRG2 (or down-regulating) via transfecting LM-MCF-7 (or MCF-7) cells with pCMV-NDRG2 (or NDRG2 siRNA) could inhibit (or promote) cell proliferation. Interestingly, the results of Western blot, immunofluorescence and flow cytometry revealed that down-regulation of NDRG2 resulted from the down-regulation of β-catenin and blocking its nuclear translocation, which led to losing control of the proliferation of breast cancer cells.Conclusion:NDRG2 inhibitthe proliferation of breast cancer cells via down-regulating the expression of β-catenin and blocking its nuclear translocation, which is significant for exploring the molecular mechanism of proliferation of breast cancer cells.
Breast neoplasms; N-myc downstream regulated gene 2; β-catenin; Cell proliferation
10.19401/j.cnki.1007-3639.2016.12.004
R737.9
A
1007-3639(2016)12-0981-08
2016-04-25
2016-06-27)
河北省高等學校科學研究項目(QN2016020);2015年度河北科技大學五大平臺開放基金課題;河北科技大學博士科研啟動基金課題。
周曉雷 E-mail: foxlei@live.cn

