參麥注射液改善3T3-L1細胞的胰島素抵抗*
毛玉山, 陳軼塵, 趙亞榮, 車曉航, 陶 金, 葉小磊△
(1寧波大學醫學院附屬醫院內分泌科, 2寧波市醫學科學研究所藥物與藥理研究室,浙江 寧波 315020)
?
參麥注射液改善3T3-L1細胞的胰島素抵抗*
毛玉山1▲,陳軼塵2▲,趙亞榮2,車曉航2,陶金2,葉小磊2△
(1寧波大學醫學院附屬醫院內分泌科,2寧波市醫學科學研究所藥物與藥理研究室,浙江 寧波 315020)
[摘要]目的: 探討參麥注射液改善3T3-L1脂肪前體細胞胰島素抵抗模型的效果及其作用機制。方法:使用地塞米松等將3T3-L1前脂肪細胞誘導分化為成熟脂肪細胞,使用油紅O染色法檢測脂肪細胞分化情況;用胰島素誘導3T3-L1脂肪細胞以建立胰島素抵抗模型,并使用葡萄糖氧化酶法檢測細胞上清液中葡萄糖濃度,以評價模型建立情況。將建立胰島素抵抗的細胞分為空白對照組、10 μmol/L羅格列酮陽性對照組、25 g/L參麥組和50 g/L參麥組。MTT檢測各組藥物作用8、16、24和36 h后的細胞活力。藥物作用8、16和24 h后測定細胞上清液葡萄糖濃度。免疫印跡檢測葡萄糖轉運蛋白4(GLUT4)、磷脂酰肌醇3-激酶(PI3K)、AKT和磷酸化AKT(p-AKT)在各組中的蛋白水平。結果:成功建立3T3-L1脂肪細胞胰島素抵抗模型,葡萄糖濃度數據顯示參麥注射液(25、50 g/L)可以改善胰島素抵抗并可以明顯增加3T3-L1細胞GLUT4、PI3K及p-AKT的蛋白水平。結論:參麥注射液可以改善3T3-L1胰島素抵抗細胞的葡萄糖利用,并且與增加GLUT4、PI3K及p-AKT的蛋白水平有關。
[關鍵詞]胰島素抵抗; 參麥注射液; 3T3-L1前脂肪細胞
糖尿病是一種以高血糖為特征的代謝性疾病,分為1型糖尿病(type 1 diabetes mellitus,T1DM)和2型糖尿病(type 2 diabetes mellitus,T2DM),我國糖尿病人口已超過1億人,其中2型糖尿病占90%~95%。2型糖尿病是由多種因素共同作用所引發的,包括遺傳和多種環境的綜合作用,其中胰島素抵抗(insulin resistance,IR)是T2DM發病的主要原因[1]。胰島素抵抗是指胰島素的靶器官對胰島素的敏感性下降,即正常劑量的胰島素不能產生正常生物學效應的一種狀態。糖尿病的治療以有效控制血糖、預防和減少并發癥、改善患者生活質量以及延長壽命為目標。在2型糖尿病的治療中,要針對其發病機制,改善患者的胰島素抵抗,增加患者對胰島素的敏感性[2]。鑒于西藥治療存在副作用以及耐藥問題,從傳統中醫藥中尋找解決的途徑具有重要意義[3]。
參麥注射液是由中藥人參、麥冬等經化學提取精制而成的中藥注射液,其主要活性成分為Rb1、Rb2、Rc、Rd、Re、Rg1以及麥冬皂苷D,具有抗休克、抗心衰、抗炎等作用[4]。其中,人參作為參麥注射液的主要成分,其可以影響糖脂代謝通路,增加能量消耗,調節過氧化物酶體增殖物活化受體γ(peroxisome proliferator-activated receptor γ,PPARγ)的活性和表達,改善胰島素抵抗并促進胰島素合成和釋放[5]。人參皂苷Rb1能夠通過上調脂肪組織周脂素(perilipin)的表達,減少游離脂肪酸的釋放和甘油三酯的沉積,進而改善胰島素抵抗和糖代謝異常[6]。另有研究表明,參麥注射液中的麥冬成分可以減少大鼠胰島β細胞凋亡[7]。參麥注射液在用于糖尿病時,可以改善患者胰島素抵抗的狀況[8]。但是目前參麥注射液改善IR的機制尚未明確,而且缺少合適的IR細胞藥理模型。在本實驗中使用3T3-L1前脂肪細胞誘導分化為脂肪細胞,構建胰島素抵抗模型,對IR相關蛋白進行檢測。本研究對于參麥注射液改善胰島素抵抗機制的探索不僅有利于明確參麥注射液改善胰島素抵抗的具體作用因素,而且為挖掘我國傳統中藥的新用途和新價值,提供具體案例。
材料和方法
1材料
3T3-L1前脂肪細胞(ATCC);DMEM培養液(Gibco);胎牛血清(浙江天杭生物科技有限公司);羅格列酮(rosiglitazone)、胰島素和3-異丁基-1-甲基黃嘌呤(3-isobutyl-1-methylxanthine,IBMX)購自Sigma;參麥注射液(正大青春寶藥業有限公司);24孔培養板及T25培養瓶(Corning);葡萄糖氧化酶試劑盒(Invitrogen);PI3K、GLUT4、AKT和p-AKT等抗體、β-actin抗體、特異性 II 抗(Abcam)。
2方法
參考文獻2.13T3-L1前脂肪細胞的培養和分化 3T3-L1前脂肪細胞的分化中所用方法[9]。先將3T3-L1細胞復蘇,用含有10% 胎牛血清的DMEM細胞培養液重懸于T25培養瓶中,于37 ℃、5% CO2培養箱中培養,2 d換液1次。將3T3-L1前脂肪細胞分至24孔板中,待細胞融合度達到80%,加入含有IBMX(0.5 mmol/L)、胰島素(1 g/L)、地塞米松(1 μmol/L)的DMEM培養液培養48 h。棄去上清,加入含有胰島素的DMEM培養液培養48 h。棄去上清,換成DMEM培養液繼續培養至第8天。細胞使用4%多聚甲醛室溫固定10 min,用0.5%油紅O染液染色10 min,用PBS洗2遍。倒置顯微鏡下拍照,有紅色油滴產生即證明脂肪細胞分化成功。
2.2胰島素抵抗模型的建立3T3-L1分化完成后,分別用1 μmol/L、100 nmol/L、10 nmol/L和1 nmol/L胰島素誘導脂肪細胞。各組加胰島素后分別在8、16和24 h時,用葡萄糖氧化酶法分別測定各組的細胞上清葡萄糖水平,同時在顯微鏡下觀察細胞的形態學變化。最后計算不同胰島素濃度和時間點下各組與正常對照組中上清液葡萄糖濃度的差值,差值越大,胰島素抵抗越明顯。
2.3不同濃度參麥注射液對細胞活力的測定將IR細胞于實驗前24 h,以每孔1×104個接種于96孔培養板中。實驗時,將IR細胞分為空白組、10 μmol/L羅格列酮組、25 g/L參麥注射液組和50 g/L參麥注射液組,每組3個復孔。按照上述分組,通過MTT方法分別檢測IR細胞在8、16、24和36 h時570 nm處的吸光度值。
2.4葡萄糖濃度測定將最佳造模條件下獲得的IR細胞分為空白組、10 μmol/L羅格列酮組、25 g/L參麥注射液組和50 g/L參麥注射液組,每組3個復孔。按照上述分組,分別收取各組不同藥物在作用細胞8、16和24 h的上清液。細胞上清液葡萄糖濃度使用試劑盒進行檢測,簡述如下:配制0、10、20、40、80、160和200 μmol/L葡萄糖溶液。將各實驗組上清用試劑盒自帶1×reaction buffer 稀釋1倍。配制葡萄糖濃度測定所需反應液。將葡萄糖標準液、空白對照上清液和各實驗組上清液各取50 μL至96孔板中,再加入50 μL反應液,室溫避光反應30 min。用酶標儀測定560 nm處吸光度。
2.5免疫印跡檢測取出CO2培養箱中的細胞,棄去培養液后將培養皿放置于冰上,使用冷的PBS淋洗細胞2遍,吸干凈殘留的PBS,在RIPA裂解液中冰上裂解細胞,用槍頭或者細胞刮刮下細胞后,用1 mL注射器吹打細胞使DNA斷裂,100 ℃孵育5~10 min后,取3 μL用于BCA定量。煮沸后的蛋白-20 ℃保存備用。制備10%的SDS-PAGE膠,蛋白樣品加入上樣buffer后,電泳分離蛋白。小心分離SDS-PAGE膠,恒流1.5 h電轉移到PVDF膜,使用含5%脫脂牛奶的封閉液封閉1 h,與特異性抗體室溫孵育1 h或者4 ℃過夜后,加入內參照抗體β-actin室溫孵育1 h,加入HRP標記 II 抗室溫孵育1 h,TBST洗膜3次,取出膜后加入ECL發光液,暗室中壓片顯影。使用ImageJ軟件對條帶灰度值進行量化分析。
3統計學處理
計量資料數據符合正態分布且方差齊性的均以均數±標準差(means±SD)表示。多組間比較使用單因素方差分析(one-way ANOVA),兩兩比較采用Bonferroni校正的t檢驗;如果方差不齊,采用Dunnett’s T3方法分析。使用GraphPad Prism 5.0進行作圖,以P<0.05為差異有統計學意義。
結果
1前脂肪細胞分化
3T3-L1細胞通過IBMX、地塞米松和胰島素誘導后細胞逐漸變圓,并有脂滴出現。油紅O染色顯示細胞中已經產生紅色的圓形脂肪滴,提示脂肪細胞誘導成功,見圖1。

Figure 1.3T3-L1 cells before and after differentiation into adipocytes (×200). The scale bar is 50 μm. A: 3T3-L1 preadipocytes; B: 3T3-L1 adipocytes; C: 3T3-L1 adipocytes after red oil O staining.
圖13T3-L1細胞誘導成脂肪細胞前后的鏡下對比
2胰島素抵抗模型的建立
在脂肪細胞中加入不同濃度的胰島素,然后在8、16和24 h時收取細胞上清。用葡萄糖氧化酶法測定葡萄糖濃度。計算得到葡萄糖標準曲線為y=0.002 7x+0.0114,R2=0.995。然后計算得出各組經過胰島素誘導后細胞上清液葡萄糖濃度。與空白對照比較,1 μmol/L胰島素作用16 h時細胞上清液葡萄糖濃度與正常組相差最大,說明建立細胞胰島素模型效果為最好,相比于其它胰島素誘導組差異具有統計學意義(P<0.05),見圖2。

Figure 2.The effects of insulin concentration and treatment time on glucose concentration in supernatant of adipocytes. Comparison with control group, the 1 μmol/L insulin 16 h group showed the highest concentration of glucose. Mean±SD.n=3.*P<0.05vscontrol.
圖2不同濃度胰島素作用于脂肪細胞不同時間后的葡萄糖濃度
3不同濃度藥物對細胞活力的影響
10 μmol/L的羅格列酮組及 25 g/L參麥注射液作用于IR細胞 36 h 以內,其吸光度值與正常對照組相比差異無統計學意義,對細胞活力沒有抑制作用。50 g/L的參麥注射液36 h 時其吸光度值與正常對照組相比差異有統計學意義(P<0.05),對細胞活力產生抑制作用,見表1。

表1 不同藥物對IR細胞活力的影響
*P<0.05vscontrol.
4參麥注射液對葡萄糖利用的效果
檢測空白對照組、10 μmol/L羅格列酮組、25 g/L參麥注射液組和50 g/L參麥注射液組8、16和24 h時的細胞上清中葡萄糖的濃度。結果顯示,10 μmol/L羅格列酮24 h作用后上清葡萄糖濃度與空白對照組的差值最小,說明羅格列酮能增加葡萄糖的攝取量,并接近于正常細胞水平。其次是50 g/L參麥注射液24 h組,上述結果顯示羅格列酮改善胰島素抵抗的效果最好,其次為50 g/L參麥注射液組,相比于其它給藥組差異具有統計學意義(P<0.05),見圖3。
5胰島素抵抗相關蛋白的檢測
免疫印跡檢法測定4組藥物作用IR細胞48 h后的蛋白樣品可見,以IR作為空白對照組的樣品中,PI3K和GLUT4呈現低表達,但在加入不同濃度的參麥和羅格列酮后,這2個蛋白的表達量均較對照組表達增加。同時,高濃度參麥實驗組中,GLUT4和PI3K表達量最高(P<0.05),見圖4。同時,我們也檢測了AKT及p-AKT蛋白,發現3個實驗組AKT的蛋白水平與空白對照組相比無明顯變化,但高濃度的參麥組中p-AKT的蛋白水平明顯上升,與空白對照組相比,差異有統計學意義(P<0.05),見圖5。
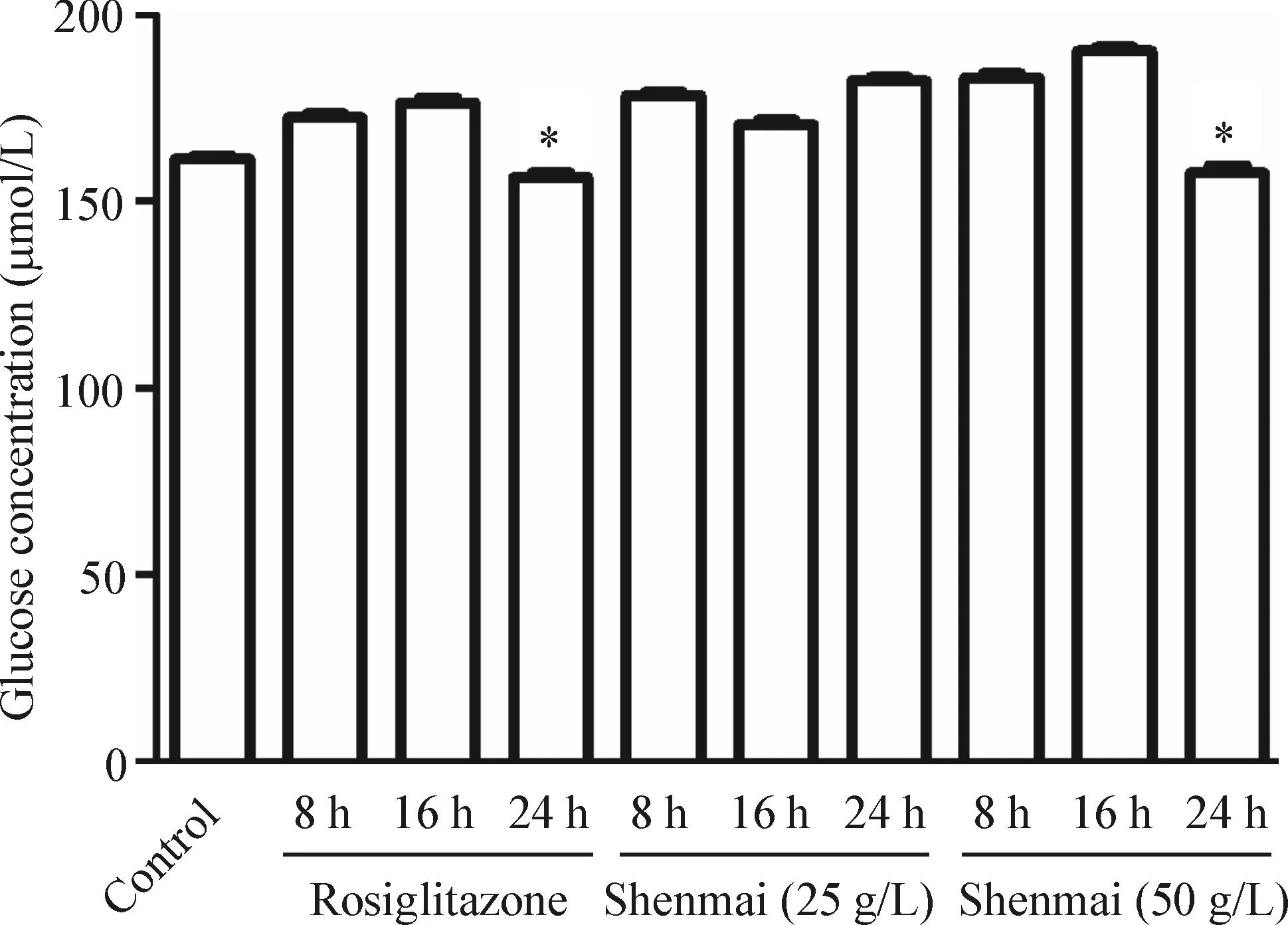
Figure 3.The effects of Shenmai injection and rosiglitazone on glucose concentration in 3T3-L1 IR model cells. The concentration of glucose in 10 μmol/L rosiglitazone group and high concentration of Shenmai group were decreased after 24 h and almost close to the normal level. Mean±SD.n=3.*P<0.05vscontrol.
圖3不用濃度參麥注射液及羅格列酮作用IR模型細胞不同時間后的葡萄糖濃度變化

Figure 4.The protein expression of GLUT4 and PI3K after treatment with Shenmai injection. Mean±SD.n=5.*P<0.05vscontrol.
圖4GLUT4及PI3K蛋白表達的變化

Figure 5.The protein levels of AKT and p-AKT after treatment with Shenmai injection. Mean±SD.n=5.*P<0.05vscontrol.
圖5 AKT總蛋白水平及p-AKT蛋白的變化情況
討論
合適的胰島素抵抗細胞模型將有助于從細胞水平研究胰島素抵抗的作用機制,可以輔助體外篩選改善胰島素抵抗的藥物[9-10]。3T3-L1前脂肪細胞是Swiss小鼠胚胎成纖維細胞,能在誘導劑作用下分化為脂肪細胞,被廣泛應用于糖、脂代謝相關的基礎和實驗研究及胰島素增敏劑藥物作用的評價中[11]。而且有研究證明完全分化的3T3-L1前脂肪細胞中胰島素可通過增加葡萄糖攝取、脂質分解和糖原的合成充分發揮作用,因此3T3-L1前脂肪細胞可作為涵蓋上述3種降糖途徑的細胞模型[12]。因此本實驗采用不同濃度胰島素誘導3T3-L1脂肪細胞建立IR模型,觀察參麥注射液對IR的影響。
脂肪的代謝和胰島素抵抗有密切的關系,脂肪組織是胰島素抵抗發生的最主要靶組織[13],有研究顯示,內臟脂肪性肥胖在胰島素抵抗方面起著特別重要的作用,其與2型糖尿病人胰島素介導的葡萄糖利用率顯著相關[14]。目前胰島素模型主要分為脂肪細胞、肝細胞和骨骼肌細胞IR模型[15]。構建3T3-L1 IR細胞模型的方法,除了有采用高糖、高胰島素聯合誘導建模;還有采用IL-6[16]、地塞米松[17]、游離脂肪酸等誘導細胞IR模型[18]。體內高濃度胰島素的刺激是脂肪細胞產生胰島素抵抗的主要因素之一[19]。本實驗中將3T3-L1完全分化后,使用在1 μmol/L胰島素作用16 h時,IR誘導效果最好。葡萄糖濃度的經典檢測方法是通過[3H]或[14C]標記的葡萄糖攝取實驗來檢測葡萄糖的攝取,需要特殊的工作環境和儀器,而在本研究中驗證模型時使用商品化試劑盒,檢測方便,無需特殊儀器,整體而言,誘導條件簡單,檢測便捷,可以作為較穩定的IR細胞模型用于研究。
胰島素通過與受體特異性結合后發揮生物學作用,最后激活AKT,引起細胞對葡萄糖攝取的增加以及GLUT4向胞膜的移位,PI3K/AKT是胰島素主要信號轉導通路[19]。在本實驗中,高濃度的參麥注射液作用后,PI3K、GLUT4和p-AKT的表達均高于羅格列酮組。說明參麥注射液可以改善胰島素抵抗,高濃度時可能優于羅格列酮的降糖效果。當AKT表達下調時,小鼠胰島素刺激后的肝糖異生明顯減弱[20],相反,當AKT過度表達時,可使3T3-L1脂肪細胞葡萄糖攝取量以及GLUT4向胞膜的轉位[21]。有研究顯示,人參提取物如人參皂苷Rg1等有效成分,能通過抑制胰島素信號轉導過程中JNK 和NF-κB等的活性,而激活AMPK途徑,活化胰島素受體亞單位1,促進葡萄糖轉運體4的移位,提高脂肪、肌肉等外周組織對葡萄糖的攝取利用,從而改善胰島素抵抗[22]。另外,人參皂苷能促進胰島素抵抗大鼠模型GLUT4和PI3K的表達[23]。因此在本實驗中我們比較了參麥注射液給藥前后PI3K、GLUT4、AKT及p-AKT的蛋白水平,相比于對照組,兩個基因表達增加說明參麥注射液存在改善IR的藥理作用。
目前研究顯示,不少中藥單體能夠影響糖代謝,如黃芪對醛糖還原酶有明顯抑制作用[24]。另外,葛根[25]、西洋參[26]和小檗堿[27]可以有效改善胰島素抵抗,增加胰島素的敏感性。有研究顯示,參麥注射液短期治療對2型糖尿病患者有改善胰島素抵抗作用。另外,參麥湯可能通過上調大鼠骨骼肌GLUT4 mRNA來改善胰島素抵抗[28]。在本實驗中,使用3T3-L1前脂肪細胞構建同時涵蓋脂肪和葡萄糖利用的IR模型,并給與參麥注射液,實驗結果顯示,參麥注射液可以明顯改善胰島素抵抗,并且高濃度參麥注射液改善IR的效果可以接近羅格列酮。羅格列酮是臨床常用的抗糖尿病藥物,可以明顯改善胰島素抵抗。但在近年來的臨床應用中,羅格列酮也可導致部分患者的液體潴留和充血性心力衰竭,其心血管的安全性也引起了國內外藥品監管部門的高度警惕,歐盟將其作為二線治療藥使用,美國也多次修改產品說明書,將心衰風險加入了黑框警告[29]。而對傳統中藥而言,由于經歷了無數代人的論證而沿用至今,部分藥方被證明具有一定的安全性,如參麥注射液在臨床廣泛用于多種原因引起的心衰治療[30-31],且罕見發生不良反應[32]。傳統中藥在改善IR方面的應用和研究尚處于起步階段,對中藥組分中部分活性成分的深入探索,可以彌補現有臨床抗糖尿病藥物的不足。
[1]Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9):948-959.
[2]Altaf QA, Barnett AH, Tahrani AA. Novel therapeutics for type 2 diabetes: insulin resistance[J]. Diabetes Obes Metab, 2015, 17(4):319-334.
[3]Li WL, Zheng HC, Bukuru J, et al. Natural medicines used in the traditional Chinese medical system for therapy of diabetes mellitus[J]. J Ethnopharmacol, 2004, 92(1):1-21.
[4]余健,辛艷飛,宣堯仙.參麥注射液藥理作用的物質基礎研究進展[J]. 醫藥導報,2013, 32(4):497-500.
[5]尚文斌,楊穎,陳名道. 人參及其主要成分抗糖尿病作用機制[J].國際內分泌代謝雜志,2007, 27(2):115-117.
[6]尚文斌,于希忠,王國強,等. 人參皂苷Rb1改善高脂喂養肥胖小鼠胰島素抵抗和脂肪異位沉積[J]. 中國中藥雜志, 2013, 38(23):4119-4123.
[7]沙建平,馬紅英,陳曉文,等.麥冬對糖尿病大鼠胰島β細胞的保護作用[J]. 成都中醫藥大學學報, 2014, 37(3):23-24,40.
[8]尚文斌,楊穎,陳名道. 人參及其主要成分抗糖尿病作用機制[J]. 國際內分泌代謝雜志, 2007, 27(2):115-117.
[9]Montagut G, Blade C, Blay M, et al. Effects of a grapeseed procyanidin extract (GSPE) on insulin resistance[J]. J Nutr Biochem, 2010, 21(10):961-967.
[10]Yan J, Zhao Y, Zhao B. Green tea catechins prevent obesity through modulation of peroxisome proliferator-activated receptors[J]. Sci China Life Sci, 2013, 56(9):804-810.
[11]Knutson VP, Balba Y. 3T3-L1 adipocytes as a cell culture model of insulin resistance[J]. In Vitro Cell Dev Biol Anim, 1997, 33(2):77-81.
[12]劉曉華,江湖,李海星,等.胰島素誘導3T3-L1脂肪細胞胰島素抵抗模型的建立[J]. 食品科學, 2012, 33(19):249-253.
[13]任穎,劉偉,陸廣華,等.2型糖尿病病人的內臟脂肪性肥胖和胰島素抵抗[J]. 中國糖尿病雜志, 2003, 11(2):84-87.
[14]董瑩, 劉偉, 任穎, 等. 2型糖尿病患者胰島素抵抗與血脂的相關性探討[J]. 診斷學理論與實踐, 2005, 4(3):216-218.
[15]陳夢云,江國榮.胰島素抵抗細胞模型研究進展[J]. 安徽醫藥, 2012, 16(2):141-143.
[16]曾天舒,潘世秀,陳璐璐.白細胞介素6導致脂肪細胞胰島素抵抗機制的初步探討[J]. 中國病理生理雜志, 2007, 23(7):1331-1334.
[17]楊桂枝,高小平,晏菊芳,等. 地塞米松和胰島素誘導3T3-L1脂肪細胞胰島素抵抗的分子機理[J]. 西南師范大學學報:自然科學版, 2003, 28(3):460-464.
[18]張靜,王秋月,姜雅秋,等. 游離脂肪酸誘導3T3-L1細胞胰島素抵抗模型的建立[J].解剖科學進展, 2008, 14(2):126-129,132.
[19]Hotamisligil GS. Molecular mechanisms of insulin resistance and the role of the adipocyte[J]. Int J Obes Relat Metab Disord, 2000, 24(Suppl 4):S23-S27.
[20]Katome T, Obata T, Matsushima R, et al. Use of RNA interference-mediated gene silencing and adenoviral overexpression to elucidate the roles of AKT/protein kinase B isoforms in insulin actions[J]. J Biol Chem, 2003, 278(30):28312-28323.
[21]Garofalo RS, Orena SJ, Rafidi K, et al. Severe diabetes, age-dependent loss of adipose tissue, and mild growth deficiency in mice lacking Akt2/PKB β[J]. J Clin Invest, 2003, 112(2):197-208.
[22]Lee HM, Lee OH, Kim KJ, et al. Ginsenoside Rg1 promotes glucose uptake through activated AMPK pathway in insulin-resistant muscle cells[J]. Phytother Res, 2012, 26(7):1017-1022.
[23]王雨秾,孫佳犄,劉毓敏. 人參皂苷對胰島素抵抗大鼠模型中GLUT4和P13K表達的影響[J]. 遼寧中醫藥大學學報, 2009, 11(6):234-237.
[24]高成. 銀杏葉與黃芪治療早期糖尿病腎病的臨床觀察[J]. 中原醫刊, 2003, 30(22):37-38.
[25]鄒文俊, 白紅艷,高小平. 中藥葛根改善胰島素抵抗作用的實驗研究[J]. 中國藥理學通報, 2004, 20(6):715-716.
[26]殷惠軍, 張穎, 楊領海, 等. 西洋參莖葉總皂苷對胰島素抵抗脂肪細胞葡萄糖轉運、GLUT-4轉位和CAP基因表達的影響[J]. 中國藥理學通報, 2007, 23(10):1332-1337.
[27]余海,鄭娜,盧芙蓉,等. 小檗堿改善胰島素抵抗機制研究新進展[J]. 中西醫結合研究, 2012, 4(4):203-205,209.
[28]柴可夫,孫煒,馬綱,等. 參麥湯對糖耐量異常大鼠骨骼肌GLUT4 mRNA基因表達的影響[J]. 中華中醫藥學刊, 2011, 29(2):231-234.
[29]歐美賢,盧金淼. “明星藥物”羅格列酮的衰落[J]. 上海醫藥, 2011, 32(3):121-122.
[30]饒朝鵬. 參麥注射治療肺心病心衰患者20例的療效觀察[J]. 時珍國醫國藥, 2010, 21(5):1295-1296.
[31]陳淑玲. 參麥注射液治療心梗后心衰的療效觀察[J]. 吉林中醫藥, 2006, 26(4):19-20.
[32]王麗,尹桃,朱敏文. 參麥注射液不良反應回顧性研究[J]. 中南藥學, 2007, 5(3):273-276.

*[基金項目]國家自然科學基金資助項目(No. 81460001)
Shenmai injection improves insulin resistance in 3T3-L1 cellsMAO Yu-shan1, CHEN Yi-chen2, ZHAO Ya-rong2, CHE Xiao-hang2, TAO Jin2, YE Xiao-lei2
(1DepartmentofEndocrinology,TheAffiliatedHospitalofNingboUniversitySchoolofMedicine,2DepartmentofDrugsandPharmacology,NingboInstituteofMedicalSciences,Ningbo315020,China.E-mail:yexiaolei@gmail.com)
[ABSTRACT]AIM: To discuss the effect of Shenmai injection on insulin resistance (IR) in 3T3-L1 cells and its mechanisms. METHODS: 3T3-L1 preadipocytes were induced by chemical reagents to differentiate into fully differentiated adipocytes. Oil red O staining was used to detect the differentiation level of the adipocytes. The insulin-resistant 3T3-L1 cell model was demonstrated using insulin, which was confirmed by glucose concentration in cell supernatant. The IR cell model was given 10 μmol/L rosiglitazone, 25 and 50 g/L Shenmai injection and normal saline for comparison. MTT assay was used to assess the cell activity of 3T3-L1 cells which was treated with drugs for 8, 16, 24 and 36 h. Glucose oxidase method was used to detect the glucose concentration in the cell supernatant at 8, 16 and 24 h. The protein levels of glucose transporter-4 (GLUT4), phosphatidylinositol 3-kinase (PI3K), AKT and p-AKT were determined by Western blot. RESULTS: 3T3-L1 adipocytes were successfully induced as shown by the positive oil red O staining. The IR cell model was demonstrated, and glucose concentration in the cell supernatant after treatment with Shenmai injection showed that Shenmai injection reduced the IR in 3T3-L1 cell model. The protein levels of GLUT4, PI3K and p-AKT increased compared to control group. CONCLUSION: Shenmai injection reduces the IR in 3T3-L1 cell model, which functions by increasing the protein levels of GLUT4, PI3K and p-AKT.
[KEY WORDS]Insulin resistance; Shenmai injection; 3T3-L1 preadipocytes
通訊作者△Tel: 0433-2435165; E-mail: cuihong@ybu.edu.cn
[收稿日期]2015- 08- 06[修回日期] 2015- 09- 19
[文章編號](責任編輯: 陳妙玲, 羅森)1000- 4718(2015)12- 2239- 05
doi:10.3969/j.issn.1000- 4718.2015.12.020
[中圖分類號]R587; R589; R363
[文獻標志碼]A

