MTDH、miR-26a與腫瘤關(guān)系的研究進(jìn)展
MTDH、miR-26a與腫瘤關(guān)系的研究進(jìn)展
楊晨晨1綜述盧曉梅2審校
(1新疆醫(yī)科大學(xué), 烏魯木齊830011;2新疆醫(yī)科大學(xué)臨床醫(yī)學(xué)研究院, 烏魯木齊830054)
中圖分類號(hào):R73-34文獻(xiàn)標(biāo)識(shí)碼:A
doi:10.3969/j.issn.1009-5551.2015.01.032
目前,腫瘤相關(guān)基因的研究仍然是腫瘤研究的熱點(diǎn)與難點(diǎn)。臨床研究表明,腫瘤細(xì)胞信號(hào)通路中的特定基因的擴(kuò)增/突變/表達(dá)狀態(tài)與靶向、化療藥物的有效性密切相關(guān)。腫瘤分子標(biāo)記物的檢測(cè)有助于發(fā)現(xiàn)新發(fā)腫瘤,臨床上檢測(cè)特定基因的異常改變情況,能針對(duì)性地為每位患者量身定做一套最適合的治療方案,從而最大程度地提高治療的有效率,減少藥物的毒副作用,避免用藥不當(dāng)貽誤治療時(shí)機(jī)。同時(shí),分子標(biāo)記物的檢測(cè)可以對(duì)相關(guān)腫瘤預(yù)后進(jìn)行評(píng)價(jià)。找到1個(gè)或多個(gè)與某個(gè)腫瘤相關(guān)的基因,有助于腫瘤的早期診斷、治療方案的選擇及判斷預(yù)后。腫瘤轉(zhuǎn)移是惡性腫瘤中普遍存在的現(xiàn)象,同時(shí)也是治療失敗和導(dǎo)致患者死亡的主要原因之一。腫瘤的轉(zhuǎn)移是癌細(xì)胞與宿主細(xì)胞相互作用的復(fù)雜過(guò)程,由一系列復(fù)雜的基因調(diào)控系統(tǒng)所組成。因此,幾年來(lái)對(duì)于腫瘤分子生物學(xué)的研究重點(diǎn)逐漸轉(zhuǎn)至腫瘤轉(zhuǎn)移基因與抑制腫瘤轉(zhuǎn)移基因,并對(duì)這些基因的調(diào)控因子和轉(zhuǎn)移過(guò)程中的作用機(jī)制進(jìn)行研究,期望通過(guò)揭示腫瘤轉(zhuǎn)移在基因水平的本質(zhì),為改進(jìn)腫瘤的診斷方法和治療手段提供依據(jù)。MTDH基因又稱星形細(xì)胞提升基因-1(astrocyte elevated gine-1,AEG-1)、LYRIC是2002年首次克隆出來(lái)的新基因。MTDH基因定位在人類8號(hào)染色體上(8q22),由于其能幫助腫瘤細(xì)胞緊貼上遠(yuǎn)距離的血管,因此對(duì)于癌癥的擴(kuò)散和轉(zhuǎn)移意義重大[1]。微小RNA(MicroRNAs,miRNAs)是一類由22~23個(gè)核苷酸組成的具有調(diào)控功能的非編碼小分子RNA,miRNAs通過(guò)與mRNA的3’-UTRs結(jié)合而發(fā)揮調(diào)控作用[2]。有的miRNAs通常在腫瘤中表達(dá)下調(diào),發(fā)揮著抑癌基因的作用,而有的miRNAs則起著癌基因的作用[3-4]。研究表明,miR-26a抑制鼻咽癌、乳腺癌、肝癌細(xì)胞的增殖[5-7],但卻促進(jìn)膠質(zhì)瘤細(xì)胞的增殖[8-9]。miR-26a可能在不同的腫瘤和不同的組織學(xué)類型中發(fā)揮著不同的作用。在Target Scan Human查到miR-26a的下游靶基因是MTDH。本文就MTDH與miR-26a在惡性腫瘤中的作用以及MTDH與miR-26a關(guān)系作一綜述。
1MTDH與在惡性腫瘤中作用的研究進(jìn)展
1.1MTDH基因的結(jié)構(gòu)與細(xì)胞定位MTDH最初在人胚胎初級(jí)星形膠質(zhì)細(xì)胞中被發(fā)現(xiàn),位于與多種惡性腫瘤發(fā)生密切相關(guān)的人類8號(hào)染色體(8q22)上,其啟動(dòng)區(qū)無(wú)TATA或CAAT,富含GC和多個(gè)SPI基序[10]。MTDH由 12 個(gè)外顯子和 11個(gè)內(nèi)含子組成[11]。MTDH作為一種緊密連接蛋白,其同源物在鼠體內(nèi)也被克隆,并被命名為L(zhǎng)YRIC(3D3/Lyric)。MTDH 的cDNA,包括poly-A 尾,由3 611個(gè)堿基組成,其開(kāi)放閱讀框架220~1 968 bp,編碼582個(gè)氨基酸,分子量64 ku,等電點(diǎn)是 9.33。MTDH在胞膜、胞質(zhì)(如內(nèi)質(zhì)網(wǎng)、核周)、胞核及特定區(qū)域核膜、核仁、核質(zhì)中都有分布[12-13]。MTDH的多種亞細(xì)胞定位,可能與不同條件下、不同細(xì)胞中發(fā)揮的作用不同有關(guān)[14-15]。
1.2MTDH與信號(hào)通路MTDH可激活多個(gè)致癌性的信號(hào)轉(zhuǎn)導(dǎo)通路,在介導(dǎo)MTDH的多效功能中發(fā)揮作用。
1.2.1PI3K/AKT信號(hào)通路PI3K/AKT是參與由MTDH介導(dǎo)的腫瘤發(fā)生的1條途徑。PI3K/AKT 信號(hào)通路不僅由MTDH 激活,而且可以調(diào)節(jié)MTDH的表達(dá)。Lee等[16]報(bào)道,MTDH表達(dá)不僅激活PI3K/AKT通路和c-Myc,其本身可激活PI3K/AKT和誘導(dǎo)c-Myc基因的表達(dá),并在神經(jīng)母細(xì)胞瘤激活c-Myc基因的表達(dá),從而導(dǎo)致神經(jīng)母細(xì)胞瘤的發(fā)生。人腦膠質(zhì)瘤細(xì)胞中,AKT活化是VEGF的啟動(dòng)子,同時(shí)在MTDH介導(dǎo)的HIF1-α上調(diào)中發(fā)揮作用[17]。PI3K/AKT信號(hào)調(diào)節(jié)多種生長(zhǎng)調(diào)節(jié)轉(zhuǎn)錄因子,如叉頭框(FOXO)蛋白和NF-κB。在前列腺癌細(xì)胞中,下調(diào)MTDH抑制AKT的活化,導(dǎo)致叉頭框(FOXO)3a和P27的活性增強(qiáng),最終導(dǎo)致細(xì)胞凋亡[18]。在食管癌細(xì)胞,由MTDH激活A(yù)KT,導(dǎo)致細(xì)胞周期蛋白D1(cyclin D1) 的上調(diào)和 P27的下調(diào)[19]。此外,MTDH 的下調(diào)抑制NF-κB 和激活蛋白-1(AP-1)的級(jí)聯(lián)活性,而mRNA和蛋白質(zhì)表達(dá)水平的NF-κB和AP-1調(diào)節(jié)的基因 IL-6、IL-8和基質(zhì)金屬蛋白酶9(MMP-9)顯著下降。 PC-3和 DU145細(xì)胞的侵襲能力也大幅降低。PI3K/AKT的激活導(dǎo)致與MDR1 mRNA有關(guān)的多核糖體增加而導(dǎo)致的化學(xué)耐藥[20]。因此,PI3K/AKT活化介導(dǎo)的MTDH,但是由MTDH激活該途徑的機(jī)制仍有待確定。
1.2.2MTDH 與NF-κB信號(hào)通路NF-κB信號(hào)通路是被確定的另一條激活MTDH的信號(hào)通路。在HeLa細(xì)胞和人惡性膠質(zhì)瘤細(xì)胞中,采用誘導(dǎo)MTDH表達(dá)的腫瘤壞死因子-α (TNF-α)進(jìn)行干預(yù),MTDH 轉(zhuǎn)至核內(nèi)表達(dá),與NF-κB的p65亞基發(fā)生反應(yīng),并且促進(jìn)NF-κB 誘導(dǎo)的基因表達(dá)。在人前單核細(xì)胞,LPS通過(guò)NF-κB活化MTDH的表達(dá)。另一方面,MTDH自身活化NF-κB,抑制MTDH的活性,可以抑制LPS誘導(dǎo)的促炎性細(xì)胞因子如TNF-α和PGE 2的產(chǎn)生。MTDH在細(xì)菌感染中發(fā)揮潛在的免疫作用,MTDH可能在腫瘤的炎癥機(jī)制中起關(guān)鍵作用[21]。Lee 等[22]報(bào)道,在神經(jīng)膠質(zhì)瘤細(xì)胞中,MTDH 與p65 直接發(fā)生作用,充當(dāng)NF-κB的共同激活物,但是TNF-α 減少了NF-κB 依賴性的EAAT2的表達(dá)。提示NF-κB可能是MTDH介導(dǎo)的EAAT2 抑制的1條信號(hào)通路。TNF-α介導(dǎo)的NF-κB抑制并不是普遍現(xiàn)象,TNF-α 還是NF-κB表達(dá)的正向調(diào)節(jié)劑,但是其機(jī)制并不是十分清楚。MTDH 作為橋梁分子可促進(jìn)NF-κB與CBP之間的相互作用,因此充當(dāng)共活化劑的作用,從而誘導(dǎo)NF-κB 依賴性的基因活化。Emdad等[23]報(bào)道,MTDH 激活NF-κB,能促進(jìn)腫瘤細(xì)胞的侵襲和遷移,從而間接有助于腫瘤血管的形成。Zhang等[24]報(bào)道,MTDH通過(guò)降低Caspase 3 的裂解,激活NF-κB信號(hào)通路,增強(qiáng)了HeLa細(xì)胞的自噬能力,從而導(dǎo)致宮頸癌細(xì)胞的化療耐藥,因此MTDH可能被用作治療靶標(biāo),以克服宮頸癌的化療耐藥。
1.2.3絲裂原活化蛋白激酶(MAPK)和Wnt信號(hào)通路除了NF-κB和AKT途徑,MTDH還激活MAP激酶途徑,特別是ME/ERK和p38蛋白激酶途徑,抑制任何一條路徑可導(dǎo)致MTDH誘導(dǎo)的致癌作用的終止。在肝細(xì)胞癌中,MTDH通過(guò)對(duì)激活Raf/MEK/MAPK與Wnt基因/β-catenin的途徑相關(guān)聯(lián)[25]。在人肝癌細(xì)胞HepG3細(xì)胞中,MTDH過(guò)表達(dá)能活化包括ERK 和p38的MAP激酶活性。激酶磷酸化糖原合酶激酶(GSK3β)可增加β-catenin蛋白的穩(wěn)定性及核易位。LEF-1是與β-catenin相互作用的轉(zhuǎn)錄因子,在細(xì)胞核內(nèi)表達(dá)。MTDH的過(guò)表達(dá)也增加了LEF-1的表達(dá)水平。MAPK途徑的特異性抑制劑能夠抑制致癌作用,阻礙基底膜浸潤(rùn)和癌癥的錨定非依賴性生長(zhǎng)[25]。抑制MTDH可減少磷酸化的AKT和GSK-3β,降低β-catenin、淋巴增強(qiáng)結(jié)合因子1(LEF1)和細(xì)胞周期素D1的水平[26]。提示MTDH可能參與Wnt/β-catenin介導(dǎo)的腫瘤發(fā)生。MTDH的靶向抑制可以為癌癥提供一種新的治療策略。最近一項(xiàng)研究表明,上調(diào)MTDH可提高彌漫性大B細(xì)胞淋巴瘤(DLBCL)細(xì)胞系中β-catenin總蛋白的表達(dá)水平,促進(jìn)β-catenin直接或間接易位至胞核,MTDH的下調(diào)能減少β-catenin總蛋白及胞質(zhì)β-catenin蛋白水平,并減少胞核中β-catenin的表達(dá),提示MTDH對(duì)DLBCL的發(fā)展中的作用是通過(guò)Wnt基因/β-catenin信號(hào)通路調(diào)節(jié)介導(dǎo)的[2]。
1.3MTDH的臨床意義MTDH的異常表達(dá)可以促進(jìn)腫瘤的增殖、侵襲、化療抗性、血管生成和轉(zhuǎn)移,是腫瘤標(biāo)記物之一,在很多腫瘤中,MTDH作為一個(gè)獨(dú)立的生物標(biāo)志物與腫瘤的高度侵襲性轉(zhuǎn)移有關(guān),同時(shí)MTDH的高表達(dá)提示該腫瘤預(yù)后較差。 MTDH蛋白在細(xì)胞核或細(xì)胞質(zhì)定位可以預(yù)測(cè)癌癥的過(guò)程和預(yù)后。
1.3.1MTDH與食管癌食管癌是世界上最普遍的惡性腫瘤之一。食管癌在全球范圍內(nèi)的發(fā)生率和死亡率分別位于惡性腫瘤的第8位和第6位[27],是中國(guó)的四大惡性腫瘤,也是我國(guó)死亡率較高的消化道惡性腫瘤之一[28]。食管癌分為食管鱗狀細(xì)胞癌(ESCC)和腺癌(ECA)2種類型。Yu等[29]發(fā)現(xiàn)了MTDH的表達(dá)顯著上調(diào)食管癌細(xì)胞系及食管癌標(biāo)本在轉(zhuǎn)錄和翻譯水平的表達(dá)。免疫組化分析顯示,47.6%68/168(47.6%)的食管癌石蠟組織中MTDH 高表達(dá)。統(tǒng)計(jì)分析表明MTDH的上調(diào)是與食管癌患者的臨床分期(P=0.001)、TNM分期(P值分別為 0.002、0.034和0.021)及組織分化程度(P=0.035)有關(guān)。而MTDH高表達(dá)的患者存活率更短(P<0.001)。多因素分析顯示,MTDH 表達(dá)可能是食管鱗狀細(xì)胞癌存活的一個(gè)獨(dú)立的預(yù)后指標(biāo)。與其他研究所不同的是,該項(xiàng)研究顯示,男性食管癌患者M(jìn)TDH的表達(dá)顯著高于女性患者,差異有統(tǒng)計(jì)學(xué)意義(P=0.041),男性特異性MTDH過(guò)表達(dá)分子機(jī)制和這一觀察結(jié)果的潛在影響仍有待進(jìn)一步研究。
1.3.2MTDH與頭頸部鱗狀細(xì)胞癌頭頸部鱗狀細(xì)胞癌(HNSCC)是頭頸部惡性腫瘤最為常見(jiàn)的一個(gè)類型,是全球第六大常見(jiàn)惡性腫瘤。這類腫瘤的惡性程度高,晚期存活率較低,預(yù)后不佳。Wang等[30]報(bào)道,MTDH的高表達(dá)與區(qū)域淋巴結(jié)轉(zhuǎn)移和較差的5年生存率密切相關(guān)。HNSCC細(xì)胞系中MTDH的下調(diào)減少了HNSCC 細(xì)胞系的集落形成、遷移和侵襲能力。相對(duì)于正常組織,MTDH在HNSCC組織中高表達(dá),miR-375在HNSCC組織中低表達(dá)(P=0.015和P=0.008)。轉(zhuǎn)染si-MTDH后,頭頸部鱗癌細(xì)胞的增殖顯著受到抑制,MTDH可能是頭頸部鱗癌的癌基因[31]。
1.3.3MTDH與乳腺癌乳腺癌是第2種最常見(jiàn)的癌癥,是導(dǎo)致美國(guó)婦女死亡的首要原因[32-33]。中國(guó)不是乳腺癌的高發(fā)國(guó)家,但不宜樂(lè)觀。Li等[34]首先提出MTDH是一種致癌的Ha-ras基因的靶基因,在含有癌細(xì)胞的原發(fā)性乳腺癌組織以及轉(zhuǎn)移性的區(qū)域中檢測(cè)到MTDH的高表達(dá),統(tǒng)計(jì)分析表明MTDH的表達(dá)與臨床分期(P=0.001)、T分期(P=0.004)、N分期(P=0.026)和M分期有關(guān)(P=0.001)。MTDH高表達(dá)的患者總生存時(shí)間更短,而MTDH低表達(dá)者生存狀態(tài)較好。MTDH 主要在細(xì)胞質(zhì)中表達(dá),而轉(zhuǎn)移腫瘤顯示核染色的比例很高。另有研究報(bào)道,MTDH高表達(dá)顯著與高核級(jí)、雌激素受體(ER)和孕激素受體(PR)的陰性表達(dá)、Ki67的高水平有關(guān),同時(shí)也與低生存率(P=0.000 1)、遠(yuǎn)處轉(zhuǎn)移低生存率相關(guān)(P=0.009)。在淋巴結(jié)陰性患者中,MTDH的高表達(dá)預(yù)后極不理想。多因素分析顯示,MTDH的表達(dá)是低生存率 (HR 3.45,95% CI為1.69~6.84,P=0.001 0)和低遠(yuǎn)處轉(zhuǎn)移生存率(HR 2.39,95%CI為1.08~5.01,P=0.031 9)的影響因素。MTDH表達(dá)導(dǎo)致浸潤(rùn)性乳腺癌預(yù)后不良[35]。Su等[36]采用免疫組化方法分析249例乳腺癌組織中MTDH的表達(dá),包括29 例導(dǎo)管增生(UDH)、14例非典型性導(dǎo)管增生(ADH)、37 例原位導(dǎo)管癌(DCIS)、162例浸潤(rùn)性導(dǎo)管癌和7例正常乳腺組織。在UDH、ADH、DCIS和浸潤(rùn)性導(dǎo)管癌組織中,MTDH的陽(yáng)性表達(dá)率分別為24.14%、28.57%、72.97%和55.56%。在正常乳腺組織未檢測(cè)到MTDH的過(guò)表達(dá)。MTDH在浸潤(rùn)性癌的表達(dá)率高于其在原位癌中的表達(dá)率,提示MTDH可能參與導(dǎo)管癌的發(fā)生。在DCIS患者,MTDH的表達(dá)與ER、PR和HER2的表達(dá)沒(méi)有相關(guān)性,而與Ki-67的表達(dá)(P=0.008)與組織學(xué)分級(jí)有關(guān)(P=0.035)。 在浸潤(rùn)性乳腺癌患者中,MTDH的表達(dá)與患者的年齡(P=0.042)、Ki-67狀態(tài)(P=0.036)、ER(P=0.018)、p53(P=0.001)密切相關(guān)。提示MTDH在乳腺癌不同組織類型中起到不同的作用。
1.3.4MTDH與舌鱗狀細(xì)胞癌舌鱗狀細(xì)胞癌(TSCC)是最常見(jiàn)的口腔癌類型,占口腔鱗癌的41%,TSCC腫瘤的細(xì)胞增殖和淋巴結(jié)轉(zhuǎn)移率很高。Ke等[37]采用免疫組織化學(xué)法(IHC)檢測(cè)93例舌鱗癌石蠟包埋組織MTDH蛋白表達(dá),并選取4對(duì)舌鱗癌同一病人癌旁組織作為對(duì)照。免疫組化結(jié)果顯示,MTDH在舌鱗癌組織中的陽(yáng)性率(48.39%,45/93)明顯高于正常舌組織(10.00%,3/30)(P<0.001)。同時(shí),MTDH的蛋白水平與分化程度(P<0.001)、臨床分期(P<0.001)、T分期(P=0.007)和N分期(P=0.012)相關(guān)。此外,具有較高的MTDH表達(dá)的患者總生存時(shí)間更短。多變量分析(Cox回歸)結(jié)果也顯示,MTDH的表達(dá)是舌鱗癌(P=0.043)的獨(dú)立預(yù)后指標(biāo)。研究結(jié)果表明,MTDH的表達(dá)與癌變舌鱗癌的發(fā)生、發(fā)展有關(guān),可能是一種新的、有價(jià)值的預(yù)測(cè)舌鱗癌患者的預(yù)后評(píng)估指標(biāo)。Deng等[38]研究報(bào)道,舌鱗狀細(xì)胞癌 Epha7和 MTDH蛋白表達(dá)陽(yáng)性率分別為55.6%和60%,均明顯高于癌旁正常上皮組織[χ2(Epha7和 MTDH)分別為4.14、5.25,P均<0.05]。組織學(xué)分級(jí)Ⅰ~Ⅱ、臨床分期Ⅰ~Ⅱ期及無(wú)頸部淋巴結(jié)轉(zhuǎn)移病例Epha7和 MTDH表達(dá)陽(yáng)性率明顯低于組織學(xué)分級(jí)Ⅲ~Ⅳ級(jí)、臨床分期Ⅲ~Ⅳ期及頸部淋巴結(jié)轉(zhuǎn)移病例(P<0.05或P<0.01)。提示Epha7和 MTDH表達(dá)水平在舌鱗狀細(xì)胞癌發(fā)生、發(fā)展中可能起重要作用,Epha7和 MTDH過(guò)表達(dá)者提示預(yù)后不良。
1.3.5MTDH與肝細(xì)胞癌一些研究分析了MTDH與肝癌的臨床相關(guān)性。Yoo等[39]首次發(fā)現(xiàn)MTDH在原代大鼠肝細(xì)胞和肝癌細(xì)胞系HepG3、QGY-7703、SNU-423、Hep3B、Huh7,SK-Hep-1中的表達(dá)。MTDH在原代大鼠肝細(xì)胞中的表達(dá)低于人肝癌細(xì)胞中的表達(dá)。MTDH在QGY-7703細(xì)胞的表達(dá)明顯高于在HepG3細(xì)胞的表達(dá)。這些結(jié)果由免疫組化組織芯片(TMA)證實(shí),包括86例原發(fā)性肝癌、23例轉(zhuǎn)移性肝癌和9例癌旁正常組織。在9例癌旁正常組織中MTDH低表達(dá),在肝癌組織中MTDH 明顯高表達(dá)。Zhu等[40]進(jìn)行的免疫組化結(jié)果顯示,MTDH主要被定位于細(xì)胞膜和細(xì)胞質(zhì)。MTDH在腫瘤組織的表達(dá)顯著高于癌旁組織,MTDH的高表達(dá)率為54.2%(175/ 323),進(jìn)一步研究顯示, MTDH的表達(dá)與微血管侵犯(P<0.001)、腫瘤分化程度(P=0.002)、TNM分期(P=0.001)有關(guān)。結(jié)果表明,MTDH的表達(dá)提示有腫瘤的微血管侵犯,分化差,TNM分期Ⅱ和Ⅲ。但MTDH的表達(dá)與其他相關(guān)臨床病理特征如年齡、性別、肝硬化、血清α-甲胎蛋白、腫瘤直徑、腫瘤包膜或巴塞羅那分期(BCLC)無(wú)關(guān)。Gong等[41]研究表明,與正常組織比較,MTDH在HBV相關(guān)HCC組織中表達(dá)升高。提示在HBV肝炎向HBV相關(guān)HCC轉(zhuǎn)變中,MTDH的表達(dá)逐漸增高。此外,統(tǒng)計(jì)分析顯示,在HBV相關(guān)的HCC患者,MTDH與美國(guó)腫瘤聯(lián)合委員AJCC,第7版)分期(P=0.020)、T分期(P=0.007)、N分期(P=0.044)、血管侵犯(P=0.006)和組織分化程度(P=0.020)有關(guān)。此外,患者的高M(jìn)TDH水平使患者的生存時(shí)間縮短(P=0.001)。
1.4MTDH的惡性生物學(xué)行為
1.4.1MTDH在腫瘤增殖和侵襲中的作用正常細(xì)胞向癌細(xì)胞生長(zhǎng)經(jīng)歷控制獨(dú)立生長(zhǎng)、永生化改造,最終獲取侵襲和轉(zhuǎn)移能力。MTDH是腫瘤的生物標(biāo)記物,MTDH的病理生理作用促進(jìn)細(xì)胞的生長(zhǎng)和增殖,錨定非依賴性生長(zhǎng)變更、遷移、侵襲、化療、血管生成和體內(nèi)腫瘤發(fā)生和轉(zhuǎn)移。在非小細(xì)胞肺癌中,下調(diào)MTDH的表達(dá)通過(guò)細(xì)胞周期停滯、抑制遷移和侵襲,體外減少錨定非依賴性和依賴性生長(zhǎng)并進(jìn)一步抑制腫瘤發(fā)生、生長(zhǎng)和轉(zhuǎn)移。MTDH的過(guò)表達(dá)增加細(xì)胞的侵襲。MTDH表達(dá)逆轉(zhuǎn)前轉(zhuǎn)移肌動(dòng)蛋白細(xì)胞骨架重構(gòu)和抑制EMT,支持了MTDH對(duì)癌細(xì)胞增殖和轉(zhuǎn)移的關(guān)鍵作用[42]。Zhang等[43]采用3(4,5-二甲基-2-基-2,5-二苯基溴化(MTT)檢測(cè)MTDH對(duì)乳腺癌細(xì)胞MCF-7的增殖和侵襲的生物學(xué)作用,結(jié)果顯示MTDH的過(guò)表達(dá)促進(jìn)乳腺癌細(xì)胞的增殖和侵襲能力,并上調(diào)HER2/neu基因,其提供了一種潛在的靶向乳腺癌治療的方法。
1.4.2MTDH與化療耐藥化療耐藥是侵襲性癌癥的重要標(biāo)志。MTDH有助于對(duì)各種化學(xué)治療劑包括5-氟尿嘧啶(5-FU)、多柔比星、紫杉醇、順鉑和4-羥基環(huán)磷酰胺(4-HC)發(fā)生化療耐藥。在SiHa細(xì)胞、HeLa細(xì)胞、宮頸癌CasKi和C33A細(xì)胞,MTDH表達(dá)水平與順鉑的化療耐藥相關(guān)。MTDH在HeLa細(xì)胞可增加自噬,可能與其降低裂解胱天蛋白酶-3的活性和EER/ NF-κB途徑的激活有關(guān)。MTDH可能被用作治療靶標(biāo),以克服宮頸癌的化療耐藥[44]。Yoo等[45]闡明MTDH誘導(dǎo)耐藥的分子機(jī)制,MTDH增加多藥耐藥基因1(MDR1)蛋白表達(dá),從而增加了外排,降低阿霉素的積累,促進(jìn)阿霉素耐藥。抑制MDR1的小干擾RNA或化學(xué)試劑,或抑制MTDH的1個(gè)或2個(gè)基因的組合,顯著增加體外阿霉素的敏感性。在裸鼠移植瘤的研究中,慢病毒表達(dá)MTDH的短發(fā)夾RNA與阿霉素的聯(lián)合,較單用MTDH的短發(fā)夾RNA或阿霉素能顯著性地抑制人肝癌細(xì)胞的生長(zhǎng)。研究盡管顯示MTDH不影響MDR1基因的轉(zhuǎn)錄,但其有利于MDR1 mRNA與核糖體關(guān)聯(lián),從而提高翻譯。MTDH也抑制泛素化和MDR1蛋白質(zhì)的隨后的蛋白酶體介導(dǎo)的降解。MTDH的抑制可能更有效地利用于肝癌的化療。
1.4.3MTDH與腫瘤的轉(zhuǎn)移惡性腫瘤細(xì)胞從原發(fā)部位,經(jīng)淋巴道、血管或體腔等途徑,到達(dá)其他部位繼續(xù)生長(zhǎng),稱腫瘤轉(zhuǎn)移。研究表明[46],在轉(zhuǎn)染MTDH逆轉(zhuǎn)錄病毒shRNA表達(dá)載體的骨肉瘤細(xì)胞系U2OS和SOSP-M中,轉(zhuǎn)移傾向、細(xì)胞增殖都顯著降低。轉(zhuǎn)染MTDH逆轉(zhuǎn)錄病毒shRNA后,U2OS和SOSP-M細(xì)胞的侵襲和遷移能力明顯降低。此外,下調(diào)MTDH后,上皮-間質(zhì)轉(zhuǎn)化(EMT)也減少,MTDH的過(guò)度表達(dá)顯著與骨肉瘤的轉(zhuǎn)移相關(guān)。 研究證實(shí)[47],MTDH通過(guò)調(diào)節(jié)EMT促進(jìn)骨肉瘤發(fā)生轉(zhuǎn)移。在頭頸部鱗癌中,體外實(shí)驗(yàn)表明,MTDH表達(dá)可增強(qiáng)頭頸部鱗狀細(xì)胞的遷移和侵襲能力。MTDH誘導(dǎo)EMT,由2個(gè)調(diào)節(jié)形態(tài)學(xué)變化和介導(dǎo)的生物分子的E-鈣粘蛋白和波形蛋白的表達(dá)。此外,MTDH介導(dǎo)的AKT活化,所有的上述效應(yīng)幾乎完全通過(guò)AKT的抑制阻斷。研究結(jié)果表明,MTDH可能通過(guò)AKT信號(hào)通路介導(dǎo)的EMT促進(jìn)頭頸部鱗狀細(xì)胞的轉(zhuǎn)移[47]。
2miR-26a在惡性腫瘤中的作用研究進(jìn)展
2.1miR-26a的結(jié)構(gòu)Hsa-miR-26a(miR-26a)首先從Hela細(xì)胞克隆得到,在多種組織泛表達(dá),其表達(dá)無(wú)組織特異性。miR-26a-1、miR-26a-2、miR-26b 是Hsa-miR-26a 家族中的3種亞型,分別位于3、12和2號(hào)染色體。miR-26a-1和miR-26a-2的成熟體miRNA 具有相同的序列,與miR-26b成熟體miRNA有2個(gè)核苷酸不同(圖1)。在一系列細(xì)胞核內(nèi)和胞漿內(nèi)酶的作用下,帶有莖-環(huán)結(jié)構(gòu)miR-26被加工成成熟miR-26(圖2)[48]。成熟miR-26為21~22個(gè)核苷酸長(zhǎng),為6~7的種子區(qū)域核苷酸。miR-26的種子區(qū)的序列為結(jié)合靶mRNA的區(qū)域,miR-26通過(guò)與mRNA的3’-UTRs結(jié)合而發(fā)揮調(diào)控作用。由于miR-26可以抑制靶基因的翻譯和減少靶基因編碼蛋白的表達(dá)水平,所以miRNA有許多調(diào)節(jié)腫瘤發(fā)生及腫瘤的靶基因。miR-26a的表達(dá)失調(diào)參與了多種腫瘤的發(fā)生發(fā)展和侵襲轉(zhuǎn)移,如肺癌、甲狀腺癌、子宮平滑肌肉瘤、乳腺癌和結(jié)腸癌等。
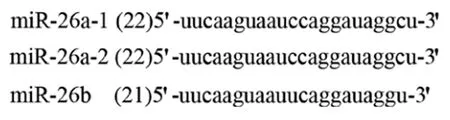
圖1 成熟體miR-26a的序列
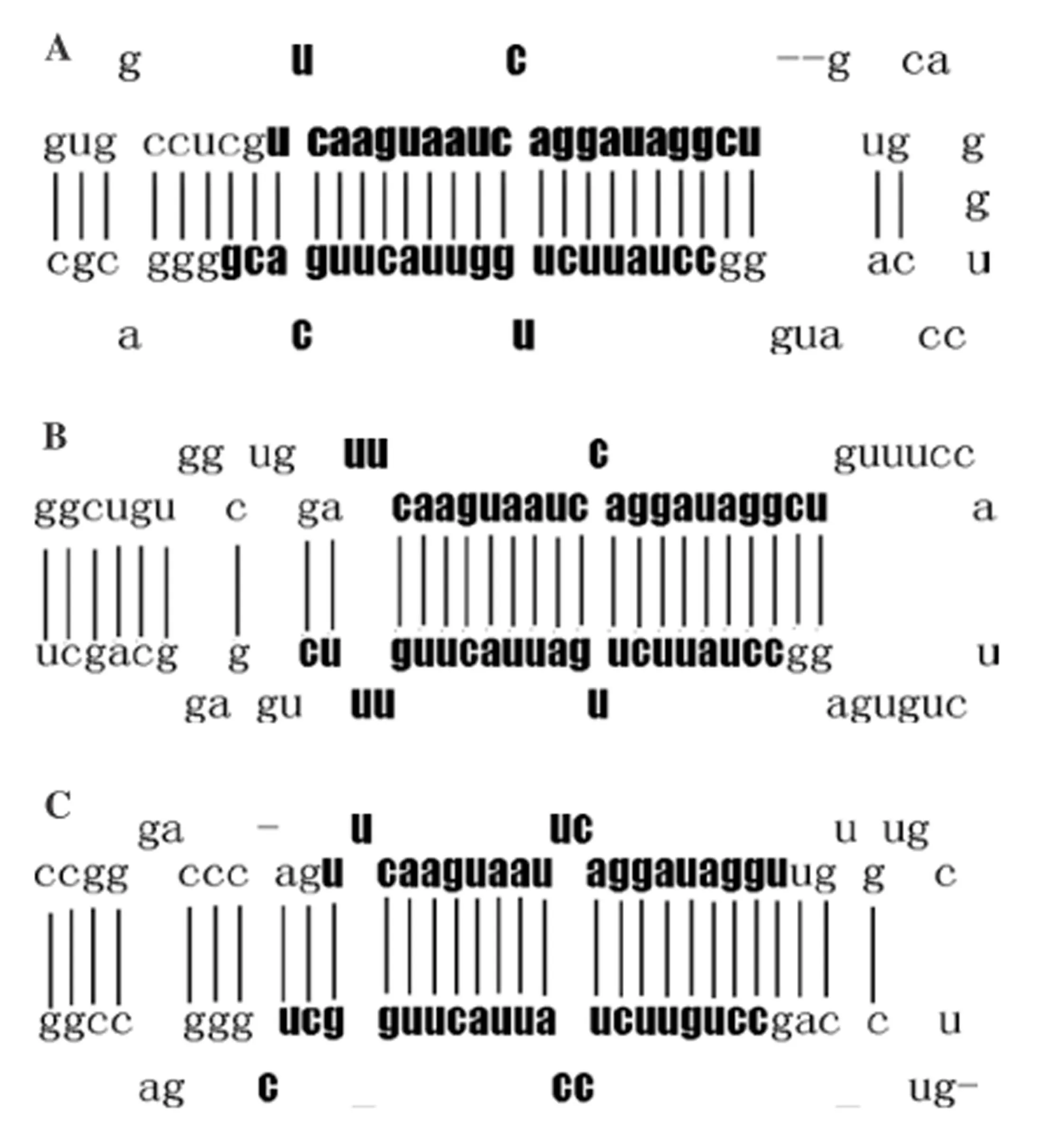
A:pre-miR-26a-1;B:pre-miR-26a-2;C:pre-miR-26b
2.2miR-26a與腫瘤的關(guān)系50%以上的miRNAs定位在腫瘤相關(guān)的基因組區(qū)域(cancer associated genomic regions,CAGR),包括LOH區(qū)、染色體擴(kuò)增區(qū)及脆性位點(diǎn)等,其表達(dá)水平在許多腫瘤中發(fā)生改變,可能起到原癌基因或腫瘤抑制基因的作用,因此也將此類miRNA稱作oncomirs。到目前為止,已發(fā)現(xiàn)多個(gè)發(fā)揮原癌基因或腫瘤抑制基因作用的miRNAs,如let-7、miR-21、miR-17-92 cluster、miR-143、miR-145、miR-372和miR-375等,它們通過(guò)調(diào)控下游靶基因的轉(zhuǎn)錄和翻譯參與了腫瘤的演進(jìn)過(guò)程。miR-26a在多種組織泛表達(dá),無(wú)組織特異性.但對(duì)于其具體功能還知之甚少。而令人費(fèi)解的是,miR-26a在不同腫瘤的發(fā)病機(jī)制中扮演了截然相反的雙重角色。在淋巴瘤、乳腺癌以及肝癌中,miR-26a在癌組織中表達(dá)降低,并發(fā)揮抑癌基因的作用;而在膠質(zhì)瘤中,miR-26a卻表達(dá)增高,扮演癌基因的角色。miR-26a抑制急性髓細(xì)胞樣白血病細(xì)胞的增殖,卻促進(jìn)急性T淋巴細(xì)胞白血病細(xì)胞的增殖。這些有爭(zhēng)議的結(jié)論表明,miR-26a可能在不同的腫瘤和不同的組織學(xué)類型中發(fā)揮著不同的作用,其功能的復(fù)雜程度是毋庸置疑的。
2.2.1miR-26a在腫瘤中的抑癌基因作用在膀胱癌、乳腺癌、口腔鱗狀細(xì)胞癌、間變癌、伯基特淋巴瘤、肝癌和橫紋肌肉瘤中miR-26的表達(dá)降低,并且被認(rèn)為是一種抑制miRNA,起到抑制腫瘤的作用,miR-26a在這些腫瘤中充當(dāng)抑癌基因的角色。Zhao等[49]報(bào)道,miR-26a在前列腺癌組織和細(xì)胞中的表達(dá)低于正常前列腺組織和細(xì)胞,另外穩(wěn)定的轉(zhuǎn)染miR-26a的慢病毒能夠抑制前列腺癌細(xì)胞的增殖、轉(zhuǎn)移、上皮間質(zhì)轉(zhuǎn)化和誘導(dǎo)細(xì)胞阻滯在G1期。Wnt5a是miR-26a的生物信息學(xué)分析潛在的靶基因。熒光素酶檢測(cè)和Western blot分析確定了Wnt5a是miR-26a的新的直接靶基因,miR-26a可以靶向作用于Wnt5a而抑制前列腺癌。一項(xiàng)關(guān)于膽囊癌的研究發(fā)現(xiàn), miR-26a在膽囊癌組織中是下調(diào)的,miR-26a的表達(dá)與腫瘤的組織學(xué)分級(jí)相關(guān)聯(lián),miR-26a能顯著抑制膽囊癌細(xì)胞增殖[50]。此外,該研究證實(shí)了HMGA是miR-26a的直接目標(biāo)。HMGA2 mRNA和miR-26a呈負(fù)相關(guān)。此外,HMGA2拮抗劑能阻礙miR-26a對(duì)膽囊癌細(xì)胞增殖的抑制,結(jié)果表明miR-26a的表達(dá)通過(guò)靶向HMGA2促進(jìn)膽囊癌增殖,miR-26a可作為膽囊癌的預(yù)后因子和治療靶點(diǎn)。Song等[51]發(fā)現(xiàn)miR-26a在骨肉瘤組織和細(xì)胞系中的表達(dá)水平明顯低于正常對(duì)照。miR-26a的表達(dá)下調(diào)與骨肉瘤的不良臨床分期和遠(yuǎn)處轉(zhuǎn)移有關(guān)。多因素分析表明,miR-26a的這種損失是影響骨肉瘤總生存的獨(dú)立預(yù)后因素。此外,miR-26a的表達(dá)抑制骨肉瘤細(xì)胞侵襲和遷移。miR-26a通過(guò)靶向其3'-UTR抑制Enhancer of zeste homolog 2 (EZH2)的表達(dá)。此外,EZH2上調(diào)并miR-26a的表達(dá)呈負(fù)相關(guān)。證明miR-26a的表達(dá)下調(diào)與腫瘤侵襲性和腫瘤轉(zhuǎn)移有關(guān),miR-26a的關(guān)聯(lián)通過(guò)靶向EZH2基因在骨肉瘤抑制細(xì)胞遷移和侵襲。miR-26a的是骨肉瘤患者一個(gè)獨(dú)立的預(yù)后標(biāo)志物。Jia等[52]關(guān)于舌鱗狀細(xì)胞癌的研究顯示,舌鱗狀細(xì)胞癌miR-26a和長(zhǎng)鏈非編碼RNA(long noncoding RNA,lncRNA) MEG3基因表達(dá)較正常的舌組織中大大減少,miR-26a的低表達(dá)水平和MEG3是舌鱗癌預(yù)后差的獨(dú)立預(yù)后因素。在人舌鱗癌細(xì)胞株SCC-15和CAL27中,miR-26a的抑制可能導(dǎo)致MEG3的上調(diào),減少的miR-26a和MEG3可能存在鏈接關(guān)系。此外miR-26a和MEG3的過(guò)表達(dá)抑制SCC-15和CAL27的增殖和細(xì)胞周期進(jìn)程,促進(jìn)細(xì)胞凋亡。miR-26a和MEG3可能在舌鱗癌發(fā)病中起重要的抗腫瘤作用。
2.2.2miR-26a在腫瘤中的癌基因作用在神經(jīng)膠質(zhì)瘤和卵巢癌中miR-26高表達(dá),促進(jìn)了腫瘤細(xì)胞的生長(zhǎng)和增殖,充當(dāng)癌基因的作用。miR-26a的過(guò)度表達(dá)促進(jìn)卵巢癌增殖和克隆形成。miR-26a通過(guò)抑制ER-α的轉(zhuǎn)錄后修飾來(lái)促進(jìn)卵巢癌(OC)細(xì)胞生長(zhǎng)。此外,抑制的miR-26a阻礙了裸鼠注射OC細(xì)胞的腫瘤形成。異常表達(dá)的miR-26a可以有助于OC的發(fā)展[53]。Qian等[54]報(bào)道,miR-26a在神經(jīng)膠質(zhì)瘤細(xì)胞中能促進(jìn)腫瘤細(xì)胞的生長(zhǎng)和細(xì)胞集落以及血管生成,而下調(diào)miR-26a的表達(dá)則起到相反的作用。在神經(jīng)膠質(zhì)瘤細(xì)胞miR-26a直接靶向抑制素(PHB)水平,與miR-26a的表達(dá)呈負(fù)相關(guān),并與膠質(zhì)瘤等級(jí)密切相關(guān)。該結(jié)果揭示miR-26a調(diào)節(jié)PHB,在體內(nèi)和體外促進(jìn)神經(jīng)膠質(zhì)瘤的進(jìn)展,為神經(jīng)膠質(zhì)瘤基礎(chǔ)的治療有幫助。
2.3miR-26a的下游靶基因及相互調(diào)節(jié)關(guān)系一系列研究表明,EZH2、PTEN、MCL-1 和MTDH是潛在的miR-26的下游靶基因。但miR-26與其靶基因在不同腫瘤中的作用仍然不清楚,需要進(jìn)行進(jìn)一步調(diào)查。
2.3.1miR-26a與MTDHZhang等[55]首次報(bào)道了miR-26a在乳腺癌標(biāo)本和細(xì)胞系中下調(diào),miR-26a的瞬時(shí)轉(zhuǎn)染促進(jìn)乳腺癌細(xì)胞系MCF7細(xì)胞的細(xì)胞凋亡。MTDH和EZH2被識(shí)別為miR-26a的2個(gè)直接的靶標(biāo),MTDH和EZH2在乳腺癌顯著上調(diào)。外源性的miR-26a異種移植物MCF7細(xì)胞能減少M(fèi)TDH和EZH2的表達(dá)。此外,MTDH下調(diào)導(dǎo)致細(xì)胞凋亡,MTDH能逆轉(zhuǎn)miR-26a在MCF7細(xì)胞凋亡的作用。研究結(jié)果表明miR-26a的功能通過(guò)靶向MTDH和EZH2的拮抗人乳腺癌的發(fā)生。
2.3.2miR-26a與MCL-1Gao等[56]研究表明,在乳腺癌細(xì)胞和臨床標(biāo)本中,miR-26a可下調(diào)細(xì)胞增殖、細(xì)胞集落的形成、遷移及細(xì)胞凋亡。MCL-1是Bcl-2家族的抗凋亡成員,是miR-26a 的下游靶因。乳腺癌細(xì)胞系miR-26a與MCL-1呈負(fù)相關(guān)關(guān)系。該研究進(jìn)一步探討了MCL-1參與miR-26a增加紫杉醇對(duì)乳腺癌細(xì)胞的敏感性的作用,miR-26a通過(guò)調(diào)控MCL-1對(duì)細(xì)胞增殖和乳腺癌轉(zhuǎn)移產(chǎn)生影響。
2.3.3miR-26a與PTENLiu 等[2]報(bào)道了miR-26a對(duì)肺癌細(xì)胞的轉(zhuǎn)移潛力的影響。在淋巴結(jié)轉(zhuǎn)移腫瘤組織,miR-26a的表達(dá)水平高于原發(fā)肺癌組織,miR-26a的異位表達(dá)可顯著提高肺癌細(xì)胞的遷移和侵襲能力。進(jìn)一步機(jī)理研究揭示了miR-26a可增加AKT的磷酸化和NF-κB的轉(zhuǎn)錄激活,miR-26a能增強(qiáng)肺癌細(xì)胞轉(zhuǎn)移潛能,通過(guò)調(diào)制轉(zhuǎn)移相關(guān)基因的表達(dá),并通過(guò)抑制PTEN基因激活A(yù)KT信號(hào)通路,表明miR-26a可能是治療轉(zhuǎn)移性肺癌的一種潛在的治療候選者。
2.3.4miR-26a與EZH2Yu等[57]一項(xiàng)關(guān)于鼻咽癌的研究表明, miR-26a的表達(dá)可抑制鼻咽癌細(xì)胞的遷移和侵襲能力;使用小鼠模型研究顯示miR-26a在體外抑制鼻咽癌的轉(zhuǎn)移。miR-26a降低了EZH2在體外和體內(nèi)的表達(dá)水平,提示miR-26a的鼻咽癌的抗轉(zhuǎn)移作用是通過(guò)調(diào)節(jié)EZH2介導(dǎo)的。Dang 等[58]研究報(bào)道,miR-26a在A549人肺癌細(xì)胞系可顯著抑制細(xì)胞增殖的表達(dá),阻止體外G1/S期過(guò)渡,誘導(dǎo)細(xì)胞凋亡,并抑制細(xì)胞侵襲和轉(zhuǎn)移。用miR-26a的抑制劑轉(zhuǎn)染A549細(xì)胞后,抑制miR-26a能促進(jìn)細(xì)胞遷移和侵襲。miR-26a抑制EZH2和下游靶基因,包括DAB2IP和RUNX3的增強(qiáng)的表達(dá),表明EZH2是miR-26a的一個(gè)下游靶基因。miR-26a的使用可作為一種抗致癌基因在人肺癌的分子機(jī)制中起重要作用,并且可能被用于肺癌的治療。
綜上所述,MTDH、miR-26a在腫瘤的發(fā)生發(fā)展及腫瘤轉(zhuǎn)移中起到不同的作用,并且 MTDH及miR-26a在乳腺癌中存在上下游靶基因的調(diào)控關(guān)系,但是在食管癌中的存在的調(diào)控關(guān)系仍需進(jìn)一步研究。
參考文獻(xiàn):
[1]Ge XL,Lv X, Feng LL.Metadherin Contributes to the pathogenesis of diffuse large B-cell lymphoma[J]. PloS One,2012,7(6): e39449.
[2]Liu B,Wu X,Liu B,et al.MiR-26a enhances metastasis potential of lung cancer cells via AKT pathway by targeting PTEN[J].Biochim Biophys Acta, 2012,1822(11):1692-1704.
[3]Medina PP,Nolde M,Slack FJ.OncomiR addiction in an in vivo model of microRNA-21-induced pre-B-cell lymphoma[J]. Nature,2010,467: 86-90.
[4]Garofalo M,Croce CM.microRNAs:Master regulators as potential therapeutics in cancer[J]. Annu Rev Pharmacol Toxicol,2011,51:25-43.
[5]Lu J,He ML,Wang L,et al.MiR-26a inhibits cell growth and tumorigenesis of nasopharyngeal carcinoma through repression of EZH2[J].Cancer Res,2011,71(1):225-233.
[6]Kota J,Chivukula RR,O’Donnell KA,et al.Therapeutic microRNA delivery suppresses tumorigenesis in a routine liver cancer model[J].Cell,2009,137(6):1005-1017.
[7]Zhang B,Liu XX,He JR,et al.Pathologicallydecreased miR-26a antagonizes apoptosis and facilitates carcinogenesis by targeting MTDH and EZH2 in breast cancer[J].Carcinogenesis,2011,32(1):2-9.
[8]HuseJT,Brennan C,Hambardzumyan D,et al.The PTEN-regulating microRNA MiR-26a is amplified in high-grade glioma and facilitates gliomagenesis in vivo[J].Genes Dev,2009,23(11):1327-1337.
[9]Kim H,Huang W,Jiang X,et al.Integrative genome analysis reveals an Oncomir/oncogene cluster regulating glioblastoma survivorship[J].Proc Natl Acad Sci USA,2010,107(5):2183-2188.
[10]AnttiIa V,Stefansson H,KaljeJa M,et al.Genome-wide association study of migraine implicates a common susceptibility variant on 8q22.1[J].Nat Genet,20l0,42(10):869-873.
[11]Yoo BK, Emdad L,Lee SG, et al.Astrocyte Elevated Gene-1 (AEG-1): a multifunctional regulatorof normal and abnormal physiology[J].Pharmacol Ther, 2011,130(1): 1-8.
[12]Meng X, Zhu D, Yang S, et al. Cytoplasmicmetadherin(MTDH) provides survival advantage under conditions of stress by acting as RNA-binding protein[J].J Biol Chem,2012,287:4485-4491.
[13]Liao WT,Guo L,Zhong Y,et al.Astrocyte elevated gene-1 (AEG-1) is a marker for aggressive salivary ghnd carcinoma[J].J Transl Med,2011,9:205.
[14]Yoo BK,Emdad L,Su ZZ,et al.Astrocyte elevated gene.regulates hepatoellular carcinoma development and progression[J].J Clin Invest,2009,119:465-477.
[15]Thirkettle HJ,Giding J,Warren AY,et al.LYRIC/AEG-1 is targeted to different subcellular compartments by ubiquitiny1ation and intrinsic nuclear localization signals[J].Clin Cancer Res,2009,15:3003-3013.
[16] Lee SG, Jeon HY, Su ZZ, et al.Astrocyte Elevated Gene-1 contributes to the pathogenesis of neuroblastoma[J].Oncogene,2009,28:2476-2484.
[17] Emdad L, Lee SG, Su ZZ, et al.Astrocyte elevated gene-1(AEG-1) functions as an oncogene and regulates angiogenesis[J].Proc Natl Acad Sci USA,2009,106:21300-21305.
[18] Kikuno N,Shiina H,Urakami S,et al.Knockdown of astrocyte-elevated gene-1 inhibits prostate cancer progression through upregulation of FOXO3a activity[J].Oncogene,2007,26:7647-7655.
[19]Isozaki Y, Hoshino I, Akutsu Y, et al. Usefulness of microRNA-375 as a prognostic and therapeutic tool in esophageal squamous cell carcinoma[J].Int J Oncol,2014, [Epub ahead of print]
[20]Yoo BK,Chen D,Su ZZ,et al.Molecular mechanism of chemoresistance by astrocyte elevated gene-1[J]. Cancer Res,2010,70(8):3249-3258.
[21]Khuda I,Koide N,Noman ASM,et al.Astrocyte elevated gene-1 (AEG-1) is induced by lipopolysaccharide as toll-like receptor 4 (TLR4) ligand and regulates TLR4 signaling[J].Immunology, 2009, 128(1 Suppl):e700-706.
[22]Lee SG, Kim K, Timothy P.Oncogene AEG-1 promotes glioma-induced neurodegeneration by increasing glutamate excitotoxicity[J].Cancer Res, 2011,71(20):6514-6523.
[23] Emdada L,Leeb SG, Zhong Z.Astrocyte elevated gene-1 (AEG-1) functions as an oncogene and regulates angiogenesis[J]. PNAS, 2009, 106(50):21300-21305.
[24] Zhang J, Zhang Y, Liu S, et al.Metadherin confers chemoresistance of cervical cancer cells by inducing autophagy and activating ERK/NF-κB pathway[J].Tumour Biol,2013,34(4):2433-2440.
[25]Yoo BK, Emdad L, Su ZZ,et al.Astrocyte elevated gene-1 regulates hepatocellular carcinoma development and progression[J].J Clin Invest,2009,119:465-477.
[26]Jianbo X,Hui W,Yulong H,et al.Astrocyte-elevated gene-1 overexpression is associated with poor prognosis in gastric cancer[J]. Med Oncol, 2011,28(2):455-462.
[27]Hao JJ, Gong T, Zhang Y,et al.Characterization of gene rearrangements resulted from genomic structural aberrations in human esophageal squamous cell carcinoma KYSE150 cells[J]. Gene,2013,513(1):196-201.
[28]Hjortland GO, Meza-Zepeda LA, Beiske K,et al.Genome wide single cell analysis of chemotherapy resistant metastatic cells in a case of gastroesophageal adenocarcinoma[J]. BMC Cancer, 2011,20(11):455.
[29] Yu C,Chen K,Zheng H, et al.Overexpression of astrocyte elevated gene-1(AEG-1) is associated with esophageal squamous cell carcinoma (ESCC) progression and pathogenesis[J]. Carcinogenesis, 2009, 30:894-901.
[30] Wang YP, Liu IJ, Chiang CP, et al. Astrocyte elevated gene-1 is associated with metastasis in head and neck squamous cell carcinoma through p65 phosphorylation and upregulation of MMP1[J]. Mol Cancer,2013,12(1):109.
[31] Nohata N, Hanazawa T, Kikkawa N, et al. Tumor suppressive microRNA-375 regulates oncogene AEG-1/MTDH in head and neck squamous cell carcinoma (HNSCC)[J]. J Hum Genet, 2011, 56(8):595-601.
[32]Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer,2010, 127:2893-2917.
[33]Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[34]Li J, Zhang N, Song LB, et al. Astrocyte elevated gene-1 is a novel prognostic marker for breast cancer progression and overall patient survival[J].Clin Cancer Res,2008, 14:3319-3326.
[35]Tokunaga E,Nakashima Y,Yamashita N,et al.Overexpressionm of metadherin/MTDH is associated with an aggressive phenotype and a poor prognosis in invasive breast cancer[J].Breast Cancer, 2014,21(3):341-349.
[36]Su P, Zhang Q, Yang Q. Immunohistochemical analysis of Metadherin in proliferative and cancerous breast tissue[J]. Diagnost Pathol, 2010,5:38.
[37]Ke ZF, He S, Li S, et al. Expression characteristics of astrocyte elevated gene-1 (AEG-1) in tongue carcinoma and its correlation with poor prognosis[J]. Cancer Epidemiol, 2013 37(2):179-185.
[38]Deng N, Feng Y.Expression of EphA7 and MTDH and clinicopathological significance in the squamous cell cancer of the tongue[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2011,36(12):1195-1198.
[39]Yoo BK, Emdad L, Su ZZ, et al. Astrocyte elevated ene-1 regulates hepatocellular carcinoma development and progression[J]. J Clin Invest,2009, 119:465-477.
[40]Gong Z, Liu W, You N, et al. Prognostic significance of metadherin overexpression in hepatitis B virus-related hepatocellular carcinoma[J]. Oncol Rep, 2012,27:2073-2079.
[41]Zhu K, Dai Z, Pan Q, et al. Metadherin promotes hepatocellular carcinoma metastasis through induction of epithelial-mesenchymal transition[J]. Clin Cancer Res,2011, 17:7294-7302.
[42]Yao Y,Gu X,Liu H,et al.Metadherin regulates proliferation and metastasis via actin cytoskeletal remodelling in non-small cell lung cancer[J].Br J Cancer, 2014,111(2):355-364.
[43] Zhang X, Zhang N, Zhang MX. Astrocyte elevated gene-1 induces breast cancer proliferation and invasion through upregulating HER2/neu expression[J].Chin Med J (Engl), 2011,124(21):3546-3550.
[44] Zhang J, Zhang Y, Liu S, Zhang Q, et al.Metadherin confers chemoresistance of cervical cancer cells by inducing autophagy and activating ERK/NF-κB pathway[J].Tumour Biol, 2013,34(4):2433-2440.
[45] Yoo BK, Chen D, Su ZZ, et al. Molecular mechanism of chemoresistance by astrocyte elevated gene-1[J]. Cancer Res, 2010,70(8):3249-3258.
[46]Tang J, Shen L, Yang Q,et al.Overexpression of metadherin mediates metastasis of osteosarcoma by regulating epithelial-mesenchymal transition[J].Cell Prolif, 2014, 47(5):427-434.
[47]Yu C, Liu Y, Tan H,et al.Metadherin regulates metastasis of squamous cell carcinoma of the head and neck via AKT signalling pathway-mediated epithelial-mesenchymal transition[J]. Cancer Lett, 2014 ,343(2):258-267.
[48]Gao J,Liu QG.The role of miR-26 in tumors and normal tissues (Review)[J].Oncol Lett,2011,2: 1019-1023.
[49]Zhao S, Ye X, Xiao L,et al.MiR-26a inhibits prostate cancer progression by repression of Wnt5a[J].Tumour Biol, 2014,35(10):9725-9733.
[50]Zhou H, Guo W, Zhao Y .MicroRNA-26a acts as a tumor suppressor inhibiting gallbladder cancer cell proliferation by directly targeting HMGA2[J]. Int J Oncol, 2014,44(6):2050-2058.
[51] Song QC,Shi ZB,Zhang YT,et al.Downregulation of microRNA-26a is associated with metastatic potential and the poor prognosis of osteosarcoma patients[J].Oncol Rep, 2014,31(3):1263-1270.
[52]Jia LF, Wei SB, Gan YH,et al. Expression, regulation and roles of miR-26a and MEG3 in tongue squamous cell carcinoma[J].Int J Cancer, 2014,135(10):2282-2293.
[53] Shen W, Song M, Liu J,et al. MiR-26a promotes ovarian cancer proliferation and tumorigenesis[J].PLoS One, 2014,9(1):e86871.
[54]Qian X,Zhao P,Li W,et al.MicroRNA-26a promotes tumor growth and angiogenesis in glioma by directly targeting prohibitin[J].CNS Neurosci Ther, 2013,19(10):804-812.
[55]Zhang B, Liu XX, He JR, et al. Pathologically decreased miR-26a antagonizes apoptosis and facilitates carcinogenesis by targeting MTDH and EZH2 in breast cancer[J].Carcinogenesis,2011,32(1):2-9.
[56]Gao J,Li L,Wu M,et al.MiR-26a inhibits proliferation and migration of breast cancer through repression of MCL-1[J].PLoS One, 2013,8(6):e65138.
[57]Yu L,Lu J,Zhang B,et al.miR-26a inhibits invasion and metastasis of nasopharyngeal cancer by targeting EZH2[J].Oncol Lett,2013 ,5(4):1223-1228.
[58]Dang X, Ma A, Yang L,et al. MicroRNA-26a regulates tumorigenic properties of EZH2 in human lung carcinoma cells[J].Cancer Genet, 2012,205(3):113-123.
[收稿日期:2014-09-10]
(本文編輯張巧蓮)
基金項(xiàng)目:新疆醫(yī)科大學(xué)創(chuàng)新基金(XJC201228)
作者簡(jiǎn)介:李莉(1978- ),女,副教授,研究方向:醫(yī)學(xué)圖像處理及分析,從事大學(xué)生教育管理。
通信作者:爾西丁·買(mǎi)買(mǎi)提,男,教授,碩士生導(dǎo)師,研究方向:衛(wèi)生統(tǒng)計(jì)學(xué)理論和方法研究,E-mail: 624799002@qq.com。
·醫(yī)學(xué)教育·

