體外兩種方式培養的腸神經干細胞生物學特性比較
劉淼清,王永飚,黃曉忠,朱利斌,陳肖鳴,李仲榮
(溫州醫科大學附屬第二醫院育英兒童醫院 小兒外科,浙江 溫州 325027)
·論 著·
體外兩種方式培養的腸神經干細胞生物學特性比較
劉淼清,王永飚,黃曉忠,朱利斌,陳肖鳴,李仲榮
(溫州醫科大學附屬第二醫院育英兒童醫院 小兒外科,浙江 溫州 325027)
目的:對纖維連接蛋白(FN)包被和未包被兩種方式培養的腸神經干細胞進行生物學特性比較,探索腸神經干細胞體外擴增合適的培養方式。方法:從孕15 d SD胎鼠腸管分離出腸神經干細胞,用FN包被和不包被兩種方式原代培養第5天的神經球,通過形態學、免疫熒光細胞化學及流式細胞儀檢測對其生長狀態、增殖及分化能力進行比較。結果:與包被組相比,未包被組的原代培養第5天的神經球呈半貼壁生長,球體形態較規則,球體中央開始變黑,神經球周邊未形成大量放射狀的神經絲;熒光鏡下發現2組原代神經球的Nestin、BrdU都顯陽性;包被組的球體周圍放射狀神經絲Tuj-1顯陽性。流式細胞儀檢測結果顯示,與包被組的(12.67±2.16)%相比,未包被組的Nestin陽性細胞百分比顯著增高,為(20.69±2.15)%(P<0.05);與包被組的(12.69±1.13)%相比,未包被組的BrdU標記的增殖細胞百分比顯著增加,為(35.82±2.11)%(P<0.05);與包被組的(21.77±2.53)%相比,未包被組的Tuj-1陽性細胞百分比顯著減少,為(10.67±1.14)%(P<0.05)。結論:未包被FN的體外培養加快了形成神經球的時間,且形態較規則,能較好地維持干細胞自我增殖,減少分化,適宜作為腸神經干細胞體外增殖培養方式。
腸神經干細胞;增殖;培養;纖維連接蛋白
位于腸道的腸神經系統(enteric neural system,ENS)是獨立于交感、副交感神經的外周自主神經系統。國外研究[1]發現腸道也存在神經干細胞,即腸神經干細胞(enteric neural stem cells,ENSCs)。在國內,本課題組率先成功提取、培養ENSCs[2]。ENSCs與中樞神經干細胞生物學特性相比,可能存在對腸管的特異性,易與ENS結合、重建,提高移植干細胞的成活率和移植成功率。因而熟悉、掌握適宜的體外培養ENSCs的方法,對以后ENSCs的生物學特性研究、為移植治療提供大量和穩定的干細胞來源有重要意義。
1 材料和方法
1.1 實驗動物 孕15 d(E15)清潔級SD大鼠,體質量不拘,由中國科學院上海實驗動物中心提供,動物質量合格證編號:SCXK(滬)2007-0005。本實驗設計符合動物保護條例并經過溫州醫科大學動物保護委員會批準。
1.2 試劑與儀器 主要試劑:纖維連接蛋白(fibronectin,FN,Chemicom),DMEM/F12培養基(Gibco),2-巰基乙醇(2-Mercaptoethanol,Gibco),Retinoicacid(Sigma),重組人堿性成纖維細胞生長因子(human recombinant bFGF,Sigma),N2/B27-supplement(Gibco),表皮生長因子(EGF,Sigma),5-溴脫氧尿嘧啶核苷(BrdU,Sigma);一抗:小鼠抗大鼠BrdU(CST),小鼠抗大鼠Tuj-1(Abcam),小鼠抗大鼠Nestin(BD);二抗:DyLight488標記山羊抗小鼠IgG(KPL)。
主要儀器:倒置相差顯微鏡(Nikon),熒光顯微鏡(Olympus),流式細胞儀(BD)。
1.3 實驗方法及分組 參照朱利斌等[2-3]建立的大鼠ENSCs分離、培養、純化及鑒定方法并適當改良,且培養液中未添加雞胚浸出液(CEE)。方法簡述如下:孕鼠頸椎脫臼處死,解剖獲得腸管,剪切、消化、過濾、離心后棄去上清,用ENSCs培養基重懸細胞,錐蟲藍染色計數,以1.0×106個/mL接種到預先用FN包被或未包被的25 mL培養瓶中,于37 ℃、5% CO2飽和濕度培養箱中培養,第24小時半量換液,以后每隔2 d半量,約每5~6 d傳代1次,反復傳代。
1.4 檢測指標 選取培養5 d的ENSCs作為研究對象(依據第5天的ENSCs形成的神經球中央開始變黑且需行傳代培養,此時細胞處于對數生長期轉向平臺期的特點而選取)。2組細胞進行形態學動態觀察,免疫學觀察和流式細胞儀檢測,包括Tuj-1陽性細胞、BrdU標記的增殖細胞、Nestin陽性細胞百分比。
1.5 統計學處理方法 應用統計學軟件SPSS 16.0進行統計學分析。陽性細胞百分比以表示,應用配對t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 形態學及免疫學觀察 FN包被組:原代培養第5天ENSCs腸神經球幾乎是貼壁的、不規則的集落,直徑為100 nm左右,有部分細胞遷出,集落周圍出現極長的突觸狀連接(見圖1),經免疫學鑒定發現集落周圍放射絲狀物Tuj-1顯陽性,提示為神經元軸突(見圖3)。腸神經球Nestin顯陽性(類似圖4),腸神經球BrdU顯陽性。
未包被組:原代培養第5天單細胞形成典型長神經球,部分懸浮,部分呈半貼壁,背景較干凈,神經球間并未出現極長的神經絲,直徑幾乎接近200 nm,球體開始變黑,適宜傳代(見圖2)。腸神經球中的細胞Nestin陽性(見圖4),腸神經球BrdU陽性。
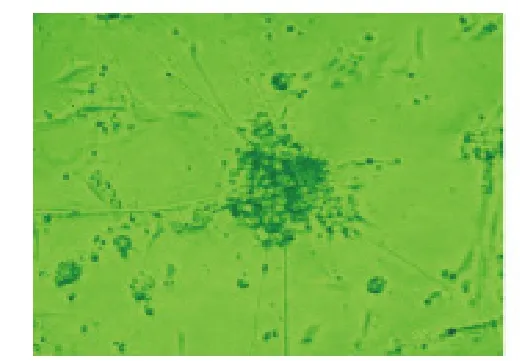
圖1 包被組培養第5天ENSCs腸神經球貼壁,不規則,周圍出現極長的突觸狀連接(×200)
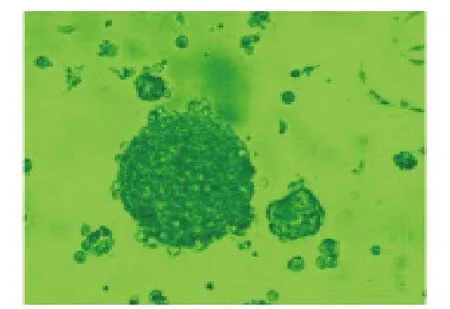
圖2 未包被組第5天ENSCs腸神經球,規則,半懸浮生長,直徑幾乎接近200 nm(×200)
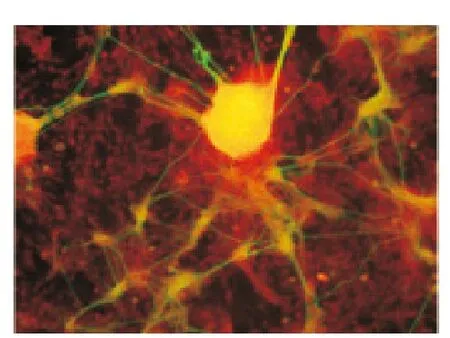
圖3 包被組ENSCs腸神經球周圍放射絲狀物Tuj-1顯陽性
2.2 流式細胞儀檢測2組陽性細胞百分比 見圖5。與包被組相比,未包被組的Nestin陽性細胞百分比顯著增加,BrdU標記的增殖細胞百分比顯著增加,Tuj-1陽性細胞百分比顯著減少(均P<0.05),見表1。
3 討論
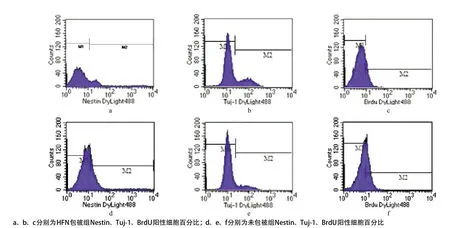
圖5 流式細胞儀檢測結果
表1 2組Nestin、Tuj-1、BrdU陽性細胞百分比比較(,%)

表1 2組Nestin、Tuj-1、BrdU陽性細胞百分比比較(,%)
與包被組比:aP<0.05
組別NestinTuj-1BrdU未包被組20.69±2.15a10.67±1.14a35.82±2.11a包被組12.67±2.16a21.77±2.53a12.69±1.13a
腸神經元發育缺陷性疾病是小兒外科臨床相當常見的一類疾病,可以是局限性,也可以為彌漫性,包括先天性巨結腸、腸神經元發育異常癥等[4]。近年來國內外研究者成功地在胚胎、出生后甚至成年鼠及人的腸道提取、培養出ENSCs[5]。本研究提取同一來源ENSCs,分成用FN包被及未包被2組進行連續培養,對2組ENSCs生物學特性進行全面比較,尋找適宜的培養方式,以易于ENSCs進行大量體外擴增,便于ENSCs移植治療腸神經元發育缺陷性疾病。
形態學觀察發現2組細胞存在共同特點:都能從單細胞自我增殖形成ENSCs克隆集合體(即腸神經球)。但2組從形態學及免疫學方面存在較多不同之處:①相對于包被組,未包被組ENSCs黏附能力較差,但仍能呈半貼壁狀態。國內許漢鵬等[6]研究發現,腦神經干細胞也存在類似現象,并了解到神經前體細胞在增殖和分化過程中,會表達和分泌多細胞間黏附分子。結合本實驗室以往研究[7]發現,來源同體SD胚鼠腦神經干細胞與ENSCs的生物學特性存在類似性,推測ENSCs也可能存在易表達的黏附因子并分泌黏附蛋白,從而使ENSCs具有黏附性,而半貼壁于瓶底。②未包被組原代培養第5天鏡下背景干凈,克隆球規則,球體直徑較大。神經球是單克隆神經干細胞及其各方向不同分化階段后代細胞的集合,神經球大小反應增殖能力大小[8],說明包被組增殖能力弱于未包被組。③國外Bondurand等[1]提取E11.5胚鼠消化道神經干細胞并用FN包被培養,培養第10天才能形成典型腸神經球,國內肖莉等[9]研究顯示胎齡越小,提取的ENSCs增殖能力越強,E11.5增殖能力強于E15增殖能力。然而本研究E15 ENSCs培養第5天就能形成典型神經球,反而E11.5 ENSCs增殖能力弱于E15,說明包被組中FN具有抑制ENSCs增殖的功能。④相對于未包被組,包被組克隆集合體周圍可見大量神經絲出現,經免疫學鑒定為神經元特異性β III微管蛋白,此微管蛋白作為分化早期的神經元標記[7],說明包被組FN促進ENSCs分化為神經元等子代細胞。
流式細胞儀檢測發現,未包被組ENSCs表達Nestin及BrdU標記的增殖細胞含量顯著高于包被組,但BrdU陽性細胞變化幅度明顯高于Nestin陽性細胞變化幅度。Nestin是神經干細胞表達的一種中間絲狀蛋白-神經巢蛋白,目前被公認為神經干細胞的特征性的生物學標記[7]。Micci等[10]認為神經干細胞表達陽性,而祖細胞表達陰性,說明Nestin間接反映ENSCs的含量。而BrdU是一種只能在細胞分裂增殖期摻入到細胞DNA中的化合物[11],因此是反映細胞增殖情況的最佳指標。神經球是單克隆ENSCs及其各方向不同分化階段后代細胞的集合[8],提示BrdU合成量間接反映ENSCs及定向分化的祖細胞的增殖分裂能力。相對于Nestin蛋白而言,BrdU指標檢測包括了部分定向增殖分化的祖細胞,所以比例幅度相對高于Nestin。本研究同時發現未包被組Tuj-1陽性細胞百分比顯著低于包被組,說明與未包被組比,包被組ENSCs增殖能力下降,易分化為神經元等子代細胞。
本研究證實FN具有抑制ENSCs增殖、誘導ENSCs分化的功能。這一結果一方面說明無任何底物添加,更能維持ENSCs增殖,減少其分化;另一方面說明這些底物(如FN等)猶如細胞外基質,有助于了解腸道微環境變化對腸神經系統形成的影響;再者,研究體外藥物干預對ENSCs增殖分化影響時,往往忽略貼壁底物本身會對ENSCs分化起重要作用,從而對研究結果判定產生偏差。
[1] Bondurand N, Natarajan D, Thapar N, et al. Neuron and glia generating progenitors of the mammalian enteric nervous system isolated from foetal and postnatal gut cultures[J]. Development, 2003, 130(25): 6387-6400.
[2] 朱利斌, 劉征吉, 李仲榮, 等. 大鼠腸神經干細胞分離和體外培養的初步研究[J]. 溫州醫學院學報, 2007, 37(1): 5-8.
[3] 朱利斌, 劉征吉, 王愛和, 等. 大鼠腸神經干細胞體外培養和鑒定[J]. 中華實驗外科雜志, 2007, 24(1): 122.
[4] De Giorgio R, Camilleri M. Human enteric neuropathies: morphology and molecular pathology[J]. Neurogastroenterol Motil, 2004, 16(5): 515-531.
[5] Metzger M, Bareiss PM, Danker T, et al. Expansion and differentiation of neural progenitors derived from the human adult enteric nervous system[J]. Gastroenterology, 2009, 137(6): 2063-2073.
[6] 許漢鵬, 茍琳, 楊浩, 等. 中樞神經系統不同部位來源的神經干細胞在體外生長特性的比較[J]. 解剖學報, 2004, 35 (4): 358-362.
[7] 王永飚, 朱利斌, 劉征吉, 等. 腸與腦來源神經干細胞的增殖和分化特性比較[J]. 醫學研究雜志, 2011, 40(3): 71-74.
[8] Mokry J, Subrtova D, Nemecek S. Differentiation of epidermal growth factor-responsive neural precursor cells within neurospheres[J]. Acta Medica (Hradec Kralove), 1996, 39(1): 7-20.
[9] 肖莉, 高亞, 劉勇. 比較胚胎和新生小鼠腸神經嵴干細胞體外增殖分化的實驗研究[J]. 中華小兒外科雜志, 2007, 28(2): 73-77.
[10] Micci MA, Pasricha PJ. Neural stem cells for the treatment of disorders of the enteric nervous system: strategies and challenges[J]. Dev Dyn, 2007, 236(1): 33-43.
[11] Nakamura S, Takeda Y, Kanno M, et al. Application of bromodeoxyuridine (BrdU) and anti-BrdU monoclonal antibody for the in vivo analysis of proliferative characteristics of human leukemia cells in bone marrows[J]. Oncology, 1991, 48(4): 285-289.
(本文編輯:丁敏嬌)
Comparison of biological properties of enteric neural stem cells in two ways of culturing in vitro
LIU Miaoqing, WANG Yongbiao, HUANG Xiaozhong, ZHU Libin, CHEN Xiaoming, LI Zhongrong. Department of Pediatric Surgery, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To find a suitable proliferation way of culturing enteric neural stem cells in vitro, and to compare the biological characteristics of stem cells which were cultured in dishes coated and uncoated with fibronectin (FN). Methods: Enteric neural stem cells were isloated from gut of 15 days rat embryos, the neurospheres of fifth days were extracted from two groups. Growth status, proliferation and differentiation capacity of cells were compared through morphological observation, immunofluorescence cytochemistry and flow cytometer analysis between the two groups. Results: Compared with the FN coated group, the neurospheres of fifth days were the state of semi-adherent growth, the neurospheral morphology was regular, and were beginning to get dark in the center of them, and the spheres did not form a large amount of nerve fiber. Under fluorescence microscope, the typical neurospheres which were shown positive to BrdU in two groups were found. Radial nerve fiber of the neurospheres were positive to Tuj-1 (neuronal axons). After culturing for 5 days, compared with treatment with FN group (12.67±2.16)%, flow cytometer analysis showed positive to Nestin of the FN uncoated group had inacresed significantly (20.69±2.15)% (P<0.05); BrdU which mark proliferative cell increased significantly (35.82±2.11)% vs FN group (12.69±1.13)% (P<0.05); The percentage of Tuj-1 positive to neuron decreased significantly (10.67±1.14)% vs FN group (21.77±2.53)% (P<0.05). Conclusion: The way of uncoating culture reduces the time of forming neurospheres which were regular shape; maintains stem cell self-proliferation, reduce enteric neural stem cell differentiation and is suitable for stem cell self-proliferation in vitro.
enteric neural stem cells; proliferation; culture; fibronectin
R726.1
A
10.3969/j.issn.2095-9400.2015.08.005
2014-09-16
浙江省自然科學基金資助項目(Y207272);浙江省醫藥衛生平臺重點資助項目(2012ZDA038)。
劉淼清(1984-),男,江西湖口人,住院醫師,碩士。
李仲榮,主任醫師,教授,博士生導師,Email:wmc lzr@163.com。

