花生熱激蛋白AhHSP70與熱激因子AhHSF基因的克隆及表達分析
李翠+侯蕾+任麗+張燁+鄭奕雄+王興軍
摘要:熱激蛋白(heat shock proteins,HSPs)和熱激轉錄因子(heat shock factors.HSFs)在植物熱脅迫信號轉導和耐熱性的產生過程中發揮了重要作用。本研究從花生轉錄組文庫中篩選到HSP70、HSF的eDNA片段,通過序列比對在花生全基因組序列中獲得這兩個基因的基因組序列,根據序列信息設計引物,以花生葉片eDNA為模板擴增全長ORF并進行生物信息學分析結果顯示,AhHSP70基因的ORF全為1 962 bp,編碼653個氨基酸,分子質量為72.45 kD,理論等電點pl為4.93;AhHSF基因的ORF全長為1 212 bp,編碼403個氨基酸,分子質量為46.03 kD,理論等電點pl為4.85。AhHSP70與AhHSF均不具有信號肽,為可溶性蛋白,二級結構中有大量無規則卷曲。利用這兩個基因的氨基酸序列分別與來源于其他物種HSP70、HSF的氨基酸序列進行同源比對,并構建進化樹進行親緣關系分析,結果表明,AhHSP70與大豆GmHSP70親緣關系較近,與番茄SlHSP70親緣關系比較遠;AhHSF與菜豆PaHSF親緣關系較近,而與蒺藜苜蓿MtHSF的親緣關系較遠。利用實時熒光定量PCR對AhHSP70和AhHSF在熱脅迫情況下的表達進行分析,結果表明這兩個基因在42℃高溫條件下表達量顯著升高,AhHSP70在高溫脅迫3 h后表達明顯升高,熱處理24 h和48 h后,表達量為對照的 50倍和135倍;轉錄因子AhHSP在高溫脅迫3 h后表達明顯升高,高溫處理6 h后達到最高,隨后下降。本研究初步驗證了花生熱激蛋白和熱激因子基因在花生響應高溫脅迫中的作用。
關鍵詞:花生;熱激蛋白;熱激因子;基因克隆;序列分析;基因表達
中圖分類號:S565.203.2 文獻標識號:A 文章編號:1001-4942(2015)04-0001-07
收稿日期:2015-01-30
基金項目:國家自然科學基金項目(21376281);國家“863”計劃項目(2013AA102602);山東省生物資源創新項目;濟南市科技創新項目(20l102033);山東省自主創新成果轉化專項(2012ZHZXIA0418)
熱激蛋白(heat shock proteins,HSPs)是一類進化保守的多肽,在機體受到高低溫、干旱、鹽漬、缺氧、機械損傷等多種環境脅迫時誘導合成[1],其中高溫足誘導HSPs合成的主要因素[2],故又稱應激蛋白或熱休克蛋白。HSPs作為一種分子伴侶,能夠及時將受熱損傷的蛋白聚集,協助其肽鏈的折疊,促使其復性從而恢復體內正常蛋白的功能[3]。張建國等[4]研究發現,HSPs的積累水平與生物的耐熱性呈顯著正相關。熱激因子(heat shock factors,HSFs)是生物體內調節熱激應答的一類轉錄因子,主要存在于細胞核內,能激活或抑制基因的轉錄,在植物熱脅迫信號轉導和耐熱性的產生過程中發揮了重要的作用[5]。
HSPs作為一類逆境脅迫蛋白,可以被多種逆境所誘導,并能夠減輕脅迫引起的傷害,Lurie等[6]還發現HSPs蛋白具有交叉保護的功能。Tissieres等[7]首次在黑腹果蠅中發現熱激蛋白HSPs,隨后發現動物、植物、微生物都能合成HSPs。在生物體內熱激蛋白有多種形式,例如泛索(ubiquitin)是一類組成型表達的熱激蛋白,蛋白質二硫鍵異構酶(protein disulphide - isomerase,PID))也被認為是一種熱激蛋白[8]。根據分子量大小的不同,可將HSPs分為5個家族,即HSP110、HSP90、HSP70、HSP60和小分子HSP[9]。其中HSP90具有調節作用,可作用于激素受體,保證受體呈無活性狀態[10]。HSP70是HSPs家族中最為保守也是最重要的一類蛋白[11],是目前研究最深入的一類蛋白,在依賴ATP的蛋白質折疊和裝配中起作用。HSP70結構包括N端ATPase結合區以及C端多肽結合區,N端序列高度保守,具有結合并水解ATP的活性[12,13]。HSP60最早被稱為分子伴侶,線粒體HSP60主要參與了核編碼的線粒體蛋白質的加工、定位和裝配,小分子HSP在熱激及其恢復時,在細胞質、細胞核以及細胞器之間運動,保護細胞免受高溫傷害,修補被損傷的蛋白。小分子熱激蛋白N端序列在不同物種中差異較大,C端則高度保守[14]。植物熱激蛋白可以在不同的器官中被誘導,可在根、莖、葉、種子以及幼苗中產生,也可在體外單個細胞中產生,此外,它們也可定位于不同的細胞器中。
典型的熱激轉錄因子結構包括N端的DNA結合域(DBD)、寡聚化結構域(OD)、核定位信號(NLS)、核輸出信號(NES)和C端轉錄激活結構域。植物熱激轉錄因子可通過形成回文發卡結構,特異結合熱激蛋白基因啟動子中高度保守的熱激元件,控制熱激蛋白基因的表達[4]。如熱脅迫條件下,擬南芥中的HSF可調節HSP110、HSP70和小分子HSP的表達[15]。根據表達特性不同,熱激轉錄因子可分為組成型和誘導型兩種,一般參與脅迫應答的主要是誘導型熱激轉錄因子。最早的熱激轉錄因子是在酵母中被克隆得到的,隨后在果蠅和哺乳動物中發現并克隆[17]。在植物中,道德是在番茄中克隆[18],目前在擬南芥、水稻、玉米、大豆等植物中均開始了對該基因家族的研究[16,19,20]。
本試驗從花生葉片中克隆了AhHSP70和AhHSF的全長編碼序列,分別對其進行生物信息學分析,并利用實時定量PCR技術在mRNA水平檢測了高溫脅迫對花生AhHSP70和AhHSF表達的影響,了解熱激蛋白在花生抗逆脅迫中的作用,為探討花生響應高溫的分子機理、選育耐高溫的花生新品種奠定基礎。
1 材料與方法
1.1 材料與試劑
供試材料為花生耐旱品種仲愷花1號,由仲愷農業工程學院種子科學與工程研究所提供。大腸桿菌(Escherichia coli)菌種DH5α為山東省農業科學院生物技術研究中心保存。瓊脂糖凝膠DNA回收試劑盒購自天根生化科技有限公司;T4 DNA連接酶、Tap DNA聚合酶購自Fermentas公司;pMD18-T載體、反轉錄試劑盒、DNA酶、實時熒光定量PCR試劑盒FastStart Universal SYBR Green Master(Rox)購自羅氏試劑公司,LA Taq DNA聚合酶購自寶生物工程(大連)有限公司。PCR引物合成由上海生工生物工程股份有限公司完成。endprint
1.2 試驗方法
1.2.1 42℃高溫處理 將仲愷花1號在溫室中培養,待其幼苗長出2周左右,選取18株長勢基本一致的花生幼苗,每3株作為一個重復,進行42℃持續高溫處理,分別于處理0、3、6、12、24、48 h對葉片進行取樣,迅速置于液氮并于-80℃保存備用。
1.2.2 總RNA的提取與eDNA的合成 高溫處理不同時間的花生葉片總RNA的提取采用CTAB-LiCl法,用CTAB提取液裂解研磨好的植物組織,氯仿/飽和酚抽提,去除蛋白質等雜質,LiCl、無水乙醇沉淀RNA,隨后進行DNA消化,獲得總RNA。用紫外可見分光光度計測定RNA的濃度,上樣2 μg瓊脂糖凝膠電泳檢測所提取的RNA,在Alpha Imager PE型凝膠成像系統上觀察拍照。按照TaKaRa反轉錄試劑盒(PrimeScriptTM Ⅱ 1st Strand eDNA Synthesis Kit)說明進行反轉錄獲得eDNA。
1.2.3 AhHSP70和AhHSF基因eDNA全長序列的克隆 從花生轉錄組序列中篩選到HSP70和HSF基因的eDNA片段,通過同源查找花生全基因組序列(未發表數據)獲得兩個基因的基因組序列,根據基因組序列中預測的編碼區設計引物,以花生葉片eDNA為模板克隆兩個基因的ORF全長,分別命名為AhHSP70和AhHSF。
PCR擴增基因全長的反應體系(50 μl):1 μL的eDNA模板,5 U/μL Pfu高保真DNA聚合酶0.5 μL,5×Buffer 5 μl,2.5 mmol/L dNTP 4 μL,正反向引物各2 μL以及ddH2O 35.5μL。
PCR反應程序:94℃預變性3 min;94℃變性30 s,56℃退火30 s,72℃延伸2 min,35個循環;72℃延伸10 min,保存溫度為4℃。
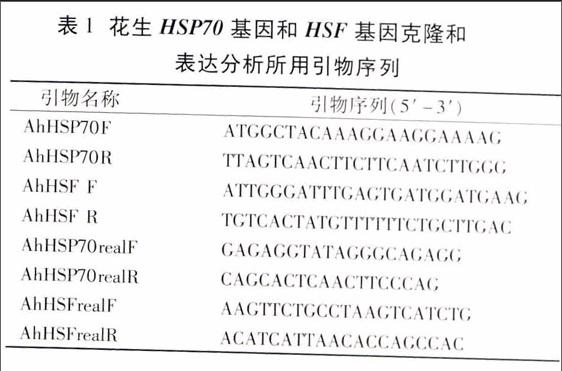
反應結束后進行1%瓊脂糖凝膠電泳,目的片段回收純化后平末端加A,加A產物與pMD18-T載體連接,轉入DH5α大腸桿菌感受態細胞,后經菌液PCR檢測,挑取含有目的片段的菌液在山東省農業科學院生物技術中心測序中心進行測序,得到HSP70和HSF的ORF序列。所使用的引物序列見表1。
1.2.4 AhHSP70和AhHSF序列的生物信息學分析 利用DNAStar軟件將測得的序列翻譯成氨基酸序列,用DNAMAN軟件分析其氨基酸序列的二級結構、親水性/疏水性以及跨膜結構;用MEGA5.0軟件分別對其氨基酸構建進化樹,進行進化分析;在線軟件Protparatam工具(http://web.expasy.org/protparam/)分析其理化性質;在線工具PSORT(http://psort.nibb.ae.jp/form.html)預測其亞細胞定位;Signal P 3.0在線軟件預測其信號肽;SMART和InterPro在線軟件對蛋白質結構域進行分析預測.
1.2.5 AhHSP70和AhHSF基因的表達分析 利用qRT-PCR分析花生經過高溫處理O、3、6、l2、24、48 h后基因的表達。以組成型表達的花生Actin基因作為內參,實時定量PCR引物為AhHSP70realF、AhHSP70realR和AhHSFrealF、AhHSFrealR(表1)。采用FastStart Universal SYBR Green Master(Rox)按說明書進行操作。用ABI PRISM 7900HT實時定量PCR儀進行反應,反應程序為:95℃預變性10 s;95℃ 15 s,60℃ 1 min,40個循環;溶解曲線分析:95℃ 15 s,60℃ 1 min,95℃ 30 s,60℃ 15 s。重復試驗3次。根據溶解曲線檢測PCR產物的特異性。基因表達差異通過2-△△CT方法計算。
2 結果與分析
2.1 AhHSP70和AhHSF基因克隆及進化樹分析
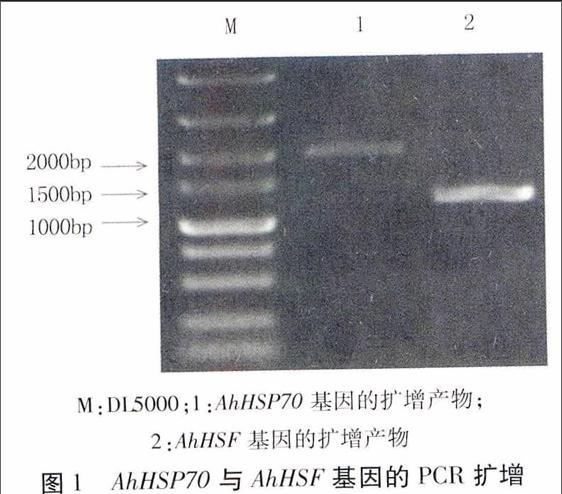
以花生葉片eDNA為模板擴增AhHSP70和AhHSF開放讀碼框,擴增產物經1%瓊脂糖凝膠電泳分析。由圖可見,擴增條帶的長度分別為2 000 bp和1 500 bp左右。同收目的片段末端加A后與pMD18-T載體連接,轉化大腸桿菌DH5α,選取陽性菌落進行測序,經正反向拼接,AhHSP70基因的全長ORF為1 962 bp,編碼含653個氨基酸的肽鏈;AhHSF基因的全長ORF為1 212 bp,編碼含403個氨基酸的肽鏈。
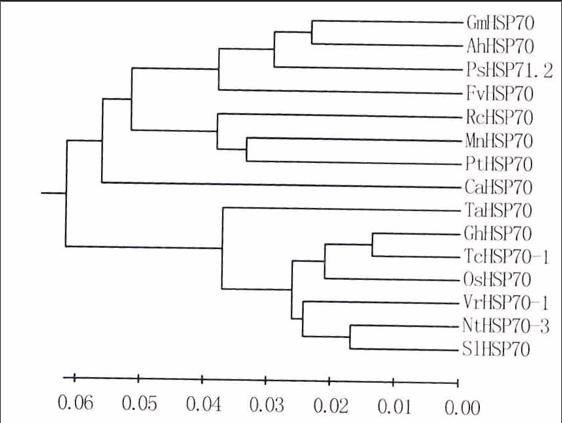
從GenBank獲得大豆、水稻、豌豆等植物的熱激蛋白HSP70和HSF序列,利用DNAMAN軟件分別對不同植物來源的HSP70和HSF進行同源性分析,并利用MEGA5.0軟件構建進化樹(圖2a、b)。結果表明,AhHSP70與大豆和豌豆的HSP70親緣關系較近,處于同—分支,而與小麥、棉花、番茄等的HSP70親緣關系較遠;AhHSF與菜豆和紫苜蓿的HSF親緣關系比較近,而與蒺藜苜蓿和大豆等的HSF親緣關系較遠
2.2 AhHSP70和AhHSF蛋白的理化性質、細胞定位分析
使用Protparatam在線工具分析AhHSP70和AhHSF蛋白的理化性質,結果顯示AhHSP70蛋白的分子質量為71.45 kD,理論等電點pI為4.93。在氨基酸構成中,相對含量較多的是Ala、Glu、Gly和Lys,分別占9.2%、8.6%、8.90%和8.3%。總的帶負電荷的殘基(Asp+Glu)有102個,帶正電荷的殘基(Arg+Lys)有86個。AhHSF分子質量為46.03 kD,理論等電點pI為4.85。在氨基酸構成中,含量較多的是Ser、Glu、Leu和Asp,分別占12.2%、9.7%、7.7%和6.7%。總的帶負電荷的殘基(Asp+Glu)有66個,帶正電倚的殘基(Arg+Lys)有40個。
通過DNAMAN軟件分別對AhHSP70、AhHSF兩個蛋白序列疏水性/親水性以及它們的跨膜結構域進行預測和分析,結果表明,AhHSP70與AhHSF肽鏈中親水氨基酸分布都比較均勻,并且數量大于疏水氨基酸(圖3),且兩者均不含跨膜結構域。可以推斷AhHSP70和AhHSF均為可溶性蛋白。endprint
亞細胞定位預測結果顯示,AhHSP70和AhHSF蛋白在細胞核定位的概率均可達0.76,因此,推測AhHSP70和AhHSF定位于細胞核的可能性比較大。運用Signal P 3.0在線軟件對AhHSP70和AhHSF蛋白序列信號肽進行預測分析,結果顯示這兩個蛋白均無信號肽。
2.3 AhHSP70和AhHSF二級結構和蛋白結構域的預測及分析
用DNAMAN軟件對花生AhHSP70和AhHSF蛋白序列的二級結構進行預測 結果顯示,AhHSP70和AhHSF蛋白序列中,均有α-螺旋、無則卷曲、β-折疊三種二級結構,其中無規則卷曲是AhHSP70和AhHSF蛋白中最大量的二級結構,α-螺旋和β-折疊分布于整個蛋白質分子中。通過SMART和InterPro工具在線軟件預測分析表明,AhHSP70蛋白C端391~548 aa處為底物結合位點區域.637~646 aa處是一段低復雜性區段(Lowe-complexity region,LCR)。AhHSF蛋白質結構中,N端10~103 aa處具有典型的DBD結構域,內部存在一個螺旋-轉角-螺旋的疏水結構,該疏水結構可以精確定位并識別啟動子區熱激元件(HSE),在HSP基因轉錄時DBD區域可與HSE結合,從而調控熱激蛋白基因的表達[21]。C端有一段保守的的卷曲螺旋區域(coiled coil region)以及LCR。
2.4 AhHSP70和AhHSF基因的表達分析
實時熒光定量PCR分析結果表明,花生在42℃高溫脅迫條件下,AhHSP70和AhHSF兩個基因表達量均顯著增加。基中AhHSP70高溫處理3 h時表達量開始升高,24 h時表達量大幅度升高,48 h后仍繼續升高,表達量達到處理前的135倍,說明AhHSP70在高溫脅迫下表達顯著升高,響應熱脅迫長時間誘導。AhHSF在高溫脅迫3 h表達顯著升高,在高溫脅迫6 h表達量達到最高,為處理前的624倍,隨后下降,但到48 h表達量仍高達處理前的23倍(圖4)。
3 討論
植物在生長發育過程中會受到各種逆境脅迫的影響,體內會產生一系列復雜的防御機制來進行自我保護,如在高溫等脅迫條件下,生物體內熱激蛋白合成發生變化,降低生物體在脅迫中受到的傷害,是一種有效的防御措施。目前已有很多植物的熱激蛋白和熱激轉錄因子基因被克隆,并研究了它們在植物抵御逆境脅迫中的作用。
本研究利用花生轉錄組和全基因組序列結果,從花生葉片中克隆獲得AhHSP70和AhHSF的完整ORF,通過氨基酸序列同源性比對分析表明,AhHSP70與豆科植物大豆GmHSP70親緣關系較近,AhHSF與豆科植物菜豆PaHSF序列相似性較高。亞細胞定位分析顯示高溫處理情況下AhHSP70和AhHSF主要定位于細胞核中,推測熱激蛋白AjHSP70可能參與核內蛋白質的轉運、折疊及解折疊的作用,而熱脅迫條件下熱激轉錄因子AhHSF進入細胞核從而調控下游基因表達對AhHSP70和AhHSF蛋白結構域的預測分析表明,AhHSP70 C端具有底物結合位點,可能參與蛋白質的折疊、轉運、跨膜運輸以及蛋白質降解調控等過程,與行使分子伴侶的功能有關;AhHSF蛋白結構的N端具有DNA結合區域,與調控下游基因的轉錄有關。
HSPs作為一種分子伴侶型的應激蛋白,能夠對外界環境刺激做出應答反應,減少高溫對生物體的傷害,有效地提高生物體對惡劣環境的適應能力[22,23]。此外,HSPs能夠提高細胞的應激能力,具有保護細胞或機體免受損傷的作用。近年來的研究表明,除高溫之外,其他環境脅迫如干旱、低溫等也會誘導HSPs的產生。另外,正常情況下生物體內也會有HSPs的存在。本研究利用qRT-PCR對AhHSP70和AhHSF基因的表達分析顯示,在受到42℃熱脅迫條件下花生葉片中AhHSP70在3 h表達量開始升高,24 h以后表達量持續大幅度升高。大豆中的研究結果顯示,熱處理3~5 min就可以檢測到大豆幼苗中熱激蛋白mRNA的積累,l~2 h達到高峰,6 h后mRNA水平顯著下降,12 h表達量幾乎為零[24]。擬南芥中對HSP70家族多個基因表達分析的結果顯示,除了mtHsc70-1(屬于擬南芥中線粒體HSP70家族)和cpHsc70-1(屬于擬南芥中葉綠體HSP70家族)兩個基因,其他基因在40℃熱處理后表達上調,多數基因在處理30 min表達量就上升到最大,之后緩慢下降,如HSP70-2基因,少數基因在60 min時表達量最高,之后下降,如HSP70基因[25]。玉米中也有類似的情況.熱激蛋白的誘導合成只持續4 h,隨后下降。而本試驗中,AhHSP70在高溫處理48 h仍持續高表達,且受誘導時間周期延長。因此,熱激蛋白在不同植物體內的表達模式有所差異,花生中AhHSP70可能在持續高溫下對調控植物的生長起到重要作用。對熱激因子的表達在植物中也有研究,其響應熱激脅迫的周期普遍較短。陳先知等[26]發現對一黃瓜進行2 h熱處理后,全基因組中的熱激轉錄因子表達水平存在很大差異,大部分轉錄因子表達量顯著上升。擬南芥中AtHsfA2在正常條件下基本檢測不到表達,37℃熱處理0.5 h到1 h表達量最高,隨后明顯降低,處理12 h表達量降低為零[6]。本試驗中,AhHSF在高溫脅迫3 h時表達量顯著升高,到6 h時達到最高,隨后表達量顯著下降,可能是由于在高溫初期,AhHSF的表達上調激活下游相關熱激蛋白的表達,隨著熱處理時間延長,熱激蛋白的高表達可能會對其表達具有抑制作用,因此,表達量有所下降.這與宮本賀等[27]在麝香百合中的研究結果相似,但麝香百合熱激轉錄因子表達量下降后又出現上升趨勢,可以看出AhHSF在不同植物中表達模式也是有差異的根據以上結果推測AhHSF在花生感受高溫脅迫的初期行使調控作用,表明AhHSF是一個受高溫誘導且在高溫環境中起調節作用的熱激轉錄因子。
4 結論
本研究克隆到花生熱激蛋白AhHSP70和熱激因子AhHSF的基因全長ORF,通過實時熒光定量PCR分析高溫處理不同時間AhHSP70與AhHSF的表達,結果顯示,AhHSP70對熱刺激初期不敏感,長時間高溫誘導后上調劇烈;在高溫條件下AhHSF表達水平快速上調,隨后快速下調。該結果為進一步研究熱激蛋白與轉錄因子的基因功能奠定了基礎,為闡明其在花生適應逆境脅迫的作用機理具有重要作用。endprint

