腦源性神經營養因子對帕金森病大鼠多巴胺能神經元的影響
趙淑杰 朱雨嵐
1)北京民航總醫院神經內科 北京 100025 2)哈爾濱醫科大學神經內科 哈爾濱 150080
帕金森病(Parkinson’s disease,PD)是慢性進行性神經系統變性病,雖然目前有許多治療藥物,但都不能改善其自然病程。尋找一種能延緩或逆轉病情發展的保護性治療措施是帕金森病治療所追求的重要目標,國內外研究表明,神經生長因子對體外培養的多巴胺能神經元的存活和分化均有一定影響,不僅可促進多巴胺能神經元的存活,還能夠顯著降低6-OHDA對多巴胺能神經元的毒性作用,本文就BDNF對實驗動物的多巴胺能神經元的影響進行報告。
1 資料與方法
1.1 行為學觀察 所有大鼠術前常規進行行為學測試,確認無異常旋轉行為,生理鹽水對照組術后14d,基本上無旋轉行為。6-OHDA組在注射6-OHDA后24h旋轉行為>10 r/min,術后14d,旋轉行為>10r/min,6-OHDA+BDNF組經過神經營養因子注射術后14d,旋轉能力減慢,10只大鼠基本上旋轉5~8r/min,術后21d,10只大鼠旋轉能力仍為5~8r/min。見表1。
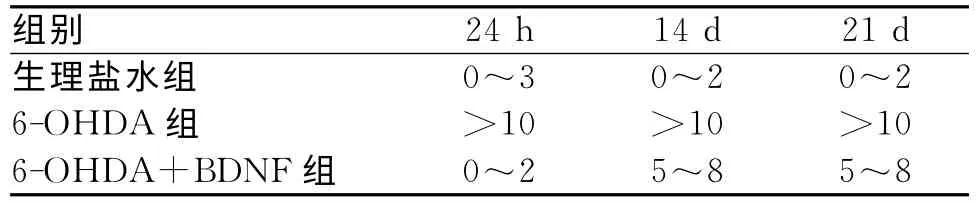
表1 大鼠注射術后旋轉行為變化表 (時間,r/min)
1.2 大鼠黑質DA能神經元數目的變化 鏡下觀察TH陽性神經元,TH陽性神經元主要見于生理鹽水組的黑質,數量較多,胞體較大,呈錐體型或橢圓型,神經元軸突明顯,(42.3±7.56)個/μm2(見圖1)。6-OHDA組大鼠黑質的TH陽性神經元數明顯減少,(2.41±1.07)個/μm2;神經元胞體腫脹,軸突少,細胞輪廓不清(見圖2)。2組差別具有統計學意義(P<0.01),且神經元胞體輪廓及突起也不清晰。6-OHDA+BDNF組神經元數為(15.36±3.04)個/μm2,神經元胞體比6-OHDA組明顯好轉,損傷恢復明顯(見圖3)。各組結果見表2,統計學處理差異明顯。
1.3 紋狀體多巴胺含量變化 6-OHDA對黑質紋狀體的損害還體現在使紋狀體多巴胺含量減少,6-OHDA+BDNF組紋狀體內多巴胺含量較6-OHDA組增高,差別具有統計學意義(P<0.05),見表3。
圖1 生理鹽水組黑質部TH陽性神經元(×200)
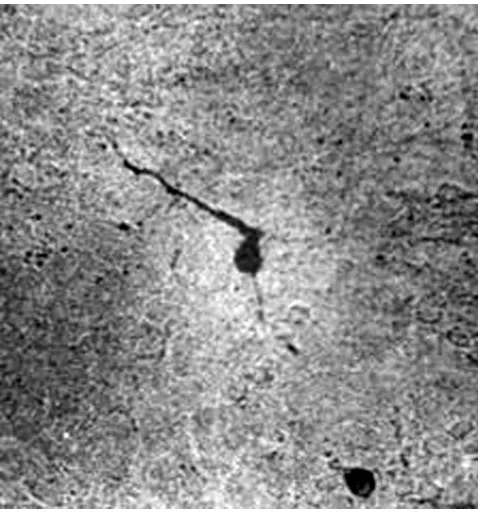
圖2 6-OHDA組黑質部TH陽性神經元(×400)
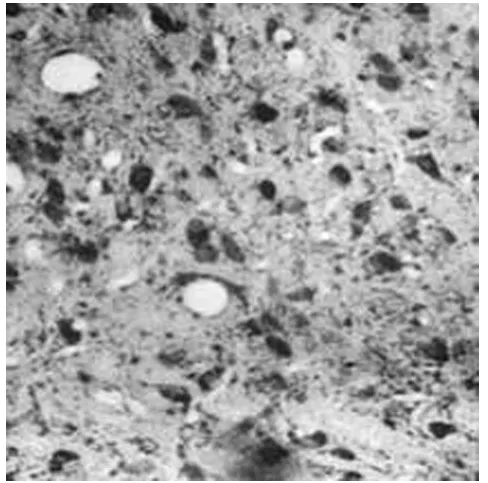
圖3 6OHDA+BDNF組黑質部TH陽性神經元(×200)
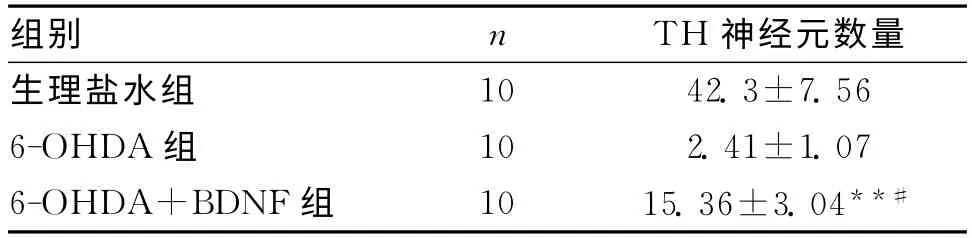
表2 大鼠黑質TH神經元的變化 (個/μm2)
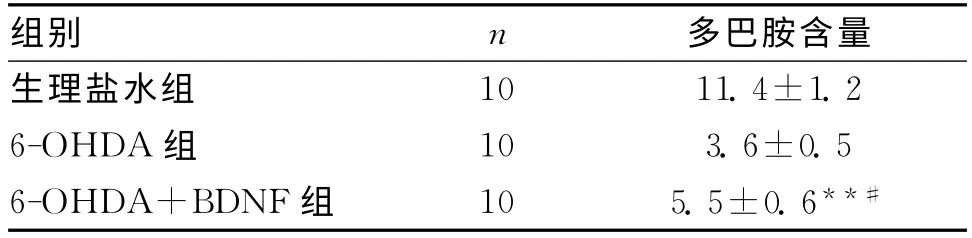
表3 大鼠紋狀體部多巴胺含量變化 (按濕重,μg/g)
2 討論
近年來不少研究揭示了PD的細胞凋亡證據[1-3]。將純的NTFs培養基體外培養胚胎多巴胺能神經元,能明顯提高其存活率,減少細胞凋亡[4-6]。目前國外已經開始研究神經營養因子對體內多巴胺能神經元的保護作用[7],并把其基因同酪氨酸羥化酶基因聯合起來,一方面既可促進多巴胺合成,另一方面又能保護多巴胺能細胞免受損傷,取得了一定成果。Frim等[8]將BDNF基因介入到成纖維細胞,再將成纖維細胞提前移植于1-甲基-4-苯-1,2,3,6-四氫吡啶(MPTP)毀損紋狀體的PD大鼠模型,可防止1-甲基-4苯基吡啶(MPTP)對大鼠的毒性作用,說明其具有保護黑質多巴胺能神經元的作用,這可能是通過逆軸突轉運誘導細胞的保護機制或增加線立體的功能發揮作用的。在用藥途徑上本研究避開血腦屏障(blood brain barrier,BBB)將BDNF通過立體定向注入黑質,與David的研究比較,藥物作用更直接,起效更快,而David等的方法是等移植細胞成活后,通過已經介導了BDNF基因的成纖維細胞的自分泌和旁分泌,產生BDNF發揮作用。旋轉行為觀察方面,本實驗與David等的研究相吻合,并且旋轉行為減少持續存在。且TH陽性神經元數量、紋狀體多巴胺含量BDNF組比模型組也有顯著增加,因其能特異性保護多巴胺能神經元免受損傷,清除致病因子,因此神經營養因子可用于PD的治療[9]。
Rosenblad等[10]通過紋狀體和側腦室兩種途徑注入膠質細胞源性神經營養因子(GDNF)和神經營養因子(NTFs),探討它們的神經保護作用,結果發現GDNF可提供幾乎92%的保護作用。本實驗也采用藥物直接作用方式,將BDNF通過立體定向注射于黑質致密部,結果發現BDNF減輕6-OHDA對紋狀體多巴胺含量下降(6-OHDA+BDNF組與6-OHDA組比較減輕20%),減輕6-OHDA對多巴胺能神經元損傷(見表2);治療前后行為學觀察對比,治療后癥狀明顯改善;大鼠黑質致密部TH神經元的變化說明本課題治療組與PD模型組差別具有統計學意義;紋狀體多巴胺含量觀察治療后與PD模型組差別具有統計學意義。本實驗與Rosenblad等結果一致,即神經營養因子對多巴胺能神經元有顯著的保護作用。我們分析BDNF主要通過以下幾種途徑保護多巴胺能神經元:(1)BDNF通過與受體結合使細胞內鈣結合蛋白(Calbindin)及其mRNA含量增加[11],與細胞內超載鈣離子結合,并促進其排出,保持細胞內鈣的穩定性,從而保護神經元免受損傷。(2)BDNF、GDNF能促進超氧化物歧化酶(SOD)及谷光甘肽過氧化物酶的生成并增強其活性,使自由基減少,從而減輕了自由基對神經元的損傷。(3)研究表明,神經元損傷與興奮性氨基酸——谷氨酸的過量釋放導致的谷氨酸興奮性毒性有直接關系。而神經營養因子的表達,分別受谷氨酸和GABA所介導,而BDNF可抑制興奮性遞質特別是谷氨酸的釋放,減少細胞損傷。(4)NTFs還可通過阻止細胞色素C的釋放,從而抑制細胞凋亡的啟動。因此,NTFs對PD患者多巴胺能細胞具有保護作用。
[1]Yao R,Cooper GM.Requirement for phosphatidylinositol-3 kinase in the prevention of apoptosis by nerve growth factor[J].Science,1995,267(5 206):2 003-2 006.
[2]Hassouna I,Wickert H,Zimmernann M,et al.Increase in bax expression in substantia nigra following 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine(MPTP)treatment of mice[J].Neuroscilett,1996,204(1-2):85-88.
[3]Lawrence MS,Ho DY,Sun GH,et al.Overexpression of Bcl-2with herpes simplex virus vectors protects CNS neurons against neurological insults in vitro and in vivo[J].J Neurosci,1996,16(2):486-496.
[4]Ip NY,Li Y,Yancopoulos,et al.Cultured hippocampal neurons show responses to BDNF,NT-3and NT-4,but not NGF[J].J Neurosci,1993,13(8):3 394-3 405.
[5]Tompkins MM,Basgall EJ,Zamrini E,et al.Apoptotic like c hanges in Lewy-body-associated disorders and normal aging in substantia nigral neurons[J].Am J Pathol,1997,150(1):119-131.
[6]Agid Y.Aging,disease and nerve cell death[J].Bull Acad Natl Med,1995,179(6):1 193-1 203.
[7]Mochizuki H,Goto K,Mori H,et al.Histochemical detection of apoptosis in Parkinson’s disease[J].J Neurol Sci,1996,137(2):120-123.
[8]Frim DM,Unler TA,Galpem WR,et al.Implanted fibroblasts genetically engineered to produce BDNF prevent MPTP toxicity to dopaminergic neurons in the rat[J].Proc Natl Acad Sci USA,1994,91(11):5 104-5 108.
[9]Zawada WM,Kirschman DL,Cohen JJ,et al.Growth factors rescue embryonic dopamine neurons from programmed cell death[J].Exp Neurol,1996,140(1):60-67.
[10]Rosenblad C,Kirik D,Devaux B,et al.Protection and regeneration of nigral dopaminergic by neurturin or GDNF in a partial lesion midel of Parkinson‘s disease after afministration into the strial or the lateral ventricle[J].Eur J neurosci,1999,11(5):1 554-1 556.
[11]Clarkson ED,Zawada WM,Freed CR.GDNF reduces apoptosis in dopaminergic neurons in vitro[J].Neuroreport,1995,7(1):145-148.

