亞臨床甲減對帕金森病患者認知功能障礙的影響
徐燕平 陳應柱 李曉波 趙海寧 張桁忠 吳 健
江蘇蘇北人民醫院神經內科 揚州 225001
帕金森病(PD)是中老年人神經系統慢性進行性變性疾病,以運動功能障礙為主要表現。近年來研究表明,PD 伴發輕度認知損害(MCI)是PD 癡呆發生的高危因素,及早識別并干預MCI對預防或延緩PD 癡呆非常重要。甲狀腺功能改變時,TSH 的波動較T3、T4更迅速且顯著。血中TSH是反映下丘腦-垂體-甲狀腺功能的敏感指標,尤其對亞臨床型甲減的診斷有重要意義;甲狀腺功能異常與帕金森病的相關性研究較少,且結論并不一致[1]。本研究探討亞臨床甲減對帕金森病認知功能的影響,現報道如下。
1 資料與方法
1.1 臨床資料 收集2012-01—2013-06在我院神經內科門診就診及住院并能按時隨訪的原發性PD 患者。入選標準:(1)所有患者診斷均符合英國PD 協會腦庫診斷標準。(2)入院24h內完善甲狀腺功能檢查。排除標準:(1)經頭顱CT 或MRI檢查排除腦血管病、腦炎、外傷、藥物等所致的帕金森綜合征、帕金森疊加綜合征、特發性震顫、抑郁癥;全身器質性疾病不能配合檢查及精神障礙者;(2)既往有甲狀腺疾病;(3)規律使用可影響甲狀腺功能的藥物(如鋰劑和含碘藥物等),存在其他可能影響甲狀腺功能結果的內科疾病(如慢性腎衰、慢性心肺疾病、腫瘤等);(4)入院24h內未完善甲狀腺功能檢查及FT3、FT4異常者;(5)既往服用過鹽酸苯海索等影響認知功能的藥物;(6)阿爾茨海默病、血管性癡呆、額顳葉癡呆等。
1.2 方法
1.2.1 指標檢測:所有納入患者于入院后第2天晨行TSH、FT3、FT4化驗檢查。并根據TSH 水平分成亞臨床甲減(SCH)組和正常TSH 組。TSH 參考值:0.27~4.2uIU/mL,FT3參考值:3.1~6.8pmol/L,FT4參考值:12~22 pmol/L。
1.2.2 認知功能評估:入院第2天應用MoCA 量表對52例PD 患者認知功能進行評分。
1.3 統計學方法 應用SPSS 17.0統計軟件進行統計分析處理,計量資料以均數±標準差表示,采用t檢驗,計數資料以百分比表示;采用χ2檢驗;P<0.05為差異有統計學意義。
2 結果
2.1 2 組帕金森病患者的基本資料比較 2 組在性別、年齡、受教育時間、Hoehn-Yahr分級比較差異無統計學意義,見表1。
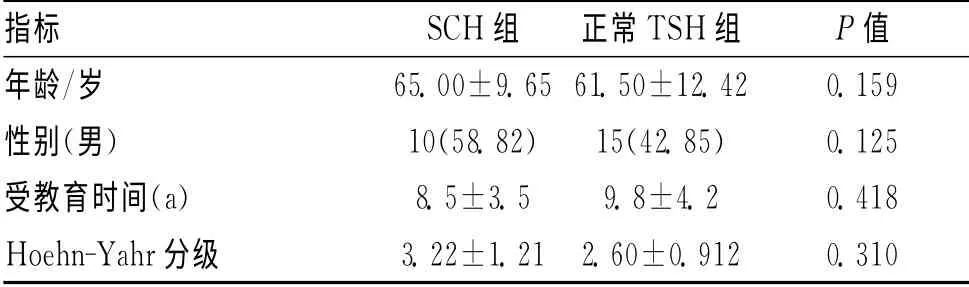
表1 2組基本資料比較
2.2 2組MoCA 量表評分比較 SCH 組MoCA 評分30.15±4.025,正常TSH 組為20.80±5.127,差異有統計學意義(P=0.043)。
3 討論
PD 及甲減在老年人中都有相對較高的患病率,在65歲以上老年人PD 發病率約為1.6%[2]。而甲減的發病率在6%~7%[3]。亞臨床甲減,是指無癥狀或癥狀輕微、血清甲狀腺激素水平正常、促甲狀腺激素(TSH)水平升高的臨床狀態,其診斷主要依賴實驗室檢查。目前尚未證實PD 與甲減之間是否存在著內在聯系,但有國外研究者建議對懷疑存在甲狀腺功能異常的帕金森病患者尤其是出現了病情惡化或對足量多巴胺產生耐藥的帕金森病患者進行TSH 篩查[4-5],然而關于亞臨床甲減對帕金森病患者認知功能障礙的影響的研究卻較少。
國外有文獻報道80%的帕金森病患者伴認知障礙,隨著疾病的進展,約30%將最終發展為帕金森病癡呆。有研究表明,在新診斷和未治療的帕金森病患者中19%的患者患有非癡呆認知功能損害[6]。蒙特利爾認知評價量表是一項檢測早期帕金森病患者輕度認知障礙便捷、有效的方法[7]。影響帕金森病認知障礙的因素,其中年齡、受教育時間、Hoehn-Yahr分級和ADL評分與帕金森病認知障礙顯著相關。
本研究通過對2組患者的MoCA 量表評分比較,亞臨床甲減對帕金森病患者認知功能的影響,結果發現亞臨床甲減對帕金森病患者認知功能有影響。
關于SCH 對帕金森病認知功能障礙的影響機制,可能有以下幾點:(1)肽類激素神經降壓素(neurotensin。NT)在下丘腦-垂體-甲狀腺軸起重要的作用,NT 還可能輔助TSH釋放[8]。有很多學者研究認為NT 通過抑制多巴胺D2 受體來增加多巴胺的釋放[9],提示TSH 與多巴胺之間存在相互調節機制。(2)亞臨床甲減也可影響脂質代謝、C 反應蛋白等[10],改變內皮功能,促使動脈血管僵硬,減弱血管功能,干涉腦部血液供應及氧化作用[11],啟動內生神經保護機制。(3)基礎代謝率減低。實驗室檢查發現亞臨床甲減患者的基礎代謝率減低。低代謝狀態可能對腦組織損傷起到保護作用[12]。伴亞臨床甲減的帕金森病認知功能較甲狀腺功能正常的好,臨床上對亞臨床甲減篩查追蹤及及時治療甲亢可能對帕金森患者認知功能的改善有價值。
[1]劉藝鳴.甲狀腺功能異常與帕金森病的相關性[J].內科理論與實踐,2010,5(5):400-402.
[2]De Rijk MC,Tzourio C,Breteler MM,et al.Prevalence of parkinsonism and Parkinson’s disease in Europe:the EUROPARKINSON collaborative study[J].J Neurol Neu—rosurg Psyehiatr)r,1997,62(1):10-15.
[3]Li TM.Hypothyroidism in elderly people[J].Geriatr Nuns,2002,23(2):88-93.
[4]Munhoz RP,Teive HA,Troiano AR,et a1.Parkinson’8disease and thyroid dysfunction[J].Parkinsonism Relat Disord,2004,10(6):381-383.
[5]許繼平,劉孟平,石壽林,等.帕金森病、帕金森綜合征、原發性震顫的TGAb、TMAb和甲狀腺功能的測試研究[J].中華神經精神雜志,1995,28(2):91.
[6]Williams-Gray CH,Fau-Foltynie T,Foltynie T,et al.Evolution of cognitive dysfunction in an incident Parkinson’s disease cohort[J].Brian,2007,130(Pt 7):1 787-1 798.
[7]顧劍萍,劉振國,干靜,等.帕金森病認知障礙及相關因素分析[J].中國現代神經疾病雜志,2009,9(3):252-256.
[8]Stolakis V,Kalafatakis K,Botis J,et a1.The regulatory role of neurotensin on the hypothalamic—anterior pituitary axons:emphasis orl the control of thyroid-related functions[J].Neuropeptides,2010,44(1):1-7.
[9]Fawaz CS,Maael P,Leo D,et a1.Presynaptic action of neurotensin on dopamine release through inhibition of D2receptor function[J].BMC Neurosci,2009,10:96.
[10]La Vignera S,Condorelli R,Vicari E,et al.Endothelial dysfunction and subclinical hypothyroidism:a brief review[J].J Endocrinol Invest,2012,35(1):96-103.
[11]Velkoska Nakova Valentina,Bosevski Marijan,Dimitrovski Chedo,et al.Subclinical hypothyroidism and risk to carotid atherosclerosis[J].Arq Bras Endocrinol Metab,2011,55(7):475-480.
[12]Baek JH,Chung PW,Kim YB,et al.Favorable influence of subclinical hypothyroidism on the functional outcomes in stroke patients[J].Endocr J,2010,57(1):23-29.

