神經干細胞移植聯合促紅細胞生成素對大鼠脊髓損傷的修復作用
趙 巖,肖宇龍,左 媛,王喜良,霍洪軍,江建明,閆慧博
(1.內蒙古醫科大學第二附屬醫院脊柱外科,內蒙古 呼和浩特 010030;2.南方醫科大學附屬南方醫院脊柱外科,廣東 廣州 510515;3.南方醫科大學第三附屬醫院脊柱外科,廣東 廣州 510630)
目前,脊髓損傷是神經損傷領域的常見疾病,但各國醫學界對其治療仍無重大突破。近年來研究[1]結果顯示:與其他干細胞比較,神經干細胞(neural stem cells,NSCs)具有顯著優勢,NSCs有較高的自我更新和增殖潛能,具備早期胚胎細胞特性,能夠分化為神經系統的各類細胞,其被認為是一種治療脊髓損傷的理想干細胞。目前,研究[2]結果顯示:促紅細胞生成素(erythropoietin,EPO)是一種新型的組織保護因子,具有神經保護和營養作用。但針對NSCs移植聯合EPO是否可有效地促進脊髓損傷大鼠功能的恢復尚鮮有研究。因此,本研究將NSCs和EPO聯合用于治療大鼠脊髓損傷,探討聯合應用治療脊髓損傷的效果是否優于單純NSCs移植,為臨床治療脊髓損傷提供理論依據。
1 材料與方法
1.1 實驗動物、主要試劑和儀器 健康成年雌性Wistar大鼠40只,體質量(220±20)g,孕14d的Wistar大鼠2只,均由內蒙古大學動物實驗中心提供,動物合格證號:SCXK(蒙)2002-0001。DMEM-F12培養基、胎牛血清(FBS)和B27補充液(美國Gibco公司),EPO(沈陽三生制藥公司),SABC免疫組織化學試劑盒、Nestin抗體和抗神經絲 NF-200抗體(武漢博士德公司)。FITC、胰蛋白酶和25cm2培養瓶(美國Corning公司),外科手術器械和纖維器械1套。
1.2 NSCs原代培養和鑒定 實驗方法參考文獻 [3],將孕鼠斷頭處死,迅速在無菌條件下剖腹取出胎鼠,剪開顱骨取腦組織,在解剖顯微鏡下分離中腦、海馬和側腦室下區組織。將分離的胎鼠腦組織用D-Hank’s液浸洗,用眼科剪將胎鼠腦組織剪成1mm×1mm×1mm的小組織塊,用等體積0.125%胰酶37℃消化10~15min,反復機械吹打,然后加入雙倍體積、含10%FBS的DMEM/F12終止消化。經200目不銹鋼篩網過濾,800r·min-1離心10min,棄去上清液。加入完全培 養 液 [DMEM/F12 加 20mol· L-1B27,10μg·L-1堿 性 成 纖 維 生 長 因 子(bFGF),20μg·L-1表皮細胞生長因子(EGF)]。吹打為單細胞懸液后,以活細胞濃度為1×108L-1接種于培養瓶中[3]。于CO2培養箱中培養5~7d,每隔2~3d離心、半量換液1次,將傳至3~4代的NSCs制作成細胞懸液,將細胞濃度調至1×109L-1[4-6],行 Nestin抗原免疫組織化學和免疫熒光鑒定。
1.3 大鼠脊髓全橫斷模型的建立[7]用3.5%戊巴比妥(1.3mL·100g-1)腹腔內注射麻醉,在無菌條件下以T8棘突為標志暴露脊髓T10節段[8-10],用鈍頭的鉤針完整地挑起脊髓,尖刀片于大鼠T10節段處連同硬脊膜和脊髓組織一起切斷,并切除1mm脊髓節段,彎頭顯微鑷輕抬起橫斷脊髓兩斷端以明確脊髓組織完全橫斷,明膠海綿填塞脊髓損傷處。
1.4 動物分組和給藥 40只大鼠隨機分為4組,每組10只。對照組:造模后大鼠在明膠海綿中給予DMEM/F12培養液10μL,并腹腔注射等量生理鹽水;NSCs組:大鼠造模成功后,將制備好的NSCs懸液用臺式離心機離心5min(1000r·min-1),再用 DMEM 調整細胞濃度至1×109L-1,在損傷局部明膠海綿中注入NSCs懸液10μL,在損傷處上下各1mm范圍內用微量注射器于0.25、0.50和0.75mm深度各注入 NSCs懸液共3μL,每個注射點0.5μL;EPO組:大鼠腹腔注射EPO 5000IU·kg-1,每天1次,連續注射7d,造模后在明膠海綿中給予DMEM/F12培養液10μL;NSCs+EPO組:移植NSCs并聯合腹腔注射EPO,5000IU·kg-1,每天1次,連續注射7d。
1.5 免疫組織化學染色和FITC-NF-200免疫熒光染色觀察大鼠NSCs和脊髓組織形態學 術后大鼠存活8周,8周后應用4%多聚甲醛磷酸鹽溶液經心臟灌注固定,取脊髓損傷處及上下各1cm脊髓組織置于質量分數30%蔗糖溶液中4℃過夜。部分脊髓組織常規梯度脫水、透明、石蠟包埋,切片行抗神經纖維絲蛋白抗體NF-200免疫組織化學染色;部分脊髓組織行縱向連續冰凍切片,片厚為30μm,隔3張取1張,NF-200為一抗,行FITC熒光標記的NF-200神經纖維絲蛋白染色。
1.6 大鼠后肢運動功能評分的檢測 應用實驗性脊 髓 損 傷 運 動 功 能(Basso-Beattie-Bresnahan)BBB評分法[11]對大鼠后肢運動功能恢復情況進行評價,評價時間為術前12h和術后3、7、14、28、42和56d。所有數據均由2名非本研究組但熟悉本評分標準的人員進行隨機雙盲評分,取平均值作為最終得分。
1.7 統計學分析 采用SPSS 13.0統計軟件進行統計學處理。各組大鼠后肢運動功能BBB評分以表示,多組間樣本均數比較采用單因素方差分析,組間兩兩比較采用LSD法。
2 結 果
2.1 體外培養的NSCs形態學 從胎鼠中腦、海馬和側腦室下區組織分離的單個細胞近似圓形、大小相近,培養2~3d后大多數細胞死亡,只有少數細胞進入有絲分裂期,鏡下可見明顯細胞核分裂象,分裂象的細胞逐漸聚集成團。細胞培養4~5d后,可見數個到數十個由細胞組成呈懸浮狀的球狀細胞團,這些細胞團體積很小,折光性強,突起不明顯,邊界清楚,大多呈褐色,邊緣見較小毛刺,稱為 “神經干細胞球”,中心部分顏色較深,但邊緣顏色較淺(圖1A,見插頁五)。將傳代后的神經干細胞球制備成單細胞懸液,經2~3d培養,可見這些單個細胞出現分裂現象,并重新形成小的細胞團,經5~6d培養,培養液中出現散在的、大小不等的神經干細胞球,7d時形成大的神經干細胞球,其邊界清楚、折光性強。NSCs標記性蛋白Nestin在原代和傳代培養的神經干細胞球中均有表達,并呈現綠色熒光(圖1B,見插頁五)。
2.2 大鼠損傷脊髓組織的形態學 術后8周,肉眼見損傷處脊髓組織因瘢痕組織增生而顏色變深,損傷處脊髓組織輕度萎縮(圖2,見插頁五)。橫斷處脊髓組織縱向切片NF-200染色顯示:對照組大鼠橫斷處脊髓組織殘端萎縮,橫斷區均為透明、不著色的瘢痕組織所代替,脊髓白質和灰質間可見大量空洞形成(圖3A,見插頁六);NSCs+EPO組大鼠橫斷處脊髓組織殘端輕度萎縮,橫斷區可見大量呈雜亂、無序生長的神經纖維,并可見有連續性神經纖維通過脊髓橫斷區,脊髓白質和灰質間可見少量空洞形成(圖3B,見插頁六)。對照組和EPO組大鼠未見有明顯的神經纖維再生;NSCs組大鼠可見少量的神經纖維再生,未通過損傷區到達尾側;NSCs+EPO組大鼠中,FITC共軛抗神經絲蛋白抗體NF-200標記的再生神經纖維在橫斷區頭側大量再生,呈無序狀生長,并通過損傷區到達尾側(圖4,見插頁六)。
2.3 各組大鼠后肢運動功能BBB評分 正常大鼠后肢運動功能BBB評分為21分。在本實驗中,術后3d內4組大鼠后肢運動功能的BBB評分均為0分。而后隨著時間的推移,4組大鼠后肢運動功能BBB評分均有不同程度升高,提示大鼠后肢運動功能均出現不同程度的恢復。尤以NSCs+EPO組大鼠更為顯著,并呈一定規律,脊髓橫斷損傷后各組大鼠后肢運動功能喪失,1周后開始恢復,其中2~5周恢復較快,6~8周后恢復明顯減慢。術后1~4周,NSCs組和EPO組大鼠后肢運動功能BBB評分比較差異無統計學意義(P>0.05),4周后NSCs組與EPO組大鼠后肢運動功能BBB評分比較差異有統計學意義(P<0.05);NSCs+EPO組大鼠后肢運動功能BBB評分高于其他各組(P<0.05)。術后8周末,NSCs+EPO組大鼠前、后肢運動協調、有規律,后肢腳掌可負重,但仍無法使軀體抬離地面;NSCs組大鼠前、后肢運動協調功能欠佳,只有少數大鼠后肢腳掌可負重,其余大鼠后肢腳趾呈彎曲狀,負重功能欠佳;對照組和EPO組大鼠后肢運動均為不協調、無規律的滑動。各組大鼠后肢運動功能BBB評分 見表1。
表1 各組大鼠后肢運動功能BBB評分Tab.1 BBB scores of motor function of hind limbs of rats in various groups (n=10,)
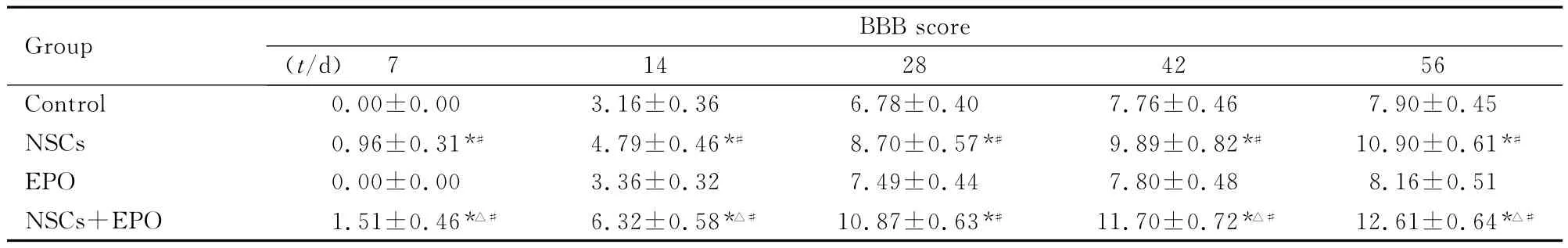
表1 各組大鼠后肢運動功能BBB評分Tab.1 BBB scores of motor function of hind limbs of rats in various groups (n=10,)
*P<0.05 vs control group;△P<0.05 vs NSCs group;#P<0.05 vs EPO group.
7 14 28 42 56 Control 0.00±0.00 3.16±0.36 6.78±0.40 7.76±Group BBB score(t/d)0.46 7.90±0.45 NSCs 0.96±0.31*# 4.79±0.46*# 8.70±0.57*# 9.89±0.82*# 10.90±0.61*#EPO 0.00±0.00 3.36±0.32 7.49±0.44 7.80±0.48 8.16±0.51 NSCs+EPO 1.51±0.46*△# 6.32±0.58*△# 10.87±0.63*# 11.70±0.72*△# 12.61±0.64*△#
3 討 論
脊髓損傷后很難再生修復,其主要原因包括損傷局部神經營養因子的缺乏和大量抑制性因子的分泌導致軸突再生的微環境遭到破壞;脊髓損傷后脊髓再生能力不足;損傷局部有膠質瘢痕形成。如能解決上述問題則有望解決脊髓損傷后神經修復和功能恢復的難題。自Reynolds等[12]首次在成年小鼠腦紋狀體中分離出可在體外分裂增殖、具有分化潛能的細胞群,并正式提出了 “NSCs”的概念以來,人們對其研究一直沒有中斷,并發現其有以下幾方面的基本特性[13-14]:可自我更新,從而維持穩定的細胞儲備;具有多向分化潛能,可分化為神經系統的各種細胞。鑒于其上述獨特的生物學特性,因此被認為是一種理想的移植種子細胞。本實驗從胎鼠腦組織中提取NSCs進行體外培養,觀察到其具有很好的克隆能力,并可穩定傳代。但NSCs在體內自然分化為神經元的比例僅占1%,分化為膠質細胞和少突膠質細胞卻分別占31.2%和50.3%[15],這嚴重影響NSCs移植后對脊髓損傷的修復效果。Watt等[16]和Hermanson等[17]采用各種神經生長因子或藥物對NSCs進行體外誘導,但分化為神經元的比例報道不一。近年來隨著人們對EPO研究的深入,證實其是一種新型的組織保護因子,具有神經營養和神經保護作用。研究[18]結果顯示:在實驗性自身免疫性腦脊髓炎模型中,EPO能夠增強少突膠質細胞的增殖和髓鞘的再生,促進脊髓損傷后神經功能的恢復。袁麗麗等[19]觀察EPO對體外培養的大鼠NSCs凋亡和分化的影響結果顯示:EPO可降低體外培養的大鼠NSCs的凋亡率,促進NSCs向神經元方向分化。盡管近些年的研究[20-22]顯示:EPO具有神經保護、神經營養的作用,但很少有人將NSCs和EPO聯合用于治療大鼠脊髓損傷。
本研究將NSCs和EPO共同作用于橫斷性脊髓損傷大鼠,利用EPO對NSCs的增殖及分化的影響,以期有效促進脊髓損傷大鼠脊髓功能的恢復,從而為臨床治療脊髓損傷提供實驗理論依據。本研究結果顯示:脊髓損傷大鼠如術后未給予任何的干預措施,自然恢復后其后肢運動功能BBB評分一般均在10分以下,大多集中在8分左右;術后8周,NSCs+EPO組大鼠后肢功能恢復明顯優于其他各組,對照組和EPO組大鼠后肢運動功能BBB評分比較差異無統計學意義;隨著時間的延長,NSCs+EPO組大鼠后肢功能恢復更為顯著,NSCs+EPO組大鼠在術后28d時后肢運動功能BBB評分達即可到10分以上,證明其對脊髓功能的恢復作用顯著。
目前判定損傷脊髓是否再生修復的標志是檢測是否有神經軸突的再生,NF-200是構成神經細胞體和神經軸突的框架,脊髓損傷后隨著神經軸突的變性壞死,構成神經軸突框架的NF-200也隨之崩潰減少,甚至消失為空洞或為瘢痕組織所替代。本研究中術后8周NF-200免疫組織化學染色結果顯示:對照組大鼠橫斷處脊髓組織殘端萎縮,橫斷區均為透明、不著色的瘢痕組織,脊髓白質和灰質間可見大量空洞形成;NSCs+EPO組大鼠橫斷處脊髓組織殘端輕度萎縮,橫斷區可見大量呈雜亂、無序生長的神經纖維,并有連續性神經纖維通過脊髓橫斷區,脊髓白質和灰質間可見少量空洞形成;NSCs+EPO組大鼠FITC共軛抗神經絲蛋白抗體NF-200標記的再生神經纖維在橫斷區頭側大量再生,呈無序狀生長,并通過損傷區到達尾側;對照組大鼠未見有明顯的神經纖維再生;NSCs組大鼠可見少量神經纖維再生,未通過損傷區到達尾側。本研究結果表明:無論是單純NSCs移植治療脊髓損傷還是NSCs聯合EPO治療脊髓損傷,二者均可以促進大鼠脊髓橫斷損傷后后肢運動功能的恢復,但NSCs聯合EPO治療脊髓損傷的修復作用更加顯著。
本研究結果表明:NSCs移植聯合腹腔注射EPO較單純NSCs移植能更有效地促進脊髓損傷大鼠后肢運動功能的恢復,該方法是探索脊髓損傷治療策略的一種有意義的、積極的嘗試,同時也為臨床治療脊髓損傷提供了非常重要的實驗理論依據。
[1]Andres RH,Horie N,Slikker W,et al.Human neural stem cells enhance structural plasticity and axonal transport in the ischaemic brain [J].Brain,2011,134(6):1777-1789.
[2]Sanchis-Gomar F,Perez-Quilis C,Lippi G,et al.Erythropoietin receptor(EPOR)agonism is used to treat a wide range of disease [J].Mol Med,2013,19(1):62-64.
[3]徐富翠,鄒禮樂,梅欣明,等.神經干細胞培養及其影響因素 [J].中國組織工程研究,2013,17(10):1835-1840.
[4]張殿君,劉 一,付長峰,等.新生大鼠脊髓源性神經干細胞的分離培養及分化鑒定 [J].吉林大學學報:醫學版,2009,35(2):230-233.
[5]Salazar DL,Uchida N,Hamers FP,et al.Human neural stem cells differentiate and promote locomotor recovery in an early chronic spinal cord injury NOD-scid mouse model [J].PLoS One,2010,5(8):1-15.
[6]張向榮,郭光華,劉德伍,等.人骨髓間充質干細胞的分離培養及BrdU標記鑒定 [J].中國組織工程研究和臨床康復,2009,13(19):3618-3622.
[7]孟步亮,巴迎春,宋士娜,等.脊髓全橫斷大鼠模型的構建 [J].中國組織工程研究與臨床康復,2011,15(7):1215-1218.
[8]Zhang SX,Huang F,Gates M,et al.Extensive scarring induced by chronic intrathecal tubing augmented cord tissue damage and worsened functional recovery after rat spinal cord injury [J].J Neurosci Methods,2010,191(2):201-207.
[9]Ozsoy O,Ozsoy U,Stein G,et al.Functional deficits and morphological changes in the neurogenic bladder match the severity of spinal cord compression [J].Restor Neurol Neurosci,2012,30(5):363-381.
[10]Talac R,Friedman JA,Moore MJ,et al.Animal spinal cord injury for evaluation of tissue engineering treatmentstrategies[J].Biomaterials,2004,25(9):1505-1510.
[11]Basso DM,Beattie MS,Bresnahan JC.Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transaction[J].Exp Neurol,1996,139(2):244-256.
[12]Reynolds BA,Tetzlaff W,Weiss S.A multipotent EGF-responsive striatal embryomic progenitor cell produces neurons and astrocytes [J].J Neurosci,1992,12(11):4564-4574.
[13]Nakamura M,Toyama Y,Okano H.Transplantation of neural stem cells for spinal cord injury [J].Rinsho Shinkeigaku,2005,45(11):874-876.
[14]Nandoe Tewarie RS,Hurtado A,Bartels RH,et al.Stem cell-based therapies for spinal cord injury [J].J Spinal Cord Med,2009,32(2):105-114.
[15]Parr AM,Kulbatski I,Tator CH.Transplantation of adult rat spinal cord stem/progenitor cells for spinal cord injury [J].Neurotrauma,2007,24(5):835-845.
[16]Watt FM,Hogan BL.Out of Eden:stem cells and their niches[J].Science,2000,287(5457):1427-1430.
[17]Hermanson O,Jepsen K,Rosenfeld MG.N-CoR controls differentiation of neural stem cells into astrocytes [J].Nature,2002,419(6910):934-939.
[18]Kang SY,Kang JH,Choi JC,et al.Expression of erythropoietin in the spinal cord of Lewis rats with experimental autoimmune encephalomyelitis [J].J Clin Neurol,2009,5(1):39-45.
[19]袁麗麗,杜紅梅,管英俊,等.促紅細胞生成素體外培養鼠胚腦皮質神經干細胞的分化 [J].中國組織工程研究與臨床康復,2011,15(49):9174-9177.
[20]Subiros N,Del Barco DG,Coro-Antich RM.Erythropoietin:still on the neuroprotection road [J].Ther Adv Neurol Disord,2012,5(3):161-173.
[21]Hong Z,Hong H,Chen H,et al.Investigation of the protective effect of erythropoietin on spinal cord injury in rats[J].Exp Ther Med,2011,2(5):837-841.
[22]Giese AK,Frahm J,Hubner R,et al.Erythropoietin and the effect of oxygen during proliferation and differentiation of human neural progenitor cells [J].BMC Cell Biol,2010,11(94):3-13.

