小鼠黑色素瘤相關抗原MART1的原核表達及抗體制備
李倩,孫鵬,楊建林,曹春雨,王艷林
三峽大學 醫學院 腫瘤微環境與免疫治療湖北省重點實驗室,湖北 宜昌 443002
鼠黑色素瘤相關抗原(melanoma antigen recognized by T-cells 1,MART1)又稱Melan-A,主要存在于正常黑色素細胞或惡性黑色素腫瘤細胞中。作為一種特征性黑素瘤腫瘤抗原,MART1 的表達異常與惡性黑色素瘤發生與發展密切相關[1-2]。最新研究表明,MART1 中的抗原肽能夠被T 淋巴細胞識別并激發強烈的CTL 反應,提示MART1在黑色素瘤特異性免疫治療中潛在的應用價值[3-6]。我們擬在大腸桿菌中原核表達和純化MART1蛋白,并以此為抗原制備高效價的兔抗鼠多克隆抗體,以為MART1在抗腫瘤免疫治療中的應用研究提供技術支撐。
1 材料與方法
1.1 材料
日本大耳白兔(雄性,2 kg)購自湖北省實驗動物中心;鼠黑色素瘤B16-F1 細胞株、大腸桿菌Rosseta(DE3)、質粒載體pET32a 為本實驗室保存;TRIzol 總RNA 純化試劑由Introvogen 公司提供;TaqDNA 聚合酶、限制性內切酶由Thermo 公司提供,Ni-NTA蛋白純化樹脂購于Qiagen公司;弗氏完全佐劑、弗氏不完全佐劑、抗β-actin 和抗His 標簽單抗購自Sigma 公司;Rodamine 標記的山羊抗小鼠IgG 為北京中杉金橋公司產品;HRP 標記的山羊抗小鼠IgG 多克隆抗體購自武漢博士德公司;PCR 引物合成及DNA測序由上海生工生物工程技術有限公司完成。
1.2 RT-PCR克隆小鼠MART1 cDNA
用TRIzol 試劑提取小鼠B16-F1 黑素瘤細胞總RNA,以該RNA 為模板、Oligo(dT)為引物,經逆轉錄酶M-MLV 催化,將mRNA 逆轉錄成cDNA 第一鏈,再以此cDNA 第一鏈為模板,用PCR 技術擴增出MART1 雙鏈DNA 編碼序列。PCR 上下游引物序列分別為5'-CGGAATTCATGCCCCAAGAAGACACAT TCA-3'和5'-AGCAAGCTTTCTCAGGGTGAATAAG GTGG-3',在上下游引物的5'端分別引入酶切位點EcoRⅠ和HindⅢ(引物序列中下劃線部分)以便隨后的克隆操作。PCR 產物經EcoRⅠ和HindⅢ雙酶切后克隆入pET32a 原核表達載體,用酶切和DNA測序鑒定所得重組質粒pET32a-MART1 中插入DNA序列和方向的正確性。
1.3 MART1的原核表達、純化及鑒定
用質粒pET32a-MART1 轉化大腸桿菌Rosseta(DE3)感受態細胞,培養至細菌處于對數生長期時,加入IPTG 至終濃度為0.3 mmol/L,誘導細菌表達重組蛋白5 h;離心收集誘導后的菌體,用裂解緩沖液(10 μmol/L 咪 唑,300 mmol/L NaCl,50 mmol/L NaH2PO4)重懸沉淀,超聲波裂解后取上清,上清中的MART1 重組蛋白用Ni-NTA 樹脂親和層析分離,咪唑濃度梯度洗脫獲得初步純化的MART1重組蛋白,再用制備性PAGE 進一步純化。用Western 印跡鑒定MART1 重組蛋白:樣品經SDS-PAGE 分離后電轉至PVDF膜,膜用5%脫脂牛奶封閉1 h,與1∶1000稀釋的鼠源His 標簽抗體共孵育,低速搖床上4℃過夜,再與1∶5000 稀釋的HRP 標記的羊抗鼠IgG 室溫共孵育1 h,ECL顯影指示目標蛋白。
1.4 MART1多克隆抗體的制備
用純化的MART1 蛋白免疫雄性日本大耳白兔。首次免疫劑量500 μg/只,與等量弗氏完全佐劑混合后于脊柱兩旁皮下注射;間隔10 d 后進行第二次免疫,注射劑量為100 μg/只,與等量弗氏不完全佐劑混合后皮下注射;10 d 后同樣方法進行第三次免疫;第三次免疫1周后頸靜脈取血,分離血清。
1.5 ELISA檢測抗體效價
以純化的MART1 蛋白(2 μg/孔)為包被抗原,一抗為本實驗中制備的梯度稀釋的兔抗血清,二抗為HRP標記的羊抗兔IgG(1∶5000稀釋),TMB顯色,全波長酶標儀檢測光密度(D450nm)。
1.6 Western印跡檢測抗體的特異性
蛋白樣品包括IPTG 誘導前、后的大腸桿菌菌液,純化的MART1 蛋白和B16-F1 細胞裂解液。上述樣品經SDS-PAGE 分離后電轉至PVDF 膜,膜用5%脫脂牛奶封閉后,先后與本實驗自制的兔抗血清(1∶3000 稀釋)和HRP 標記的羊抗兔IgG(1∶5000 稀釋)共孵育,ECL顯影指示目標蛋白。
1.7 制備抗體用于免疫熒光染色
將B16-F1 細胞接種于事先放置有蓋玻片的6孔板中制備細胞爬片,培養24 h 后用40 g/L 多聚甲醛于4℃固定15 min,經5 mL/L TxitonX-100 透化處理15 min,10 mL/L山羊血清37℃封閉30 min,然后分別與本實驗制備的MART1抗血清(1∶500稀釋)和陰性對照(1×PBS 取代一抗)37℃共孵育2 h,加入羅丹明標記的羊抗兔IgG(1∶100 稀釋),37℃避光孵育30 min,熒光倒置顯微鏡下觀測并記錄結果。
2 結果
2.1 鼠MART1 編碼cDNA 的克隆與原核表達載體構建
如1.2所述方法構建重組質粒pET32a-MART1,重組質粒經EcoRⅠ和HindⅢ雙酶切,獲得的限制性片段長度與理論預期一致(圖1),DNA 測序證實pET32a-MART1 中插入的DNA 序列、方向及讀框之間的對接均無誤。
2.2 MART1重組蛋白的原核表達、純化及鑒定
將重組質粒pET32a-MART1轉化大腸桿菌Rosseta(DE3)感受態細胞并用IPTG 誘導5 h 后,SDSPAGE 分析顯示誘導后的細菌中有一新生蛋白條帶出現,其分子大小與MART1重組蛋白預期相對分子質量一致(圖2)。該蛋白可經Ni-NTA 樹脂親和層析及切膠回收方法有效純化。Western 印跡分析證實該融合蛋白能與His標簽抗體特異性結合(圖3)。
2.3 抗MART1抗體的制備及效價鑒定
用上述實驗純化所得重組MART1 蛋白作為抗原免疫日本大耳白兔,經3 次皮下注射后,獲取免疫后的兔血清并用ELISA 法分析制備抗體的滴度和特異性。
用上述純化的同一批次的MART1 蛋白包被ELISA 檢測板,將抗體梯度稀釋(每個稀釋度設3 個復孔)后進行抗原-抗體結合反應,以高出對照血清D450nm值2.1 倍的制備血清抗體的最高稀釋度為抗體滴度。結果如圖4,本實驗所制備抗體的滴度為1∶1 024 000。
2.4 Western印跡鑒定制備抗體的特異性
Western 印跡結果顯示,制備的抗體能有效識別和結合原核表達的MART1 蛋白,在相對分子質量23×103處出現明顯的特異性反應條帶,其分子大小與預期一致(圖5)。另外,用16-F1細胞裂解液作為樣品進行的分析也能檢測出特異性條帶,表明本實驗制備的抗體能與真核細胞表達的MART1 抗原特異性結合(圖5)。

圖1 pET32a-MART1質粒的酶切鑒定
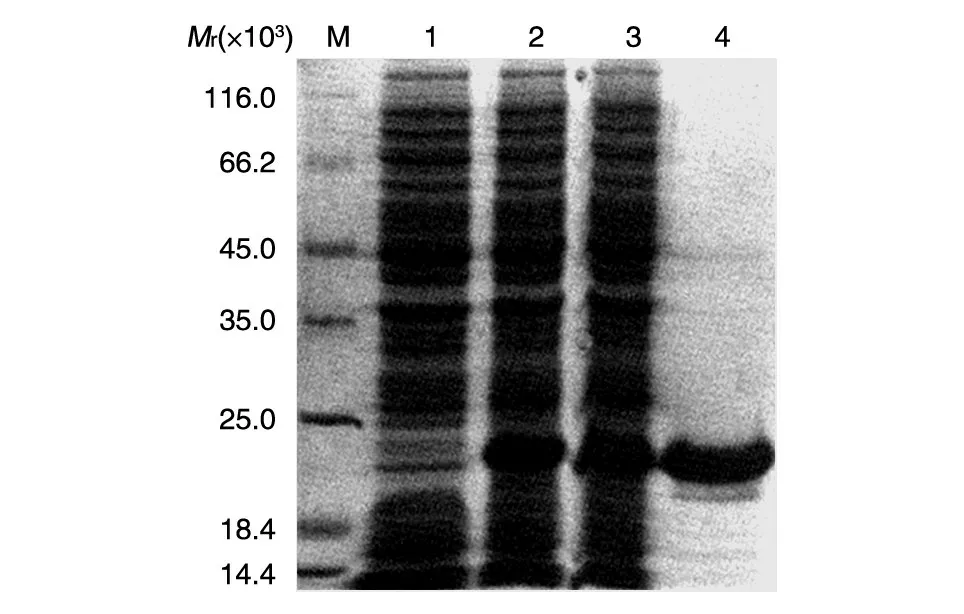
圖2 SDS-PAGE分析原核表達及純化的重組MART1

圖3 Western印跡分析原核表達和純化的MART1重組蛋白
同時,還用免疫熒光染色法檢測了制備抗體的特異性。制備B16-F1細胞爬片后,先后與制備抗體(一抗)和羅丹明標記的羊抗兔IgG(二抗)共孵育,然后在熒光顯微鏡下分析結果。結果顯示,制備抗體可以有效識別B16-F1細胞中的MART1蛋白(圖6)。
3 討論
為獲得大量可用作免疫抗原的小鼠MART1 蛋白,我們利用基因克隆技術將小鼠MART1基因全長編碼序列克隆到pET32a載體中,DNA 雙向測序證實構建的pET32a-MART1 重組質粒中外源DNA 片段插入方向及其與質粒中6×His 標簽編碼序列框架對接無誤,無移碼突變、堿基缺失等。在大腸桿菌原核表達系統中,IPTG 能高效誘導MART1 重組蛋白表達。由于重組蛋白N 端帶有6×His 標簽,我們用Ni-NTA 樹脂親和層析法純化MART1 重組蛋白。為得到更高純度的MART1 重組蛋白,我們將Ni-NTA 樹脂純化所得的蛋白樣品用制備性聚丙烯酰胺凝膠電泳進一步純化。

圖4 ELISA檢測抗體效價

圖5 Western印跡檢測抗體的特異性

圖6 細胞免疫熒光分析制備抗體的特異性(×400)
為獲得抗MART1的多克隆抗體,我們利用上述純化的MART1 重組蛋白作為抗原免疫日本大耳白兔,經1 次啟動免疫和2 次強化免疫后,在實驗動物體內獲得高效價的抗MART1 多克隆抗體。經免疫印跡和細胞免疫熒光法分析證實,該抗體能有效識別和結合原核及真核細胞中表達的MART1蛋白,具有良好的特異性。
綜上所述,我們建立了小鼠MART1蛋白原核表達和純化技術,制備出的高效價和特異性抗MART1多克隆抗體將為黑色素瘤的防治研究提供技術支撐。
[1]Weinstein D,Leininger J,Hamby C,et al.Diagnostic andprognostic biomarkers in melanoma[J].J Clin Aesthet Dermatol,2014,7(6):13-24.
[2]Wang X,Gillies E,Hassell L A,et al.Comparative genomic hybridization in a case of melanoma that loses expression of S100,HMB45,Melan A and tyrosinase in metastasis[J].Int J Clin Exp Pathol,2014,7(1):468-473.
[3]Chauvin J M,Larrieu P,Sarrabayrouse G,et al.HLA anchor optimization of the melan-A-HLA-A2 epitope within a long peptide is required for efficient cross-riming of human tumorreactive T cells[J].J Immunol,2012,188(5):2102-2110.
[4]Dadaglio G,Morel S,Bauche C,et al.Recombinant adenylate cyclase toxin of bordetella pertussis induces cytotoxic T lymphocyte responses against HLA*0201-restricted melanoma epitopes[J].Int Immunol,2003,15(12):1423-1430.
[5]Buhl T,Braun A,Forkel S,et al.Internalization routes of cell-penetrating melanoma antigen peptides into human dendritic cells[J].Exp Dermatol,2014,23(1):20-26.
[6]Zelba H,Weide B,Martens A,et al.Circulating CD4+T cells that produce IL4 or IL17 when stimulated by melan-A but not by NY-ESO-1 have negative impacts on survival of patients with stage IV melanoma[J].Clin Cancer Res,2014,20(16):4390-4399.

