一種丙肝病毒滴度測定方法
李亞東,李智華,畢研偉,陳晨,寸韡
1.中國醫學科學院&北京協和醫學院 醫學生物學研究所,云南 昆明 650118;2.云南省重大傳染病疫苗研發重點實驗室,云南 昆明 650118
1989年Choo等[1]通過克隆方法鑒定了丙肝病毒(hepatitis C virus,HCV)基因組,加速了HCV 研究進程;2005 年,HCV 2a 型JFH1 分離株在少數細胞系內獲得體外培養[2-3]。病毒研究過程中常須對其滴度進行測定,但HCV 感染細胞后產生的細胞病變效應(CPE)不明顯,這為HCV 滴度測定帶來了一定難度。2005 年,免疫熒光法(IFA)被用于HCV 滴度的測定[4],至今仍是測定HCV 滴度的主要方法。由于塑料細胞培養板在熒光顯微鏡下會產生衍射,干擾實驗結果,而玻璃細胞培養板較為昂貴,因此一般都采用細胞爬片進行IFA 實驗,但取出細胞爬片時易導致部分被感染的細胞損失,影響實驗結果的精確性。另一方面,由于顯微鏡下一個視野不能觀察到整塊細胞爬片,因此計數誤差較大。該方法也難以避免病毒二次感染的產生,造成實驗結果的不精確。
2009 年,免疫組化技術(IHC)被用于HCV 滴度的測定,該方法無須制備細胞爬片,可直接在96 孔細胞培養板內感染并進行后續免疫組化實驗,統計96 孔板中被感染孔計算TCID50,得到HCV 滴度[5]。這相比IFA 測定滴度方法更加精確,但成本依然相對較高。我們對IHC 技術測定HCV 滴度的方法加以改進,建立了一種更加簡便、經濟、安全的測定HCV 滴度的方法,為HCV 的基礎研究及臨床藥物評估提供有效手段。
1 材料與方法
1.1 材料
Huh7 細胞購于中國科學院動物研究所;HCV JFH1 病毒株為本實驗室保存;DMEM 培養基、非必需氨基酸購于Hyclone 公司;胎牛血清(FBS)購于Gibco 公司;抗HCV 核心蛋白單克隆抗體購于Viro-Stat 公司;羊抗鼠二抗-HRP 購于Thermo Pierce 公司;ImmPress羊抗鼠二抗-HRP及ImmPACT DAB 顯色試劑購于Vector 公司;瓊脂糖購于Invitrogen 公司;甲基纖維素購于Sigma 公司;96 孔板購于Costar公司。
1.2 病毒感染
Huh7 細胞按8×103/孔于96 孔板中采用含10%FBS 的DMEM 完全培 養基培 養16 h,取10 μL HCV,用DMEM 完全培養基按1/10 梯度稀釋為10-1~10-5,吸棄96 孔板中的培養基,將病毒稀釋液按50 μL/孔輕輕加入96孔板,每個稀釋度設定3個復孔以驗證此方法的可重復性,搖勻后置于37℃、5% CO2培養箱中進行感染,每隔1 h輕輕搖晃96孔板,使病毒均勻感染細胞,10 h 后吸棄病毒稀釋液,按100 μL/孔加入甲基纖維素-DMEM(含2%FBS)半固體培養基,于37℃、5% CO2培養箱中培養4 d。
1.3 HCV滴度測定
感染HCV 的Huh7細胞培養4 d后,輕輕吸棄甲基纖維素-DMEM 培養基,每孔加入100 μL 于-20℃預冷的甲醇,-20℃固定10 min,吸棄甲醇,PBS 輕洗2次,用100 μL含3% H2O2的PBS室溫處理5 min[5];PBS洗2次,加入50 μL含1% BSA和0.2%脫脂奶粉的PBS,4℃封閉過夜;吸棄封閉液,每孔加入30 μL用PBST(含0.5‰吐溫-20的PBS)以1∶500稀釋的抗HCV 核心蛋白單克隆抗體,室溫輕輕搖動1 h;吸棄一抗,PBS 洗2 次,PBST 洗1 次;每孔加入30 μL 用PBST以1∶1稀釋的辣根過氧化物酶(HRP)標記的羊抗鼠聚合二抗,室溫輕輕搖動30 min;吸棄二抗,PBS 洗2 次,PBST 洗1 次;每孔加入50 μL 新鮮配制的DAB顯色試劑,室溫作用1~10 min至看到棕色病毒斑;吸棄DAB 染液,PBS 洗2 次,加100 μL PBS,在低倍倒置顯微鏡下觀察感染病毒的細胞斑塊并計數。
2 結果
2.1 聚合二抗聯合DAB 能夠使被HCV 感染的細胞清晰顯色
目前測定HCV 滴度的主要方法是IFA 法,鑒于IFA 法測定HCV 滴度存在的一些不足,我們擬通過免疫組化技術在96 孔板內使被感染細胞顯色,減少IFA 法制備細胞爬片過程中造成的細胞損失,在一定程度上提高結果的準確性。
為了能夠完好地保存細胞內病毒的抗原性進行免疫組化實驗,需要對細胞進行固定。常用的固定劑有95%酒精、4%多聚甲醛、10%福爾馬林溶液、0.5%戊二醛、冷丙酮、冷甲醇等[6]。本實驗比較了冷甲醇、4%多聚甲醛、10%福爾馬林溶液3種常用的固定劑,均能起到很好的固定效果(圖1)。由于冷甲醇相對較易獲得,固定細胞的同時能夠滅活病毒,對人體的危害相對較小,因此本研究后續試驗采用甲醇進行細胞固定。
固定后的細胞保持了蛋白的抗原性,可以進行后續免疫組化實驗。然而,我們采用常規免疫組化技術進行后續操作,即封閉后用抗HCV 核心蛋白單克隆抗體進行孵育,利用辣根過氧化物酶(HRP)標記的羊抗鼠二抗識別鼠源一抗并采用DAB 顯色時,未觀察到細胞顯色;換用了HRP 標記的羊抗鼠聚合二抗及DAB 顯色試劑,結果能觀察到明顯的棕色病毒感染斑(圖1)。
2.2 采用0.8%~1%的甲基纖維素能夠限制病毒在胞間感染形成肉眼可見斑塊
測定HCV 滴度時,細胞被病毒感染會形成二次感染,通過免疫組化技術將被感染細胞顯色,通過TCID50方法可計算病毒滴度,但較浪費抗體,成本較高。因此,我們擬采用噬斑法計數病毒滴度。病毒感染細胞后,通過在細胞表面添加覆蓋物,可以限制病毒在細胞間感染。常用于病毒滴度測定的覆蓋物為瓊脂糖,但HCV 感染細胞不能形成可見的噬斑,因此在病毒感染細胞后,需要將覆蓋物移除以便于后續進行免疫組化實驗,而瓊脂糖覆蓋后凝固成塊狀,不易除去,因此需要選用一種既不完全凝固又能在病毒顆粒中自由流動的覆蓋物。甲基纖維素呈半固體狀,對細胞無毒害,易吸除,且不會同時吸走細胞,可以作為被實驗的覆蓋物。我們選用粘度為4000 cP 的甲基纖維素進行實驗,比較了0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.5%、2%共8 個不同終濃度的甲基纖維素進行覆蓋,綜合考慮其對病毒自由流動的限制以及移除的難易,發現終濃度為0.8%~1.0%的甲基纖維素既容易移除同時也能很好地限制病毒于細胞間感染,形成明顯斑塊(圖2)。
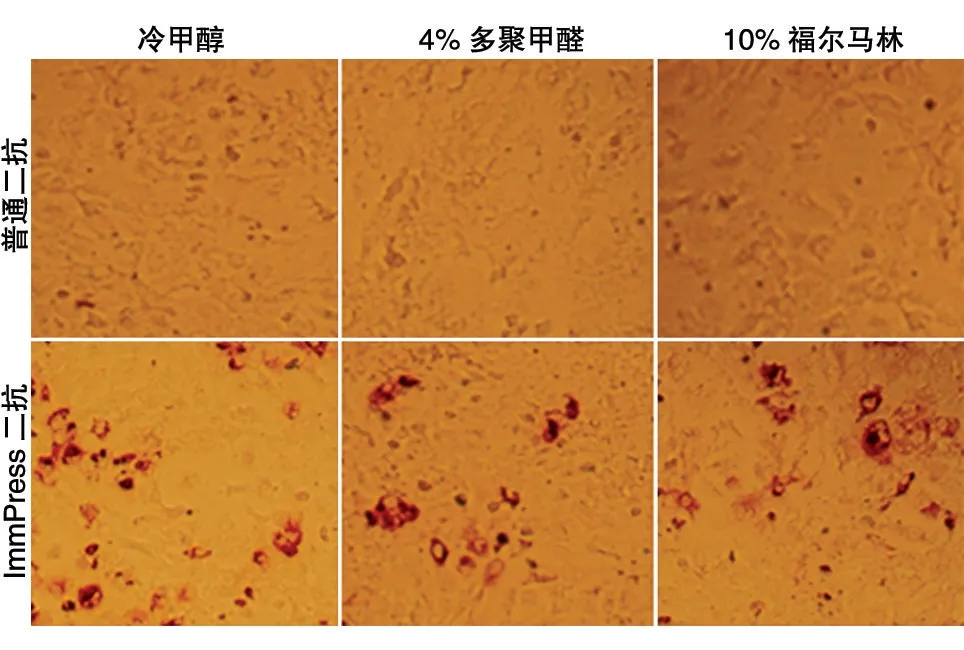
圖1 不同固定液及酶標二抗使被感染細胞顯色結果
2.3 建立的滴度測定方法具有可重復性
為了驗證所建立的滴度測定方法的穩定性與可重復性,測滴度時樣品設立3 個復孔,低倍顯微鏡下對感染斑計數。為了提高計數的準確性,將96 孔板每個孔呈“十”字劃線,-3 稀釋度的感染斑分布較均勻,感染斑個數為30±5(3 個復孔感染斑個數分別為32、26、35),各復孔之間感染斑個數無顯著性差異,說明該滴度測定方法具有穩定性和可重復性(圖3)。以此稀釋度計算,此批HCV 的滴度為6.2×105FFU/mL。
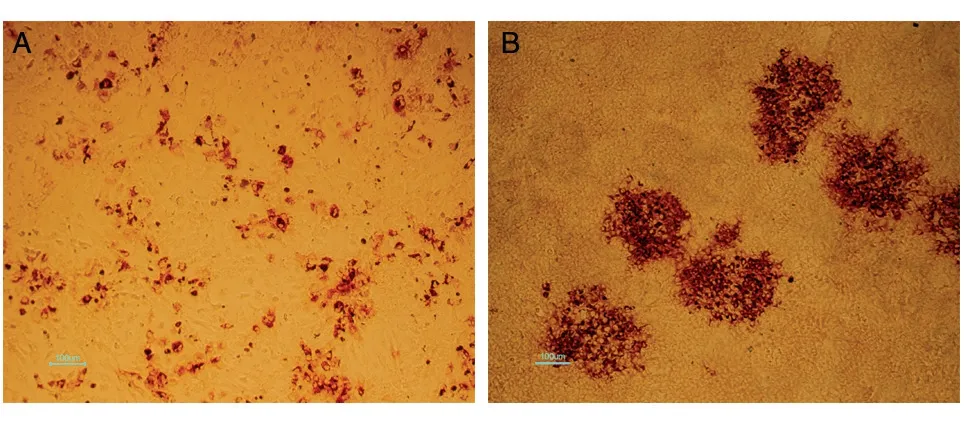
圖2 顯微鏡下HCV形成的感染斑
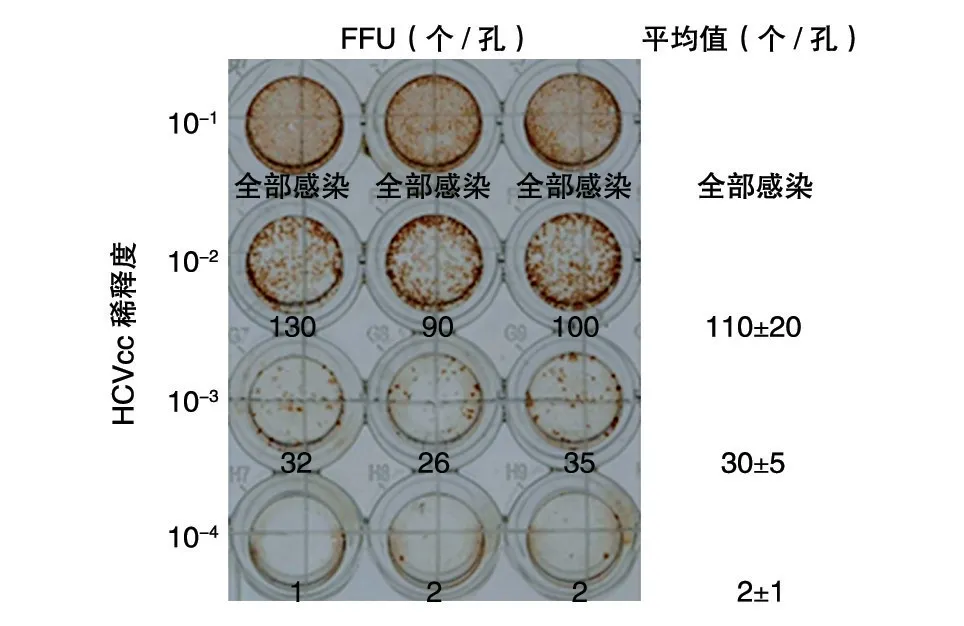
圖3 96孔板HCV滴度計算
3 討論
HCV 實現體外培養后,免疫學技術被運用到HCV 滴度測定中,發展出IFA 測定方法[4,7-8],成為HCV 滴度測定的主要方法,但仍然存在取出細胞爬片過程中會導致被感染細胞的損失,以及熒光顯微鏡下計數誤差等不足。2009 年,IHC 技術被用于HCV 滴度測定[5],將HCV 感染Huh7 細胞后,采用特異性的一抗識別HCV 蛋白,再采用HRP標記的二抗與一抗特異性結合,最后用DAB 顯色,通過統計HCV 感染細胞情況計算出HCV 的TCID50,從而得到病毒滴度。TCID50法測定HCV 滴度要浪費大量抗體,成本較高。本研究建立的測定HCV 滴度的方法,通過加入甲基纖維素限制病毒于胞間感染,利用聚合二抗及DAB 顯色形成肉眼可見的病毒斑塊,僅需一塊96 孔板就可測定4~6 個HCV 滴度,在保證結果精確的同時較為節約抗體。
本研究采用辣根過氧化物酶標記的羊抗鼠二抗識別鼠源抗HCV 核心蛋白的單克隆抗體,再用DAB顯色劑顯色,結果常規Western印跡所用的酶標二抗未使DAB 顯色;換用了高靈敏度的聚合型酶標二抗后,能夠使DAB 底物較好地顯色,使HCV 感染斑清晰呈現出來。在感染斑計數時,稀釋度較低,感染斑個數較多,導致各個感染斑之間有相連的情況,計數誤差較大;而稀釋度較高時,各孔之間感染斑個數差異較大,若以此計算滴度,則會導致大的誤差。本實驗中,10-3稀釋度在96 孔板各孔中出現約30 個感染斑,各感染斑之間分布較均勻,且復孔之間感染斑數無顯著性差異,因此以此感染斑數計算病毒的滴度。由于顯微鏡下計數易導致漏計或重復計數,可將每個孔劃線分成數個區域,以提高計數的準確度。同時,該方法形成的感染斑達到了肉眼可見的程度,可以直接計數或拍成照片后計數,若以更大的24孔板測定HCV 滴度,直接通過肉眼計數感染斑會更加容易。
[1]Choo Q L,Kuo G,Weiner A J,et al.Isolation of a cDNA clone derived from a blood-borne non-A,non-B viral hepatitis genome[J].Science,1989,244(4902):359-362.
[2]Wakita T,Pietschmann T,Kato T,et al.Production of infectious hepatitis C virus in tissue culture from a cloned viral genome[J].Nat Med,2005,11(7):791-796.
[3]Steinmann E,Pietschmann T.Cell culture systems for hepatitis C virus[J].Curr Top Microbiol Immunol,2013,369:17-48.
[4]Zhong J,Gastaminza P,Cheng G,et al.Robust hepatitis C virus infection in vitro[J].Proc Natl Acad Sci USA,2005,102(26):9294-9299.
[5]Lindenbach B D.Measuring HCV infectivity produced in cell culture and in vivo[J].Methods Mol Biol,2009,510:329-336.
[6]周會芹,楊江輝,余琦,等.固定液對細胞學涂片染色效果的影響[J].中國誤診學雜志,2009,9(30):7352-7353.
[7]Hishiki T,Shimizu Y,Tobita R,et al.Infectivity of hepatitis C virus is influenced by association with apolipoprotein E isoforms[J].J Virol,2010,84(22):12048-12057.
[8]Jiang J,Luo G.Apolipoprotein E but not B is required for the formation of infectious hepatitis C virus particles[J].J Virol,2009,83(24):12680-12691.

