丙型肝炎病毒核心蛋白通過MAPK/ERK 通路調節c-Fos誘導致癌作用研究進展
趙璐,戴振華,張賀秋,馮曉燕
1.軍事醫學科學院 基礎醫學研究所,北京 100850;2.沈陽藥科大學,遼寧 沈陽 110016
丙型肝炎病毒(hepatitis C virus,HCV)核心蛋白是一種多功能結構蛋白,除具有組裝病毒顆粒的功能外,還可與宿主細胞內多種蛋白質相互作用,參與多種轉錄因子的反式激活,或通過細胞內信號轉導通路,誘導細胞增殖、分化失衡,最終導致肝細胞癌(HCC)的發生[1-3]。因此,HCV核心蛋白在HCV致肝癌過程中具有重要作用。現有研究表明,在HCV致癌過程中,核心蛋白可以通過多種方式激活MAPK/ERK 信號通路,從而激活轉錄因子CREB/ATF、C/EBPα的表達,最終作用于c-Fos 使細胞發生癌變。我們將就此方面的研究進展進行簡要綜述。
1 HCV核心蛋白與MAPK信號通路
絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號轉導系統將細胞外刺激信號轉導至細胞及細胞核,參與細胞增殖、腫瘤形成、炎癥性疾病、應激等生理過程。從酵母到哺乳類細胞中,MAPK 通路都通過保守的三級酶促級聯反應MAPKKK-MAPKK-MAPK 進行信號轉導(圖1)。MAPKKK(MAPKK 激酶)和MAPKK(MAPK 激酶)均為絲氨酸(Ser)/蘇氨酸(Thr)蛋白激酶,MAPKK 由MAPKKK 活化后通過雙磷酸化MAPK 活化環中Thr-Xaa-Tyr 基序的Thr 和Tyr 殘基,激活MAPK。MAPK 家族成 員主要包括ERK1/2、JNK、p38 和ERK5/BMK1,相應的 通路為MAPK/ERK、SAPK/JNK、p38 MAPK 和ERK5/BMK1,同時這4 條通路之間存在著“對話(cross-talk)”。大量研究表明,在HCV 核心蛋白致癌過程中都會激活MAPK 信號通路。如Erhard 等利用表達HCV 核心蛋白的HepG2細胞系研究,發現HCV 核心蛋白的表達能激活MAPK 信號通路[4];Tsuchihara 等在穩定表達HCV 核心蛋白的BALB/3T3 A31-1-1 細胞系中,也同樣發現核心蛋白可激活MAPK通路。
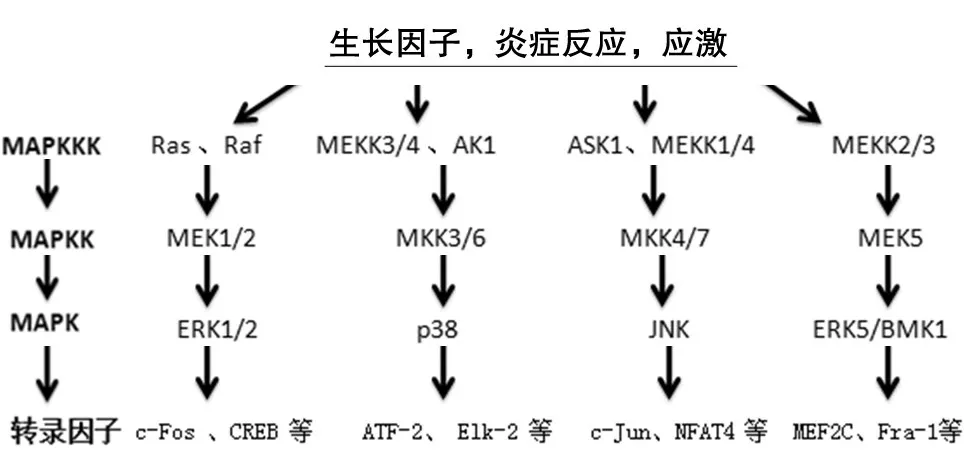
圖1 MAPK三級級聯信號傳導通路示意圖
2 HCV 核心蛋白通過MAPK/ERK 信號通路對轉錄因子c-Fos的調控作用
2.1 核心蛋白與轉錄因子c-Fos
轉錄因子AP-1 家族包括c-Fos 和c-Jun 亞族。c-Fos是一類與細胞增殖相關的原癌基因,在大多數正常細胞內均低水平表達,而在許多惡性腫瘤及其癌前病變中出現高水平表達。c-Fos 能夠通過調控MMP 活性調節血管生成因子的表達而破壞腫瘤細胞周圍組織,降解細胞外基質,促進血管生成及細胞遷移,增強腫瘤細胞的侵襲性[5]。因此,c-Fos的激活是判定細胞由正常狀態向疾病狀態轉化的一個重要的生物學指標[6]。
來自不同團隊的研究結果顯示HCV 核心蛋白與轉錄因子c-Fos 存在密切關系。Kato 等比較了7種HCV 蛋白對細胞信號轉導通路的激活作用,發現HCV 核心蛋白可顯著激活AP-1(c-Fos 和c-Jun)、SRE和NF-κB[7];Tsutsumi等在HCV 核心蛋白轉基因小鼠中檢測到AP-1活性顯著增強。另一方面,也有少數研究顯示核心蛋白不能作用于c-Fos,甚至會降低c-Fos 的表達。例如Erhard 等在表達HCV 核心蛋白的HepG2 細胞中發現HCV 核心蛋白能激活c-Jun,但卻沒有激活c-Fos[8];馮德云等發現在表達HCV 核心蛋白的QSG7701 肝細胞系中c-Fos 和c-Jun 的表達水平明顯下降,并且采用EMSA 檢測發現c-Fos和c-Jun的DNA 結合活性也顯著減弱[9]。雖然仍存在一些爭議,但絕大多數研究結果支持HCV 核心蛋白對轉錄因子c-Fos的激活作用。
2.2 MAPK/ERK 信號通路與核心蛋白激活轉錄因子c-Fos
MAPK/ERK(Ras/Raf/MEK/ERK)信號通路存在于所有的真核細胞中,是主要的MAPK 信號通路之一,參與細胞生長、增殖、凋亡等生理過程。有報道顯示c-Fos 的激活是通過Ras/Raf/MEK/ERK 信號通路磷酸化轉錄因子ATF/CREB 和Elk-1,隨后激活即早基因c-Fos 的表達(圖2)。綜合文獻報道,核心蛋白可以通過多種方式參與到Ras/Raf/MEK/ERK 信號通路中,最終激活轉錄因子c-Fos。以下為詳述。
Ras/Raf/MEK/ERK 信號通路最上游的刺激物是被鑒定為人類原癌基因的Ras。Ray 等發現HCV 核心蛋白和H-Ras共轉染原代大鼠胚胎成纖維母細胞REF后,出現細胞增殖和癌變的性狀,這表明核心蛋白能夠與H-Ras 協同作用促進細胞向癌細胞轉化[1](圖2-①)。
MAPKKK 成員Raf 也是一種原癌基因,它與細胞增殖、分化、生存、附著及血管生成的調節密切相關。在HepG2細胞中,HCV核心蛋白與14-3-3蛋白的相互作用使Raf 活性增強。Aoki 等在穩定表達HCV 核心蛋白的CCL13 細胞系中也發現HCV 核心蛋白能與14-3-3 蛋白作用,激活MAPK 的上游激酶Raf、MEK1 和ERK1/2[10]。這些實驗結果表明核心蛋白可以通過與14-3-3 蛋白相互作用的方式激活Raf,從而激活MEK-ERK 途徑(圖2-②)。此外,Giambartolomei等發現HCV核心蛋白的持續表達可使Raf 高水平表達,從而激活MAPK 信號通路[11](圖2-③)。
Hayashi 等研究了HCV 核心蛋白對MAPK/ERK級聯反應的影響,發現在穩定表達核心蛋白的HepG2 細胞中,核心蛋白可顯著激活MAPK/ERK 級聯反應,ERK磷酸化活性比對照提高了2.5倍。在該細胞中加入MEK1 抑制劑PD98059 后,原先核心蛋白激活的ERK活性被抑制,推測核心蛋白對MEK和ERK 具有激活作用[12](圖2-④、⑤)。相反,Fukuda等發現在瞬時轉染HCV 核心蛋白的細胞中,核心蛋白可增強MEK 下游Elk1 的激活,而對ERK 活性及Elk1 磷酸化沒有影響[13]。同樣,Tsuchihara 等觀察到HCV核心蛋白能激活MAPK及其下游的靶分子血清反應元件(SRE),促進MEK 下游分子Elk1 的激活和磷酸化但不影響ERK。而Yao 等在研究HCV 核心蛋白對于T 細胞激活早期事件的影響中發現,HCV核心蛋白抑制ERK 和絲裂原激活ERK 激酶(MEK)蛋白的磷酸化[14]。可見,關于HCV 核心蛋白對MEK下游分子的影響,不同的研究呈現不一致的結果,這可能與實驗系統與實驗條件有關。
CREB/ATF 是MAPK/ERK 信號通路的下游反應底物之一,同時又有研究證實CREB 是c-Fos 啟動子鈣離子反應元件結合蛋白,c-Fos啟動子序列中包含3 個CREB 反應元件[15]。所以,HCV 核心蛋白也可能通過Ras/Raf/MEK/ERK 信號通路調節CREB 作用于c-Fos,導致細胞癌變(圖2-⑥)。
CCAAT 增強子結合蛋白家族(C/EBP)也是MAPK/ERK 信號通路的下游反應底物之一,家族成員包括C/EBPα、C/EBPβ、C/EBPγ、C/EBPδ、C/EBPε、C/EBPζ。C/EBP 在機體生長發育過程中,主要通過對基因轉錄的調節參與各組織器官的細胞增殖與分化。MAPK 信號通路ERK1/2 可激活C/EBP 家族[16],而c-Fos基因的啟動子中含有功能性的C/EBPβ結合位點,同時C/EBP 能夠與其他轉錄因子(NF-κB、AP-1、Sp1、ATF/CREB)相互作用,那么核心蛋白能否通過Ras/Raf/MEK/ERK 信號通路調節C/EBP和c-Fos 的表達而引起HCC 的發生,還須進一步的研究(圖2-⑦)。
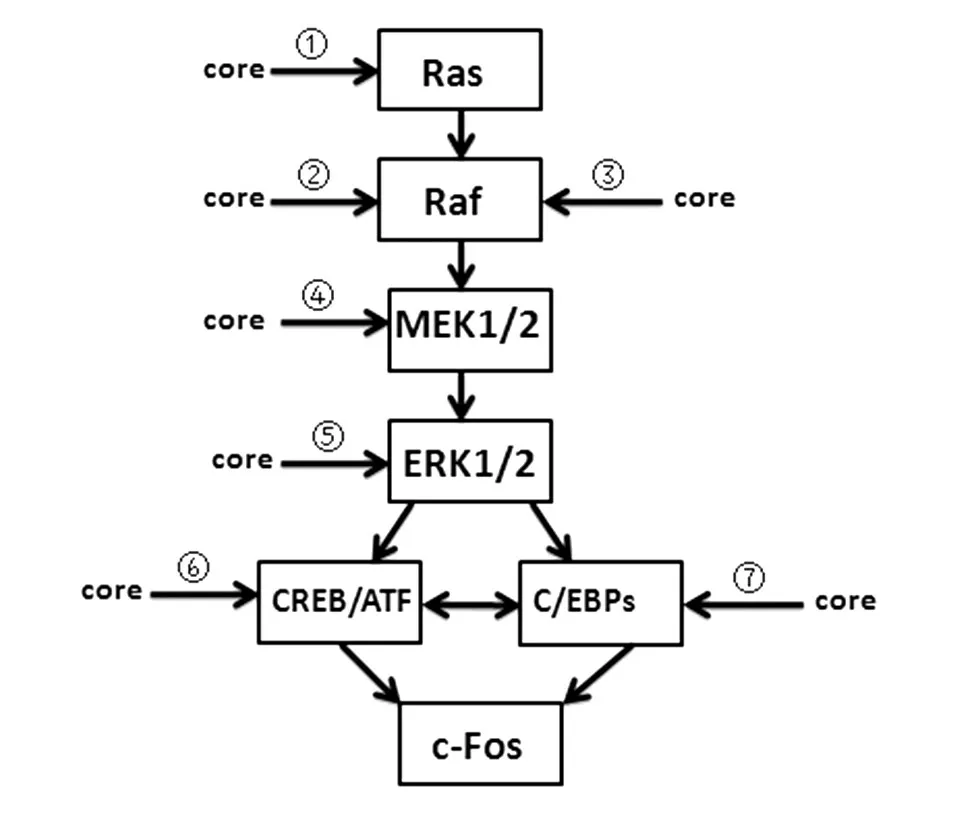
圖2 HCV核心蛋白通過MAPK通路對c-Fos基因的調節示意圖
HCV 感染大部分會轉變成持續性感染,最終可能導致HCC。在對HCV 致癌機制研究中,發現HCV核心蛋白在不同生理條件下會通過MAPK 通路參與細胞信號轉導,調節細胞內轉錄因子的表達,從而促進感染細胞的增殖和惡性轉化,在HCV 致HCC 的過程中起到了關鍵作用。核心蛋白通過MAPK/ERK信號通路對轉錄因子c-Fos 的調控作用也成為研究者關注的重點,此條通路中的蛋白也可能成為HCV相關HCC 治療的靶點。本文綜述了核心蛋白參與上述途徑的各個位點,有些已有實驗證據支持,有些尚待進一步證明,以期能夠為研究者提供一些思路,更全面地闡釋HCV 核心蛋白-MAPK/ERK-c-Fos 致肝細胞癌的作用機制。
[1]Levrero M.Viral hepatitis and liver cancer:the case of hepatitis C[J].Oncogene,2006,25(27):3834-3847.
[2]Aravalli R N,Cressman E N,Steer C J.Cellular and molecular mechanisms of hepatocellular carcinoma:an update[J].Arch Toxicol,2013,87(2):227-247.
[3]劉嬌.丙型肝炎病毒核心蛋白誘導Wnt/β-catenin 信號通路活化及其分子致病機制的研究[D].重慶:重慶醫科大學,2011.
[4]Erhardt A,Hassan M,Heintges T,et al.Hepatitis C virus core protein induces cell proliferation and activates ERK,JNK,and p38 MAP kinases together with the MAP kinase phosphatase MKP-1 in a HepG2 Tet-Off cell line[J].Virology,2002,292(2):272-284.
[5]Kim M,Murakami A,Kawabata K,et al.(-)-Epigallocatechin-3-gallate promotes pro-matrix metalloproteinase-7 production via activation of the JNK1/2 pathway in HT-29 human colorectal cancer cell[J].Carcinogenesis,2005,26(9):1553-1562.
[6]陳建勇,王聰,王娟,等.MAPK 信號通路研究進展[J].中國醫藥科學,2011,1(8):32-34.
[7]Kato N,Yoshida H,Ono-Nita S K,et al.Activation of intracellular signaling by hepatitis B and C viruses:C viral core is the most potent signal inducer[J].Hepatology,2000,32(2):405-412.
[8]Tsutsumi T,Suzuki T,Moriya K,et al.Alteration of intrahepatic cytokine expression and AP-1 activation in transgenic mice expressing hepatitis C virus core protein[J].Virology,2002,304(2):415-424.
[9]馮德云.肝細胞癌中信號轉導的異常及HCV 核心蛋白對人肝細胞生物學特性和信號轉導通路的影響[D].長沙:中南大學腫瘤研究所,2004.
[10]Hayashi J,Aoki H,Kajino K,et al.Hepatitis C virus core protein activates the MAPK/ERK cascade synergistically with tumor promoter TPA,but not with epidermal growth factor or transforming growth factor α[J].Hepatology,2000,32(5):958-961.
[11]Giambartolomei S,Covone F,Levrero M,et al.Sustained activation of the Raf/MEK/Erk pathway in response to EGF in stable cell lines expressing the Hepatitis C Virus(HCV) core protein[J].Oncogene,2001,20(20):2606-2610.
[12]Hayashi J,Aoki H,Kajino K,et al.Hepatitis C virus core protein activates the MAPK/ERK cascade synergistically with tumor promoter TPA,but not with epidermal growth factor or transforming growth factor alpha[J].Hepatology,2000,32(5):958-961.
[13]Fukuda K,Tsuchihara K,Hijikata M,et al.Hepatitis C virus core protein enhances the activation of the transcription factor,Elk1,in response to mitogenic stimuli[J].Hepatology,2001,33(1):159-165.
[14]Yao Z Q,Nguyen D T,Hiotellis A I,et al.Hepatitis C virus core protein inhibits human T lymphocyte responses by a complement-dependent regulatory pathway[J].J Immunol,2001,167(9):5264-5272.
[15]姚繁榮,曹東元,趙晏.cAMP 應答元件結合蛋白與痛覺調制[J].生理科學進展,,2006,37(2):125-128.
[16]Hong S,Skaist A M,Wheelan S J,et al.AP-1 protein induction during monopoiesis favors C/EBP:AP-1 heterodimers over C/EBP homodimerization and stimulates FosB transcription[J].J Leukoc Biol,2011,90(4):643-651.

