誘發性II型糖尿病小鼠血清細胞因子的變化
楊 華, 劉 芳, 周文江, 2, 周曉輝, 任曉楠
(1. 上海市公共衛生臨床中心, 上海 201508; 2. 復旦大學藥學院, 上海 201203)
誘發性II型糖尿病小鼠血清細胞因子的變化
楊華1, 劉芳1, 周文江1, 2, 周曉輝1, 任曉楠1
(1. 上海市公共衛生臨床中心, 上海 201508; 2. 復旦大學藥學院, 上海 201203)
目的比較誘發性2型糖尿病(T2DM)小鼠6周、24周時血糖、血脂及血清細胞因子白細胞介素-6(IL-6)、白細胞介素-10(IL-10)、腫瘤壞死因子-α(TNF-α)、γ-干擾素(IFN-γ)水平,探討T2DM小鼠模型的細胞免疫功能變化及其意義。方法3周齡雄性C57BL/6J小鼠46只,隨機分為對照組和模型組(DM組),模型組小鼠小劑量(50 mg/kg)多次腹腔注射鏈脲佐菌素(STZ), 高脂喂養。于造模后6周、24周分別測定每組小鼠的糖耐量、甘油三酯(TG)、血清總膽固醇(CHOL)、高密度脂蛋白(HDLC)、低密度脂蛋白(LDLC)水平, 同時檢測血清中IL-6、IL-10、TNF-α、IFN-γ的含量。結果造模后6周,DM小鼠表現為糖耐量異常,脂代謝紊亂,血清中IL-6水平升高,TNF-α、IFN-γ、IL-10均顯著高于對照組(P<0.05或P<0.01)。造模后24周時,糖脂代謝紊亂加重,血清中IL-6、TNF-α、IFN-γ、IL-10表達水平顯著高于造模后6周水平(P<0.01)。結論誘發性T2DM模型小鼠在成模不同時間的血糖、血脂及細胞因子的水平變化與臨床類似,可作為相關研究的動物模型。
誘發; 糖尿病小鼠; 鏈脲佐菌素; 血糖; 血脂; 細胞因子
糖尿病(DM)是一種慢性代謝紊亂疾病,世界范圍內約有1.7億患者,其患病率逐年上升,嚴重影響人們的生活質量和生命健康。在DM患者中,2型糖尿病(T2DM)占90%以上[1]。T2DM發病環節主要涉及兩大方面: 胰島素抵抗和胰島β細胞功能減退。國內外研究表明,糖脂代謝異常及胰島素抵抗可能參與炎癥發生和發展過程,T2DM及其并發癥的發生、發展過程與炎癥密切相關[2]。臨床研究證明,在DM患者中白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)、γ-干擾素(IFN-γ)等前炎癥細胞因子的血清水平發生了明顯變化[3,4],提示上述細胞因子通過促進機體炎癥反應參與了DM的發病過程,但有關細胞因子在T2DM動物模型中的相互作用的報道還很少見。
本研究通過小劑量多次注射鏈脲佐菌素(streptozotocin,STZ)結合高脂飼料建立T2DM小鼠模型,在成模早期(6周)、成模晚期(24周),通過檢測小鼠血糖、血脂及血清中IL-6、IL-10、TNF-α、IFN-γ這4種細胞因子的動態變化,分析其在小鼠糖尿病的發生、發展和預后判定中的相關性,為糖尿病的治療和預防提供實驗依據。
1 材料與方法
1.1實驗動物
SPF級3周齡雄性C57BL/6J小鼠46只,體質量14~16 g, 購于上海西普爾-必凱實驗動物有限公司[SCXK(滬)2013-0016]。小鼠飼養于上海市公共衛生臨床中心實驗動物中心[SYXK(滬)2010-0098]。光照12 h∶12 h,室溫保持在22~25 ℃,相對濕度為40%~60%,實驗期間小鼠自由飲食。
1.2藥物、試劑及儀器
STZ購自美國Sigma公司。檸檬酸購于上海生物工程有限公司。膽固醇和甘油三脂試劑盒購于羅氏公司。CBA試劑盒購于美國BD公司。血糖儀和血糖試紙條使用caresens檢測系統(測試范圍: 0.2~6 g/L 即1.1~33.3 mmol/L),超過檢測上限的記錄為33.3 mmol/L。流式細胞儀型號為BD FACS Aria I,購自美國BD公司。高脂飼料由上海仕林生物科技有限公司[滬飼審(2008)04031]提供,配方:基礎料71.8%+豬油18%+蛋黃粉8%+膽固醇2%+膽鹽0.2%。
1.3實驗方法
1.3.1模型建立 C57BL/6J小鼠隨機分為對照組(16只)和糖尿病(DM)組(30只), 分別飼喂普通料和高脂料。4周后, DM組小鼠腹腔注射STZ 50 mg/kg (STZ溶于0.1 mol/L檸檬酸緩沖液中,pH=4.4), 連續注射3 d; 對照組小鼠只注射等量檸檬酸緩沖液(pH=4.4)。24 h和1周后尾靜脈取血, 用血糖儀測小鼠血糖, 以空腹血糖值持續大于11.1 mmol/L, 確定為DM小鼠模型成功。每組小鼠繼續喂以相應的飼料。
1.3.2口服葡萄糖耐量試驗(OGTT)分別于DM小鼠成模6周(早期DM)、24周(晚期DM)時,小鼠禁食12 h(不禁水),每組取8只稱重,尾靜脈取血測空腹血糖(0 min), 繼而腹腔注射20%葡萄糖溶液(2 g/kg), 記錄給糖后15 min、30 min、60 min、120 min小鼠血糖值。
1.3.3血糖、血脂檢測于模型穩定后6周(早期DM)、24周(晚期DM), 小鼠禁食12 h(不禁水),眼眶靜脈叢取血200 μL,3 000 r/min離心10 min,分離血清,用全自動生化儀測定血糖(GLU)、血清總膽固醇(CHOL)、甘油三酯(TG)、高密度脂蛋白(HDLC)、低密度脂蛋白(LDLC)。
1.3.4流式細胞技術檢測血清細胞因子取DM組小鼠(成模后6周、24周)和對照組小鼠血清,用流式細胞儀CBA方法檢測血清中IL-6、TNF-α、IFN-γ、IL-10水平。
1.4統計學方法
2 結果
2.1小鼠一般狀況
STZ注射后72 h,DM組小鼠出現飲水量、進食量、尿量明顯增加,被毛無光澤,活動減少,體質量下降; 正常組小鼠行為和活動均正常,體質量穩步增長。
2.2造模成功率
統計STZ注射后24 h和1周的小鼠空腹血糖值,發現DM組中30只小鼠血糖值為6.7~33.3 mmol/L,其中8只小鼠血糖值小于11.1 mmol/L,為造模未成功者,予以剔除。其余22只小鼠的空腹血糖值持續大于11.1 mmol/L,且一直存活到實驗結束為造模成功。本實驗成模率相對較高,為73.3% (22/30)。
2.3糖耐量曲線變化(OGTT)
OGTT的結果表明,對照組小鼠糖耐量曲線正常,空腹血糖值較低,注射葡萄糖溶液后,血糖濃度快速升高,15 min后開始恢復,2 h基本接近正常水平。DM組小鼠在成模6周、24周時的空腹血糖水平均較對照組有顯著性差異(P<0.01)注射葡萄糖溶液后, 血糖值大幅升高, 15 min即達最高33.3 mmol/L, 30 min、60 min時血糖穩定在最高水平, 各時間點均較對照組有統計學差異(P<0.01)60 min后略有恢復,至120 min時仍然維持在較高水平,較對照組有統計學差異(P<0.01)。24周 DM組小鼠的糖耐量低于6周DM組,但同一時間點血糖值比較無統計學差異(P>0.05)(圖1)。表明小劑量多次注射STZ結合高脂飼料喂養可使小鼠血糖明顯升高,并且可維持至DM晚期。
2.4血糖、血脂檢測
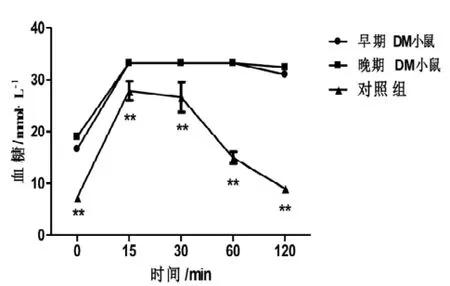
圖1 DM小鼠不同時期糖耐量的變化(n=8)Figure 1 Glucose tolerance in DM mice during different periods(n=8)
DM組和對照組小鼠比較,早期DM小鼠的GLU、TG、CHOL、HDLC、LDLC值較對照組明顯升高; 在成模24周時,GLU、TG繼續維持在高水平,而CHOL、HDLC、LDLC值較6周有所下降,其中CHOL值下降顯著(P<0.01),但CHOL、HDLC、LDLC值仍高于正常對照組(P<0.01或P<0. 05)(表1)。
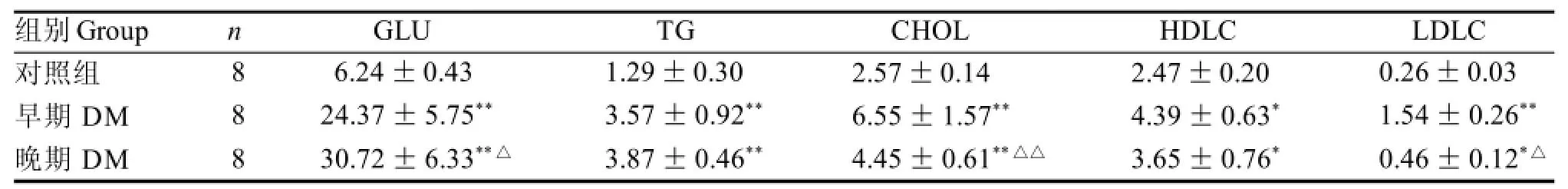
表1 DM小鼠不同成模時間血糖及血脂的變化Table 1 Blood glucose and blood lipids level in DM mice during different periods mmol /L
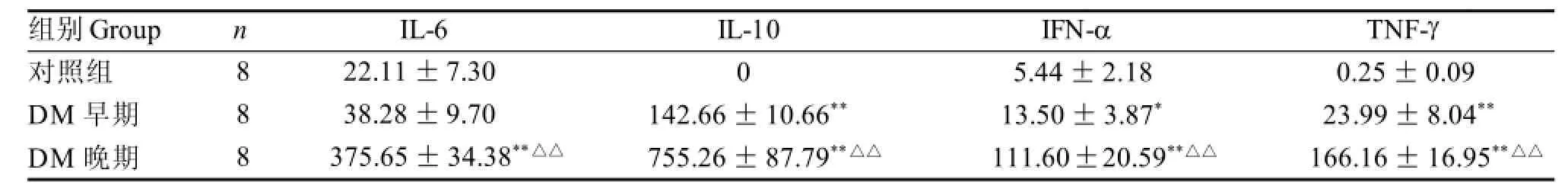
表2 DM小鼠不同成模時間血清細胞因子變化Table 2 Serum cytokines in DM mice during different periods μg/L
2.5細胞因子
與對照組比較,早期DM小鼠IL-6、IL-10、TNF-α、IFN-γ血清濃度均升高, 其中IL-10、IFN-α、TNF-γ含量較對照組有顯著性差異(P<0.05或P<0.01)。隨著DM發病時間的延長、病程進展,免疫功能紊亂程度加重及并發癥的出現,細胞因子的血清濃度遞進增高, 晚期DM小鼠, IL-6、IL-10、TNF-α、IFN-γ血清濃度顯著高于成模6周水平(P<0.01), 亦顯著高于對照組水平(P<0.01)(表2)。
3 討論
合適的T2DM動物模型是研究T2DM的重要工具,小劑量注射結合高脂飼料則可誘導小鼠T2DM的發生[5]。本研究觀察到,用該方法建立的DM小鼠,在成模6周時,出現高血脂、高血糖的糖脂代謝失常,隨著病程延長,小鼠繼續喂食高脂飼料后,進一步加劇了糖脂代謝紊亂。可能是小劑量STZ輕微破壞胰島,引起脂肪和膽固醇的堆積,還導致外周組織的胰島素敏感性顯著下降。同時高脂飲食致血漿中氨基酸濃度升高,刺激肝糖異生,最終使模型組小鼠血糖升高。這些癥狀符合T2DM的特征,與人的2型糖尿病臨床表現[6]一致。
T2DM的發病機制主要是胰島素抵抗和胰島素分泌不足,但究其病因尚未十分明了,目前認為與炎癥有關,是一種長期慢性炎癥性疾病,并伴隨一些炎癥細胞功能的改變[7,8]。多種細胞因子通過介導一些急性反應,在T2DM中發揮著重要作用。因此,在T2DM動物模型建立的過程中,關注細胞因子水平的變化非常重要,這關系到動物模型能否很好地模擬臨床病人的病程進展,而以往這方面的研究還不夠完善。
IL-6是一種常見的由多種細胞產生的細胞因子,可誘導肝臟合成炎性蛋白質,IL-6過多會使肝臟C-反應蛋白的合成增加, 加重炎性反應[9,10]。作者的研究結果表明, T2DM小鼠血清中IL-6在成模6周(即糖尿病早期)開始升高,至成模24周時,IL-6的表達量顯著高于成模6周(P<0.01),隨著糖尿病發病時間的延長, 表達水平明顯升高, 符合以上臨床研究結果。本實驗提示IL-6在糖尿病的發生發展中起重要作用, 在DM早期, IL-6的增加促進胰島素的分泌導致高胰島素血癥,當IL-6增加到一定程度,則胰島素的分泌抑制,且IL-6可使細胞產生特征性的退化改變,進一步加重糖尿病患者的病情。
TNF-α是具有多種生物活性的細胞因子,是機體炎癥反應的重要介質。IFN-γ是由活化T細胞產生,介導β細胞的直接毒性作用; 刺激淋巴細胞、胰島β細胞進行直接殺傷[11]。有研究[12]表明,TNF-α、IFN-γ等細胞因子是影響DM小鼠胰島細胞凋亡的重要因素,參與DM慢性并發癥的發生和發展, 兩者協同促進糖尿病程發生。本文作者的研究結果顯示: DM小鼠在成模6周, 血清TNF-α、IFN-γ水平較正常對照組顯著增高(P<0.01),并隨著病程延長逐漸升高,到成模24周時,與6周比較,差異有統計學意義(P<0.01),實驗結果與臨床報道相符[13,14]。主要原因可能是長期高血糖促進TNF-α、IFN-γ分泌,而大量TNF-α、IFN-γ作用于胰島細胞可造成細胞的DNA損傷及胰島素抵抗, 如此惡性循環, 不斷加重病情。這表明TNF-α、IFN-γ在糖尿病早期即參與胰島素抵抗的形成, 并可能持續對胰島β細胞產生損害, 兩者共同參與了糖尿病的發病, 并且與病程的長短有關, 發病時間越久,TNF-α、IFN-γ的血清水平越高。結果提示: TNF-α、IFN-γ的升高是糖尿病發生和發展的危險因素, 可作為判斷DM病情嚴重程度的一個監測指標, 為糖尿病的預防監測和治療提供了一種新的思路。
IL-10是一個主要的細胞因子合成抑制物,具有免疫抑制和免疫刺激雙重作用[15]。在本實驗中,血清中IL-10水平在成模6周已顯著升高,并隨著病程延長逐漸上升,到成模24周時,DM組IL-10水平較6周顯著升高,而臨床上Van Exel等[4]在對85歲以上人群進行研究后認為IL-10的產生能力與T2DM及代謝綜合征呈負相關, 與本文作者小鼠模型的實驗結果不一致。對此, 作者分析認為: 1)IL-10的水平及變化規律在動物模型與與臨床病人間可能存在一定差異, 使產生的結果不一致。2)實驗對象年齡不一致,Van Exel等研究調查的人群年齡在85歲以上, 隨著年齡的增大, 機體免疫功能呈自然衰退趨勢。本研究對象的小鼠周齡較小, 且本實驗中只觀察到小鼠成模后24周,由于在T2DM發生早期,促炎因子和抗炎因子同時產生并作用于機體,當促炎因子的作用強于抗炎因子, 輔助性T細胞1/輔助性T細胞2(Th1/Th2)的平衡被打破,慢性炎癥和免疫紊亂導致糖尿病的最終發生。如延續至老齡化小鼠的IL-10的監測,或可有助于了解小鼠IL-10表達是否隨DM小鼠病程延長而逐漸升高,這需進一步實驗驗證。
本研究結果中, T2DM小鼠隨著病程的進展,血糖持續升高,血脂紊亂加重,炎癥細胞因子的血清濃度遞進增高,病程后期免疫功能紊亂程度亦加重,提示動物體內細胞因子水平的升高是一個長期慢性的過程。病程前期糖調節受損階段就存在炎癥狀態,糖脂代謝異常及胰島素抵抗一起參與了炎癥發生發展并加重炎癥反應。在T2DM小鼠病程中上述細胞因子水平的升高,一方面反映了炎性細胞因子通過趨化、活化淋巴細胞、中性粒細胞等產生免疫病理損傷; 另一方面, 這些因子可直接作用于胰島細胞等, 造成組織損傷。兩者相輔相成,上述細胞因子或單獨或聯合, 調節著胰島β細胞的分化、生長和分泌功能, 在細胞炎性壞死進展中起著重要作用,實驗結果驗證了上述這一觀點。
本研究提示: 高脂飲食加小劑量STZ可建立穩定的小鼠T2DM模型, 該模型具有人T2DM的主要表型特征和相似的發病過程。IL-6、IL-10、TNF-α IFN-γ等細胞因子在T2DM小鼠中的變化表明其與T2DM的病程進展有著密切的關系, 如能結合動態觀察實驗小鼠的胰腺、肝臟、腎臟組織中細胞因子的水平變化,通過免疫組化染色法顯示不同病程中其在組織中的表達,更能進一步驗證組織中的表達與血清中濃度結果是否吻合。在T2DM病程中監測這些細胞因子非常必要,進一步研究這些因子的動態變化,有助于更好地了解T2DM的發生、發展并為臨床診斷、病情監測及預后提供有益的參考
[1]Hall HM, Banerjee S, McGuire DK. Variability of clopidogre response in patients with type 2 diabetes mellitus[J]. Diab Vasc Dis Res, 2011, 8(4):245-253.
[2]Kanter JE, Averill MM, Leboeuf RC, et al. Diabetes-accelerated atheresclerosis and inflammation[J]. Cire Res, 2008, 103(8)116-117.
[3] Ziceardip P, Nappo F, Giugliano G, et al. Reduction of inflammatory cytokine concentrations and improvement of endothelial functions in obese women after weight loss over one year[J]. Circulation, 2002, 105(7):804-809.
[4]Van Exel E, Gussekloo J, de Cruen AJ, et al. Low production capacity of intedeukin-10 associates with the metabolic syn drome and type 2 diabetes: the Leiden 85-plus study[J]Diabetes, 2002, 5l(4):1088-1092.
[5]司曉晨, 尚文斌, 卞慧敏, 等. 鏈脲佐菌素加高脂膳食誘導2型糖尿病大鼠模型[J]. 安徽中醫臨床雜志, 2003, 15(5):383-385.
[6]郭航, 常寶成, 楊菊紅, 等. 不同病程2型糖尿病患者胰島α及β細胞功能評價[J]. 中華全科醫師雜志, 2013, 12(11)874-877.
[7] Tilg H, Moschen AR. Inflammatory mechanisms in theregulation of insulin resistance[J]. Mol Med, 2008, 14:222-231.
[8]Pickup JC. Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes[J]. Diabete Scare, 2004,27:813-823.
[9]王春霞, 劉閣玲, 王秋成. 2型糖尿病患者甘露糖結合凝集素及IL-6、IL-8、IL-17、IL-23的變化[J]. 中國老年學雜志, 2013, 33:1761-1762.
[10] Liang H, Block TM, Wang M, et al. Interleukin-6 and oncostatin M are elcrated in liver disease in conjunction with candidate hepatocellular carcinoma biomarker GP73[J]. Cancer Biomark, 2012, 11(4):161-171.
[11] Ko KS, Lee M, Koh JJ, et al. Combined administration of plasmids encoding IL-4 and IL-10 prevents the development of autoimmune diabetes in nonobeses diabetic mice[J]. Mol Ther, 2001, 4(4):313-316.
[12] Wang X, Bao W, Liu J, et al. Inflammatory markers and risk of type 2 diabetes: a systematic review and meta-analysis [J]. Diabetes Care, 2013, 36:166-175.
[13] 陳杰, 徐斌, 惠威, 等. 2型糖尿病合并乙型肝炎肝硬化患者不同糖化血紅蛋白水平的血清細胞因子變化及其臨床意義[J]. 中國糖尿病雜志, 2014, 22(2):138-140.
[14] Jain SK, Rains J, Croad J, et al. Curcumin supplementation lowers TNF-alpha, IL-6, IL-8, and MCP-1 secretion in high glucose-treated cultured monocytes and blood levels of TNF-alpha, IL-6, MCP-1,glucose, and glycosylated hemoglobin in diabetic rats[J]. Antioxid Redox Signal, 2009, 11(2):241-249.
[15] 朱華, 徐艷峰, 劉穎, 等. 恒河猴糖尿病動物模型血清及組織中細胞因子的變化[J]. 中國實驗動物學報, 2013, 21(3):53-56.
Changes of Blood Lipid, Blood Glucose and Serum Cytokines in Different Stages of Diabetic Mice
YANG Hua1, LIU Fang1, ZHOU Wen-jiang1,2, ZHOU Xiao-hui1, REN Xiao-nan1
(1. Shanghai Public Health Clinical Center, Shanghai 201508, China;2. School of Pharmacy, Fudan University, Shanghai 201203, China)
ObjectiveTo compare the changes of blood lipid, blood glucose, serum cytokine interleukin - 6 (IL 6) and interleukin 10 (IL-10), tumor necrosis factor - (TNF-α), a gamma interferon (IFN-γ) in mice with type 2 diabetes mellitus (T2DM) during early or late stage, and discuss the meanings of cellular immune function changes in T2DM mouse model. MethodsFourty-six male C57BL/6 mice at the age of 3 weeks were randomly divided into control group and model group (DM group). Animals in the model group were intraperitoneally injected with 50 mg streptozotocin(STZ)for 3 days and fed with high-fat diet. After 6 or 24 weeks injection, glucose tolerance, blood lipid (TG, CHOL,HDLC, LDLC) level and the contents of serum IL-6, IL-10, TNF-α, IFN-γ were measured and analyzed respectively. ResultsSix weeks after injection of STZ, abnormal glucose tolerance was observed in DM mice, with the significant higher level of lipid and serum IL-6, TNF-α, IFN-γ, IL-10 compared with normal control group (P<0.05 or P<0.01). With the development of disease process, the glucose and lipid metabolic disorder aggravated in DM group after 24 weeks of injection, and the levels of serum IL-6,TNF-α, IFN-γ, IL-10 were significantly higher than those of 6 weeks (P<0.01). ConclusionThe STZ induced mouse model showed similar disease process in terms of blood glucose, blood lipids and cytokines changes in the different courses, which might be used as the potential disease animal model.
Diabetic Mice; Streptozotocin; Blood Sugar; Blood Lipid; Cytokine
Q95-33
A
1674-5817(2015)02-0102-05
10.3969/j.issn.1674-5817.2015.02.004
2014-08-25
楊華(1973-), 女, 高級獸醫師, 從事實驗動物科研工作。E-mail: yanghua@shaphc.org
周文江 (1965-), 男, 主任技師, 碩士生導師, 從事實驗動物學的教學、科研及管理工作。E-mail: wjzhou@shmu.edu.cn

