氯化鎘對ZR75-1細胞DNA錯配修復活性的抑制效應
劉曉娟,陳元紅,劉亞,胡啟迪,任湘鵬
(1.溫州醫科大學 環境與公共衛生學院,浙江 溫州 325035;2.溫州醫科大學附屬眼視光醫院 實驗室中心,浙江 溫州 325027)
氯化鎘對ZR75-1細胞DNA錯配修復活性的抑制效應
劉曉娟1,陳元紅1,劉亞2,胡啟迪2,任湘鵬2
(1.溫州醫科大學 環境與公共衛生學院,浙江 溫州 325035;2.溫州醫科大學附屬眼視光醫院 實驗室中心,浙江 溫州 325027)
目的:研究氯化鎘(CdCl2)暴露對人乳腺癌細胞ZR75-1 DNA錯配修復(DNA MMR)活性的影響。方法:用0、10、20、30、40、50 μmol/L的CdCl2對ZR75-1細胞染毒48 h和72 h后,用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)法檢測各組ZR75-1細胞的存活率。以5、10、15 μmol/L的CdCl2分別作用于ZR75-1細胞48 h后,各組平行轉染同源、異源質粒,通過流式細胞術檢測相對熒光表達率來評估各組ZR75-1細胞的DNA MMR活性;同時利用實時熒光定量PCR技術檢測CdCl2暴露后DNA MMR活性相關基因MLH1、MSH2、MSH6、PMS1 mRNA的表達。結果:MTT結果顯示,與對照組相比,10、20 μmol/L CdCl2對ZR75-1細胞的存活率無顯著影響(P>0.05),而30、40、50 μmol/L CdCl2對細胞有顯著毒性作用(P<0.05),且表現出濃度和時間依賴效應。流式細胞術檢測顯示,與對照組相比,5、10、15 μmol/L CdCl2暴露均顯著降低了ZR75-1細胞的DNA MMR活性(P<0.05)。熒光定量PCR技術檢測結果顯示,5、10、15 μmol/L CdCl2處理組中MLH1、MSH2、MSH6、PMS1 mRNA表達水平總體上升,變化趨勢均為隨CdCl2暴露濃度增加先上升后下降。結論:對細胞存活率無影響的CdCl2暴露可顯著抑制ZR75-1細胞的DNA MMR活性,并上調DNA MMR活性相關基因MLH1、MSH2、MSH6、PMS1 mRNA的表達水平。
氯化鎘;ZR75-1細胞;DNA錯配修復
鎘元素是一種生物蓄積性強、毒性持久、具有典型“三致”效應的劇毒重金屬,氯化鎘(CdCl2)是一種廣泛應用于工業中的毒性較高的鎘化合物。近年來鎘污染對人體健康的危害已成為全世界重要的公共衛生學問題,研究證實鎘與人類的多種癌癥有關聯[1],國際癌癥研究協會(IARC)將其列為第1類致癌物。有研究表明,鎘致癌的可能途徑之一是通過干擾機體DNA錯配修復(DNA mismatch repair,DNA MMR)系統的功能[2]。DNA MMR系統廣泛存在于從原核到真核生物體中,是細胞DNA復制后的一種修復機制,它能夠有效保證DNA復制的保真度,維持基因組的穩定性,DNA MMR系統活性的受損與多種腫瘤的發生發展密切相關[3]。本實驗研究采用了一種直接對活細胞DNA MMR活性進行定量分析的模型[4],該模型利用增強型綠色熒光蛋白(enhanced green fluorescent protein,EGFP)基因作為報告基因,構建一對EGFP基因真核表達質粒,包括一個可直接表達綠色熒光的同源質粒,在另一個異源質粒EGFP基因的啟動子處引入一個錯配堿基,只有經過轉染細胞,依靠細胞的DNA MMR系統修復后才能表達綠色熒光。通過檢測異源質粒轉染組與同源質粒轉染組之間的相對熒光表達率,即可定量評估細胞DNA錯配修復活性。利用該模型,本實驗研究了不同劑量的CdCl2染毒處理對乳腺癌細胞ZR75-1 DNA MMR活性的影響,以期明確CdCl2是否可直接干擾細胞的DNA MMR活性。
1 材料和方法
1.1材料
1.1.1細胞株、質粒及菌株:乳腺癌細胞ZR75-1、紅色熒光蛋白(RFP)表達質粒、EGFP表達質粒p111及突變型EGFP表達質粒p189由美國德州大學健康科學中心孫魯浙教授饋贈,p189質粒在EGFP編碼區第58位引入一個終止密碼子(TGG58-TAG),不能表達EGFP。基因工程菌E.coli DH5α及JM109感受態菌(碧云天生物科技有限公司)。
1.1.2主要試劑:CdCl2標準品(純度為99%,Sigma公司),3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT,純度為98%,Sigma公司),DMEM培養基、無支原體胎牛血清(美國GIBCO公司),Lipofectamine 2000(美國Invitrogen公司),質粒大量抽提試劑盒及內切酶Mlu I(碧云天生物科技有限公司),輔助噬菌體M13(New England Biolabs公司),Plasmid-Safe ATP-Dependent DNase(PSAD酶,EPICENTER Biotechnologies公司),Duplex-specific nuclease(DSN酶,俄國Evrogen公司),外切核酸酶ExoI I I及缺刻酶Nb.Bpu10I(德國Fermentas公司),反轉錄試劑盒及熒光定量PCR試劑盒(大連寶生物工程有限公司)。
1.1.3主要設備:CO2細胞培養箱、全波長酶標儀及NanoDrop 2000超微量分光光度計(美國Thermo Forma公司),5417R臺式低溫高速離心機及實時熒光定量PCR儀(德國Eppendorf公司),JS-380C凝膠成像系統(上海培清生物科技公司),恒溫振蕩培養箱及細菌恒溫培養箱(寧波江南儀器廠),倒置熒光顯微鏡(日本Nikon公司),流式細胞儀(美國BD Biosciences公司)。
1.2方法
1.2.1藥物配置:CdCl2用無菌去離子水配制成濃度為1 000 mmol/L的CdCl2母液,用封口膜密封好后保存于4 ℃冰箱。實驗前將CdCl2母液加入細胞培養基中震蕩混勻,配制成2倍工作濃度的工作液,即濃度分別為0(對照組)、20、40、60、80、100 μmol/L。將MTT粉末充分溶解于1×PBS溶液中,配制成2 mg/ mL的MTT溶液,過濾除菌后于4 ℃避光保存。
1.2.2細胞培養及染毒:ZR75-1細胞用DMEM高糖培養基(4 500 mg/L葡萄糖),添加10%胎牛血清,置于37 ℃ 5%的CO2培養箱培養。待細胞貼壁密度為80%左右時,將細胞接種到96孔細胞培養板中,每孔加入50 μL新鮮培養基。待細胞貼壁后,每孔加入50 μL 2倍濃度的CdCl2工作液,充分混勻,至暴毒終濃度分別為:0(對照組)、10、20、30、40、50 μmol/L。
1.2.3MTT法測定ZR75-1細胞存活率:CdCl2暴毒48 h和72 h后取出96孔板,每孔加入50 μL 2 mg/mL 的MTT溶液,放回培養箱繼續培養3~4 h。用真空抽濾器將孔中液體吸出,每孔加入200 μL DMSO,于震蕩器上振蕩5~10 min,使細胞生成的藍紫色結晶甲瓚(Formazan)完全溶解到DMSO中,使用酶標儀在570 nm下測量各孔吸光值。以各組平均吸光度值(OD570)反映細胞存活及增殖狀態,OD570值越高,則細胞數目越多,活力越高。以各暴毒組吸光度值(OD)/對照組細胞吸光度值(OD)×100%作為細胞的存活率(survival rate)。實驗重復3次。
1.2.4同源和異源質粒的制備[5-6]:以p111為底物,使用輔助噬菌體M13,用缺刻酶Nb.Bpu10I和外切核酸酶ExoI I I消化,并使用DSN酶純化,回收后得到單鏈環狀的p111編碼股(“+”鏈);以p111和p189為底物,用內切酶Mlu I酶切,濃縮回收得到線性化質粒DNA。將單鏈環狀的p111(“+”鏈)分別與線性化p111和p189分子按照1.5∶1摩爾比混合退火,形成帶一個缺刻環狀的同源和異源雙鏈核酸分子。加入PSAD酶消化,降解去除多余單鏈分子和雙鏈線性分子,純化回收后得到高純度缺刻環狀的同源和異源質粒。在此缺刻型環狀異源質粒EGFP基因的啟動子區存在一個引入的T/G錯配。
1.2.5流式細胞術定量檢測ZR75-1細胞的DNA MMR活性[4]:將生長狀態良好的ZR75-1細胞接種于6孔板,培養基更換成含CdCl2濃度為0、5、10、15 μmol/L的培養基。CdCl2暴毒48 h后,采用Lipofectamine 2000脂質體介導的轉染方法,將等量的同源或異源質粒與RFP表達質粒共轉染ZR75-1細胞,RFP表達質粒用來校正同源和異源質粒組的轉染效率。轉染24 h后,在熒光顯微鏡下觀察熒光蛋白的表達,用37 ℃預熱的胰酶處理活細胞,1 000 r/min離心4 min,棄除上清液,加入1×PBS清洗,用PBS溶解制成單細胞懸液。用流式細胞儀檢測表達綠色熒光的細胞百分率(% Gated),以及表達綠色熒光細胞的平均熒光強度(mean)。細胞的DNA MMR活性大小可由相對綠色熒光表達率(relative EGFP expression)來反映,計算公式為:(異源質粒轉染組% Gated×mean)/(同源質粒轉染組% Gated×mean)。實驗重復3次。
1.2.6Real-time PCR法檢測ZR75-1細胞DNA MMR相關基因的表達:分別收集經5、10、15 μmol/L CdCl2處理48 h后的ZR75-1及對照組細胞,TRIzol法提取總RNA,溶解于DEPC水。RNA樣品在1.2%瓊脂糖凝膠上電泳,在紫外燈下觀察出現清晰集中的28S、18S、5S三條帶,且28S/18S約為2∶1,證實RNA樣品完整性較好。同時檢測OD值,OD260/OD280值均大于1.8,證實RNA樣品純度較好;測定并調整RNA濃度為1 μg/L。反轉錄反應體系為:5×RT Buffer 4 μL,Reverse Transcriptase 1 μL,Rnase Inhibitor 1 μL,Random Primer 1 μL,RNA 1 μL,Rnase-free Water 12 μL;反轉錄反應條件為:25 ℃ 5 min,37 ℃60 min,75 ℃ 5 min,cDNA產物置于-20 ℃保存。Real-time PCR引物序列如表1所示,均委托上海生工合成。反應體系為:2×mix 10 μL,上下游引物各0.5 μL,cDNA 2 μL,加水至20 μL。反應條件:95 ℃預變性1 min,94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸20 s,共40個循環。每個基因每次設3個平行重復,所有樣品均設置陰性對照(無模板)以排除假陽性。實驗數據用??CT定量方法分析,實驗重復3次。

表1 Real-time PCR檢測的基因及引物序列
1.3統計學處理方法 采用SPSS16.0軟件進行統計分析。實驗數據以±s表示,所有數據進行正態性及方差齊性檢驗,方差齊性者多組樣本均數比較采用單因素方差分析,兩兩比較采用LSD法,方差不齊者進行Kruskal-Wallis檢驗。P<0.05為差異有統計學意義。
2 結果
2.1CdCl2對ZR75-1細胞存活率的影響 MTT法檢測結果(見表2)顯示,10、20、30、40、50 μmol/L CdCl2暴露48 h和72 h后,與對照組相比,10、20 μmol/L CdCl2對ZR75-1細胞的活力沒有明顯影響(均P>0.05);30、40、50 μmol/L CdCl2對細胞有明顯抑制作用,細胞活力呈現顯著下降(均P<0.05)。與同濃度CdCl2暴露48 h組相比,40及50 μmol/L CdCl2暴露72 h組ZR75-1細胞活力均顯著下降,差異有統計學意義(均P<0.05)。可見,CdCl2降低乳腺癌細胞ZR75-1的生存率呈現出濃度和時間依賴方式。
2.2單鏈DNA及同源和異源質粒的制備情況 如圖1所示,本實驗獲得了純度較高的單鏈DNA及同源和異源質粒。
2.3CdCl2對ZR75-1細胞DNA MMR活性的影響 流式細胞儀定量檢測ZR75-1細胞綠色熒光表達情況,如表3所示。與對照組相比,5、10、15 μmol/L CdCl2暴露后,ZR75-1細胞的相對熒光表達率均顯著下降,差異有統計學意義(均P<0.01),表明高于5 μmol/L CdCl2暴露濃度可顯著抑制ZR75-1細胞DNA MMR活性,且抑制作用呈現濃度依賴方式。10、15 μmol/L組細胞的相對熒光表達率大致相當。
表2 不同濃度CdCl2對ZR75-1細胞活力及存活率的影響(±s)
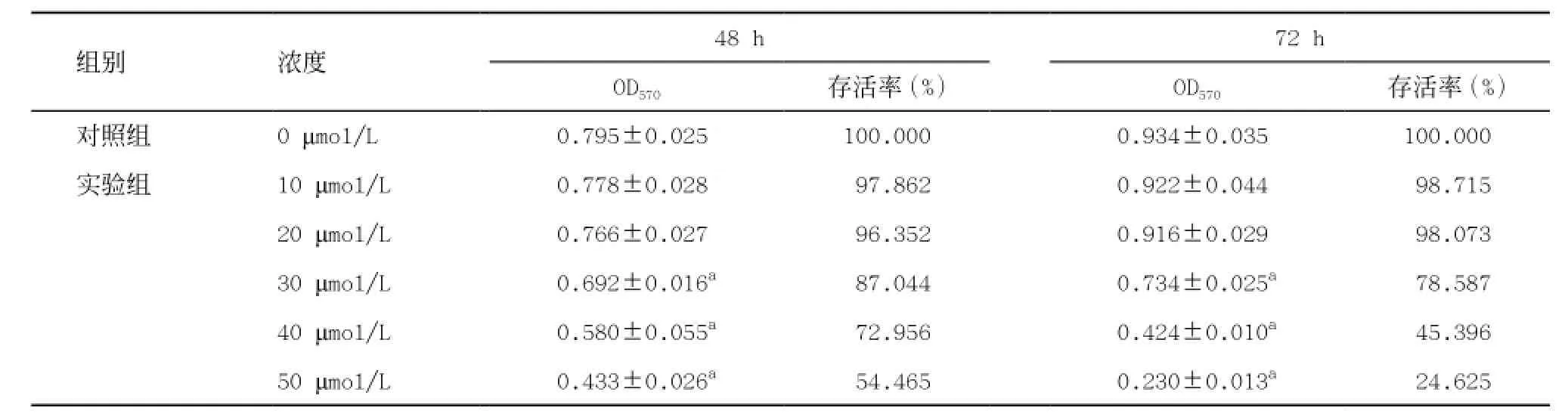
表2 不同濃度CdCl2對ZR75-1細胞活力及存活率的影響(±s)
與同一時間對照組比:aP<0.05
72 h OD570 存活率(%) OD570 存活率(%)對照組 0 μmol/L 0.795±0.025a 100.000 0.934±0.035a 100.000實驗組 10 μmol/L 0.778±0.028a 97.862 0.922±0.044a 98.715 20 μmol/L 0.766±0.027a 96.352 0.916±0.029a 98.073 30 μmol/L 0.692±0.016a 87.044 0.734±0.025a 78.587 40 μmol/L 0.580±0.055a 72.956 0.424±0.010a 45.396 50 μmol/L 0.433±0.026a 54.465 0.230±0.013a 24.625組別 濃度 48 h
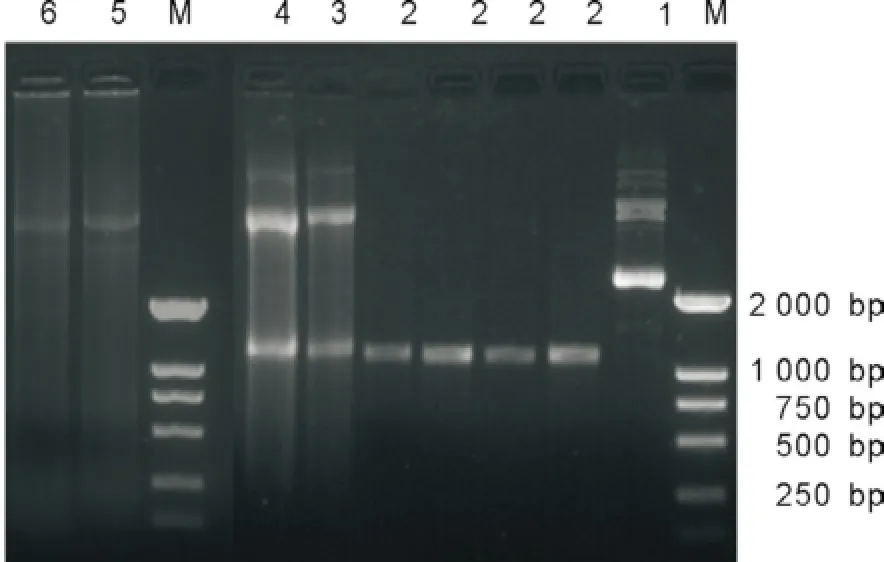
圖1 單鏈DNA及同源和異源質粒的制備電泳圖
2.4CdCl2對ZR75-1細胞DNA MMR相關基因表達的影響 Real-time PCR法測定每組樣本中每一個基因的△Ct值,然后計算出2-△△Ct(見表4)。結果表明,用5、10、15 μmol/L CdCl2暴毒ZR75-1細胞48 h后,隨著暴毒濃度的增加,MMR相關基因MLH1、MSH2、MSH6、PMS1的相對表達量均為先上升后略微下降,但整體為上升趨勢。5 μmol/L CdCl2處理組中,MSH6和PMS1基因mRNA的相對表達水平顯著上調,與對照組相比差異有統計學意義(P<0.05);MLH1和MSH2基因mRNA的相對表達水平也呈上升趨勢,但與對照組相比差異無統計學意義(P>0.05)。4個DNA MMR相關基因mRNA的相對表達水平在10 μmol/L CdCl2處理組中均顯著上調(均P<0.05),且達到最高峰。15 μmol/L CdCl2處理組中,MSH6和PMS1基因mRNA的相對表達水平顯著提高(P<0.05);MLH1 和MSH2基因表達水平略微變化,但差異無統計學意義(P>0.05)。
3 討論
DNA MMR系統廣泛存在于生物體中,主要起維持基因組穩定的作用,它是繼癌基因與抑癌基因后被確認的第三類腫瘤相關基因,大約70%的人類腫瘤均與DNA MMR基因的突變或缺陷造成的活性降低密切相關[7-8]。許多環境中的化學污染物可直接以DNA MMR基因為作用靶標,使細胞DNA MMR活性受到干擾甚至喪失,這可能是很多化學物致癌的共同機制之一[3]。已有研究表明,鎘致癌的可能途徑之一是通過干擾細胞DNA MMR系統[2],鎘暴露可以抑制烷基化損傷后DNA MMR系統介導的細胞周期停滯[9]。但是,鎘是否可以直接抑制DNA MMR系統的活力這一關鍵結論鮮見報道。
表3 不同濃度CdCl2對ZR75-1細胞相對熒光表達率的影響(±s)
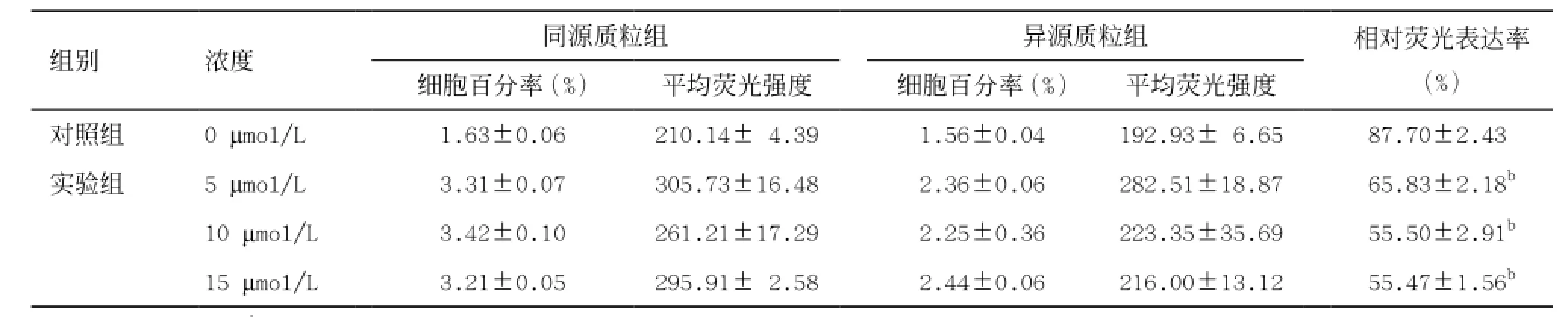
表3 不同濃度CdCl2對ZR75-1細胞相對熒光表達率的影響(±s)
與同一時間對照組比:bP<0.01
組別 濃度 同源質粒組 異源質粒組 相對熒光表達率(%)細胞百分率(%) 平均熒光強度 細胞百分率(%) 平均熒光強度對照組 0 μmol/L 1.63±0.06 210.14± 4.39 1.56±0.04 192.93± 6.65 87.70±2.43b實驗組 5 μmol/L 3.31±0.07 305.73±16.48 2.36±0.06 282.51±18.87 65.83±2.18b10 μmol/L 3.42±0.10 261.21±17.29 2.25±0.36 223.35±35.69 55.50±2.91b15 μmol/L 3.21±0.05 295.91± 2.58 2.44±0.06 216.00±13.12 55.47±1.56b
表4 不同濃度CdCl2暴露48 h后ZR75-1細胞DNA MMR相關基因mRNA的2-△△Ct(±s)
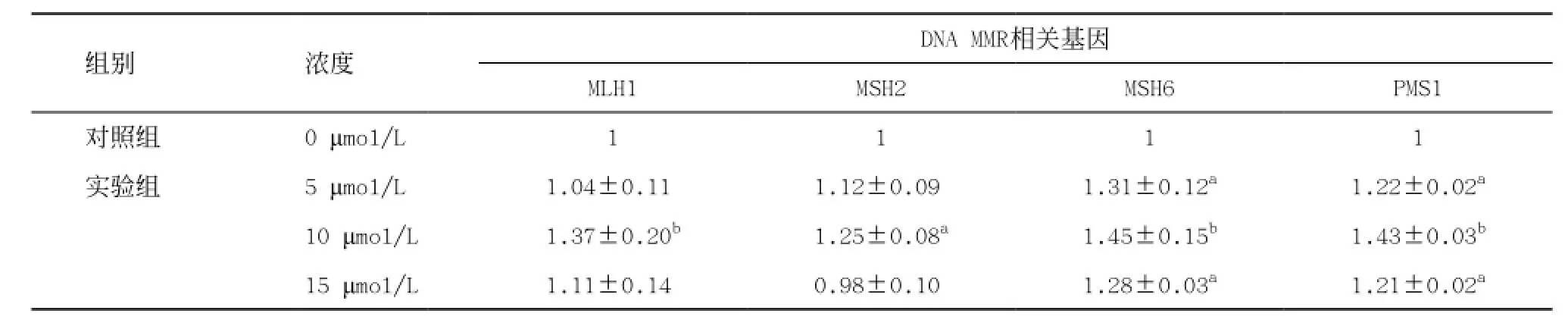
表4 不同濃度CdCl2暴露48 h后ZR75-1細胞DNA MMR相關基因mRNA的2-△△Ct(±s)
與對照組比:aP<0.05,bP<0.01
組別 濃度DNA MMR相關基因MLH1 MSH2 MSH6 PMS1對照組 0 μmol/L 1 1 1 1實驗組 5 μmol/L 1.04±0.11b 1.12±0.09b 1.31±0.12a 1.22±0.02a10 μmol/L 1.37±0.20b 1.25±0.08a 1.45±0.15b 1.43±0.03b15 μmol/L 1.11±0.14b 0.98±0.10b 1.28±0.03a 1.21±0.02a
本研究利用美國德州大學健康科學中心孫教授研究團隊建立的一種直接定量分析活細胞DNA MMR活性的模型[4],研究了不同劑量的CdCl2染毒處理對乳腺癌細胞ZR75-1 DNA MMR活性的影響。結果表明,對ZR75-1細胞生存率無明顯影響的CdCl2暴露濃度(5、10、15 μmol/L)即可對其DNA MMR活性產生了顯著的抑制效應(均P<0.01),且抑制作用呈現濃度依賴方式。本研究結果首次證實CdCl2可直接抑制活細胞的DNA MMR活力,為進一步確認CdCl2通過干擾DNA MMR活性這一致癌機制提供實驗佐證。與本研究類似,典型環境致癌物苯并芘以濃度依賴方式抑制人乳腺癌細胞的DNA MMR活力,在1、5 μmol/L暴露時可顯著抑制ZR75-1細胞的DNA MMR活性[10]。這些研究結果提示,細胞DNA MMR活性有可能作為一種敏感特異的生物標志物,用于環境污染物致癌性的快速初篩。
值得注意的是,本研究中對照組ZR75-1細胞的相對熒光表達率為0.877,小于1(理論上正常細胞的相對熒光表達率為1),這和Chen等[10]報道的ZR75-1細胞的DNA MMR活力大小基本一致,可能是因為ZR75-1本身為腫瘤細胞,其DNA MMR活力已有少部分受損。另外,Lei等[4]的研究結果顯示,人宮頸癌細胞Hela和人結腸癌細胞HCT116的相對熒光表達率分別為0.954和0.173,表明HCT116細胞的DNA MMR活力受損嚴重。我們研究過人正常肝細胞QSG-7701的DNA MMR活力,其相對熒光表達率為0.986,說明人正常細胞的DNA MMR活力比腫瘤細胞要強,這也從側面驗證了DNA MMR活力與腫瘤發生發展的密切關系。
為進一步明確CdCl2對細胞DNA MMR活性的干擾效應,本研究利用實時熒光定量PCR技術檢測了不同濃度CdCl2暴露后DNA MMR活性相關基因MLH1、MSH2、MSH6、PMS1 mRNA水平的表達情況。結果表明,5、10、15 μmol/L CdCl2暴毒ZR75-1細胞48 h后,上述4種基因的相對表達量為先上升后略微下降,整體為上升趨勢。其原因可能是CdCl2直接抑制了細胞DNA MMR活力[2],但細胞仍需要維持其基因組的穩定性,因而通過細胞內部調控體系增加MMR相關基因的表達來補償。
有文獻報道Cd2+可以與Zn2+競爭某些酶活性部位而抑制酶活性[11]。在人體DNA錯配修復過程中,hMSH2和hMSH6蛋白會形成酶復合物hMutSα,hMSH2 和hMSH3蛋白形成酶復合物hMutSβ[7],這兩種酶復合物活性的激活依賴Zn2+的結合,Cd2+可通過與Zn2+競爭酶復合物hMutSα、hMutSβ的活性部位,抑制hMSH2-hMSH6復合物的酶活性,從而抑制DNA MMR活性[11]。究竟CdCl2通過哪些途徑和方式抑制細胞DNA MMR活性,其具體分子機制還需要進一步研究。
[1]Huff J, Lunn RM, Waalkes MP, et al. Cadmium-induced cancers in animals and in humans[J]. Int J Occup Environ Health, 2007, 13(2): 202-212.
[2]Jin YH, Clark AB, Slebos RJ, et al. Cadmium is a mutagen that acts by inhibiting mismatch repair[J]. Nat Genet, 2003,34(3): 326-329.
[3]Peltom?ki P. DNA mismatch repair and cancer[J]. Mutat Res, 2001, 488(1): 77-85.
[4]Lei X, Zhu Y, Tomkinson A, et al. Measurement of DNA mismatch repair activity in live cells[J]. Nucleic Acids Res,2004, 32(12): e100.
[5]Zhou B, Huang C, Yang J, et al. Preparation of heteroduplex enhanced green fluorescent protein plasmid for in vivo mismatch repair activity assay[J]. Anal Biochem, 2009, 388(1): 167-169.
[6]Zhou B, Dong Q, Ma R, et al. Rapid isolation of highly pure single-stranded DNA from phagemids[J]. Anal Biochem,2009, 389(2): 177-179.
[7]Kunkel TA, Erie DA. DNA mismatch repair[J]. Annu Rev Biochem, 2005, 74: 681-710.
[8]劉卓, 吳建新. DNA錯配修復系統組成和功能的研究進展[J]. 現代生物醫學進展, 2008, 8: 1160-1165.
[9]Lützen A, Liberti SE, Rasmussen LJ. Cadmium inhibits human DNA mismatch repair in vivo[J]. Biochem Biophys Res Commun, 2004, 321(1): 21-25.
[10]Chen Y, Huang C, Bai C, et al. Benzo [α]pyrene repressed DNA mismatch repair in human breast cancer cells[J]. Toxicology, 2013, 304(2): 167-172.
[11]Wieland M, Levin MK, Hingorani KS, et al. Mechanism of cadmium-mediated inhibition of Msh2-Msh6 function in DNA mismatch repair[J]. Biochemistry, 2009, 48(40): 9492-9502.
(本文編輯:胡苗苗)
The inhibitory effect of CdCl2on DNA mismatch repair activity in ZR75-1 cells
LIU Xiaojuan1, CHEN Yuanhong1, LIU Ya2, HU Qidi2, REN Xiangpeng2.
1.School of Public Health and Environment, Wenzhou Medical University, Wenzhou, 325035; 2.Laboratory Center, Ophthalmology and Eye Hospital Affiliated to Wenzhou Medical University, Wenzhou, 325027
Objective: To study the effects of CdCl2on the DNA mismatch repair (DNA MMR) activity in human breast cancer cells ZR75-1. Methods: MTT assay was used to detect the survival rate of ZR75-1 cells exposed 48 and 72 h to 0, 10, 20, 30, 40, 50 μmol/L CdCl2. The cells from 5, 10, 15 μmol/L CdCl2exposure (48 h) and control group were parallelly transfected with homoduplex and heteroduplex plasmids, flow cytometry analysis was then carried out to quantitatively measure the relative EGFP expression (indirectly reflected DNA MMR activity) in ZR75-1 cells of each groups. Meanwhile, real-time fluorescent quantitative PCR technique was used to detect the mRNA expression of DNA MMR related genes (MLH1, MSH2, MSH6 and PMS1) after exposure 48 h to 5, 10, 15 μmol/L CdCl2. Results: 10, 20 μmol/L CdCl2exhibited no influence on ZR75-1 cell survival (P>0.05), while cells exposed to 30, 40 and 50 μmol/L CdCl2displayed significant mortality which showed obvious dose-dependent and time-dependent manner (P<0.05). Compared with control group, 5, 10 and 15 μmol/L CdCl2exposure induced significant inhibition of DNA MMR activity in ZR75-1 cells (P<0.05). Real-time PCR results showed that after exposure to 5, 10 and 15 μmol/L CdCl2for 48 h, the mRNA expression of detected genes (MLH1, MSH2, MSH6 and PMS1) was increased as a whole, which presented down after rising first with CdCl2exposure concentration increase. Conclusion: Low dose of CdCl2exposure which showed no effect on cell survival can represse DNA MMR activity in ZR75-1 cells, and up-regulate the mRNA expression of DNA MMR related genes.
CdCl2; ZR75-1 cells; DNA mismatch repair
R994.6
A DOI: 10.3969/j.issn.2095-9400.2015.11.003
2015-04-22
浙江省大學生科技創新活動計劃(新苗人才計劃)項目(2011R413049);溫州市科技局科研基金資助項目(H201100 18)。
劉曉娟(1987-),女,湖南婁底人,實驗員,碩士。
任湘鵬,副研究員,Email:renxpeng@wmu.edu.cn。

