精子形態對體外受精結局的影響
廖宏慶 聶玉林* 趙 魁 李 銳1.南華大學附屬第二醫院(湖南衡陽 41001); .南華星輝生殖健康專科醫院; . 婁底市中心醫院
精子形態對體外受精結局的影響
廖宏慶1,2聶玉林2*趙 魁3李 銳2
1.南華大學附屬第二醫院(湖南衡陽 421001); 2.南華星輝生殖健康專科醫院; 3. 婁底市中心醫院
目的 探討精子形態對常規體外受精(IVF)及單精子卵胞漿內注射(ICSI)周期的受精率、卵裂率、優胚率及妊娠率的影響。方法 將2011年6月至2014年6月在我院行IVF/ICSI治療的周期根據精子形態進行分組:IVF周期分為A組(正常精子形態<2%),B組(2%≤正常精子形態<4%),C組(正常精子形態≥4%);ICSI周期分為D組(正常精子形態<2%),E組(2%≤正常精子形態<4%),F組(正常精子形態≥4%),分別比較各組間受精率、卵裂率、優胚率及妊娠率的差異。 結果 IVF周期中C組受精率顯著高于B組和A組,差異具統計學意義(P<0.05),卵裂率、優胚率及妊娠率在A、B、C組之間則無顯著性差異(P>0.05);ICSI周期中D組、E組、F組受精率、卵裂率、優胚率及妊娠率無顯著性差異(P>0.05)。 結論 畸形精子癥會影響IVF周期的受精率,對ICSI周期的受精率無顯著性影響。
精子/畸形; 精子注射, 細胞質內; 治療結果
2010年《WHO人類精液檢查與處理實驗室手冊》第五版[1]對精子形態作了詳細的判斷標準,同時根據近12個月讓女性自然受孕的男性受試者的精液樣本,以95%的可信區間定義了精子形態學參考值。精子正常形態百分率低反映了精子生成或成熟過程存在某些異常,然而當精子濃度較高時,正常形態精子總數也能達到較高水平,同時形態正常的精子并不一定具有正常的精子功能,因此一直以來使用精子形態來預測精子功能存在爭議[2-4]。
近年體外受精技術得到迅速的發展,已成為治療不孕不育的常用手段,而體外受精對男性精液的要求與自然受精具有一定的差別,尤其是單精子卵胞漿內注射,對精子的要求更低,但是研究發現某些特殊類型的精子,仍可導致全部卵子受精失敗、全部卵子異常受精或者胚胎發育異常[5]。本研究回顧性的分析了精子形態對IVF/ICSI結局的影響,從而為男性不育治療提供參考。
對象與方法
一、研究對象
收集南華星輝生殖健康專科醫院2011年6至2014 年6月行常規體外受精及單精子卵胞漿內注射(IVF/ ICSI)助孕的684個周期,所有周期均為采用長方案和超長方案進行促排卵,男方禁欲2~7d取精。
二、分組
將IVF周期根據精子形態分為A組(正常精子形態<2%)、B組(2%≤正常精子形態<4%)和C組(正常精子形態≥4%) 3組;將ICSI周期根據精子形態分為D組(正常精子形態<2%)、E組(2%≤正常精子形態<4%)和F組(正常精子形態≥4%)。
三、精子形態學分析
精液液化后進行精子計數,根據精子濃度取0.1~0.5mL精液置于1.5mL EP管中,用生理鹽水清洗、離心兩遍,棄上清,留取0.5mL底層混勻,制片,根據嚴格的精子形態學標準進行評估,每份精液樣本制片兩張,經過兩位熟練的閱片者審閱,每次計數200個以上精子(極度少精子癥者除外),計算出正常形態精子比例。
四、受精及胚胎培養
女方注射絨毛膜促性腺激素(HCG)后(35±1)h,在B超下經陰道介導取卵,在體視顯微鏡下找到的卵丘-卵母細胞復合體(OCCC)裝于2003管中,3~5個卵子/管,管中為1mL 90%的處理液G-IVF。擰松管蓋置于濃度為6%的CO2、溫度為37.0℃的培養箱中平衡。
IVF受精及培養:注射HCG后(39.5±0.5)h 授精,先將1.0×105個精子加入裝有1mL 90%GIVF的2003管中,將卵子轉移至已加入精子的2003管中。精卵混合培養(17±0.5)h 觀察原核形成情況,然后在已經過CO2濃度為6%、溫度為37.0℃培養箱中平衡過的95%的G1(為卵裂期胚胎培養基)中培養,(65±1)h 觀察胚胎情況。
ICSI受精及培養:注射HCG后(40±0.5)h 用透明質酸酶將卵子顆粒細胞去掉,經95%G-MPOS洗滌后置于1006皿的95%G-MPOS小滴中,注射HCG后(41.5±0.5)h 將精子在PVP中制動,在95% G-MPOS小滴中對MⅡ卵子行ICSI。授精后(16±0.5)h 觀察原核形成情況,然后在已經過CO2濃度為6%、溫度為37.0℃培養箱中平衡過的95%的G1中培養,(65±1)h觀察胚胎情況。
五、統計學分析
結 果
一、各組的基本情況對比
A組、B組、C組之間的女方年齡、男方年齡、女方體質量指數(BMI)、女方不孕年限、原發不孕比例、內膜厚度及回收卵數均無明顯差異;D組、E組、F組之間的女方年齡、男方年齡、女方BMI指數、女方不孕年限、內膜厚度及回收卵數也無明顯差異。D組較E組和F組的女方原發不孕比例稍高一點,這主要受男方因素影響,見表1。
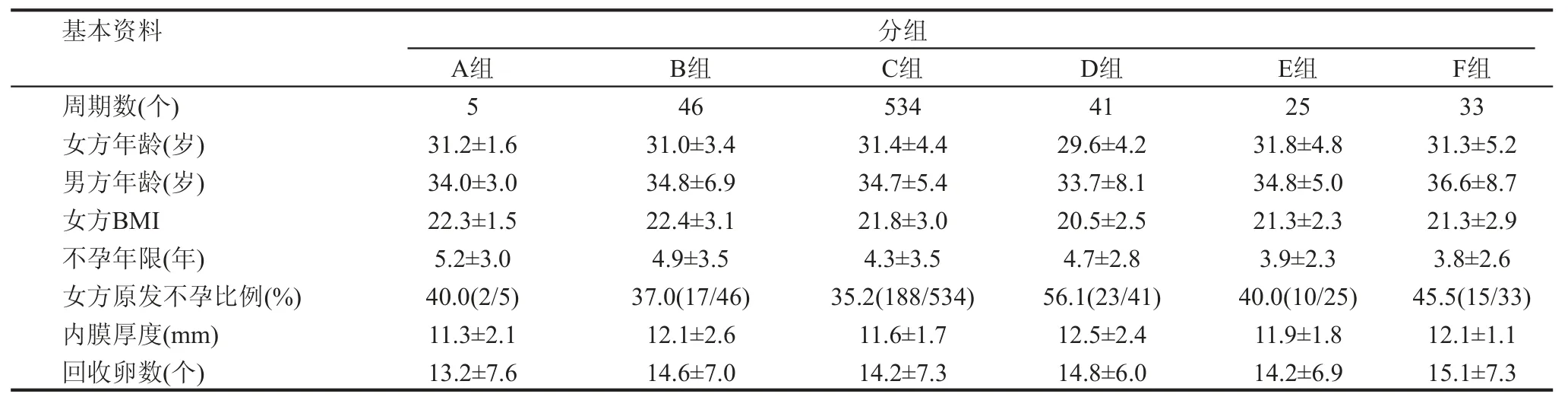
表1 6組的基本情況表
二、各組之間體外受精結局的比較
1. A、B、C三組之間受精率具有顯著性差異(P<0.05),而其他指標無顯著性差異(P> 0.05),見表2。
2. D組、E組、F組ICSI受精率、卵裂率、優胚率、妊娠率無顯著性差異(P>0.05),見表3。
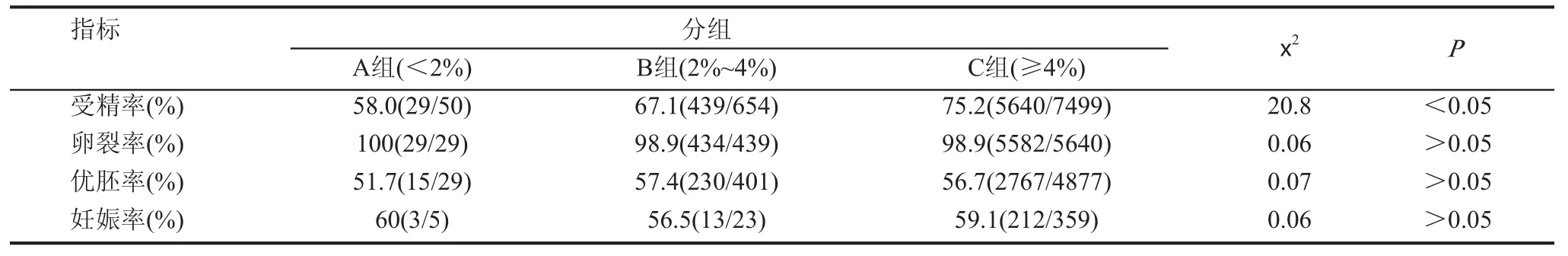
表2 A、B、C 3組各項IVF數據結果
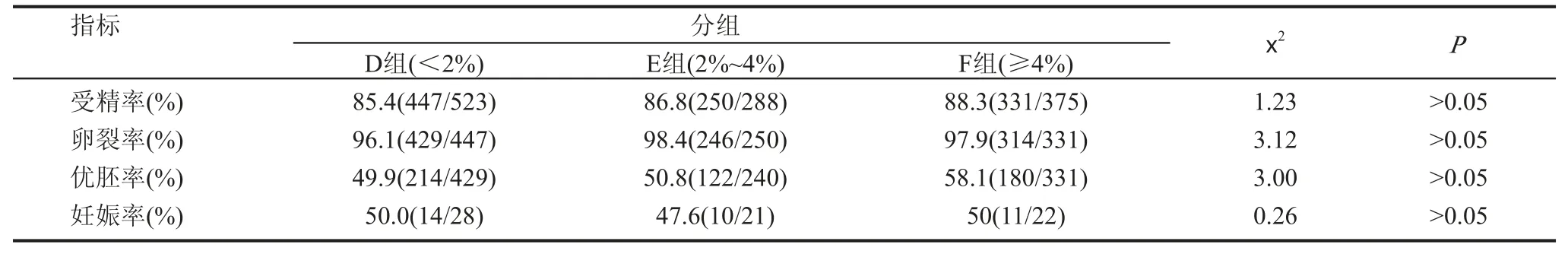
表3 D、E、F 3組的各項ICSI數據結果
討 論
精子形態學評估已經成為男性不育檢查的常規項目之一,在WHO第五版《人類精液檢查與處理實驗室手冊》推出以來,這種標準的精子形態檢查程序和嚴格的精子形態學評估方法已經被各個男科實驗室所采納,同時男科學實驗室質量控制和室間質評也大大的提高了精子形態學評估的精確性和準確性,然而精子形態只能在一定程度上反映精子的質量,并不能準確地預估精子功能,因此,值得我們探討的問題是:在精子形態中究竟是哪個指標主要影響了體外受精。
本研究結果表明,按照嚴格的精子形態學標準評估精子形態,在常規體外受精中隨著精子正常形態百分率增加,A組、B組、C組受精率呈逐漸升高的趨勢,其差異具有統計學意義,這與Lundin等[6]的研究相符。 當精子在生成和成熟的過程中存在某種異常,就可能造成大量的畸形精子產生,而這些畸形精子可能存在染色體缺陷、基因缺陷、精子DNA碎片增多、精子結構或亞細胞結構異常、精子蛋白異常等[5],從而影響精子的正常功能。IVF治療中與受精關系最密切的精子結構是精子頂體和精子的尾部,精子頂體區含有與卵子結合的蛋白和頂體酶系,而精子尾部的中段含有微管微絲及線粒體[7],精子尾部的這些結構是精子運動的前提。當精子出現這些部位異常的時候,就會出現受精率下降甚至完全不受精。另外,當精子異常形態比例較高時,存在精子內部結構和功能異常的概率也會較高。然而ICSI周期中,各組的受精率無統計學差異,可能因為ICSI是將精子直接注射到卵胞漿內,不需要精子游動到卵子透明帶周圍與卵子透明帶發生黏附、識別和穿透,因此,精子的這些缺陷可以在一定程度上被彌補。而且,使用嚴重的畸形精子甚至不成熟精子和精子細胞都有成功的報道[8],說明精子形態對ICSI 受精的影響有限。
當精子頭部核區出現空泡、過大、過小、形態嚴重異常,這可能導致精子的遺傳物質出現異常,而精子遺傳物質異常則可導致受精及胚胎發育及妊娠預后異常。然而本研究表明,A組的優胚率和妊娠率雖然低于B組與C組,但是其差異不具有顯著性,同時在ICSI的C組與D組、E組中同樣存在此現象。說明了具有受精能力的精子,其出現遺傳物質異常的概率下降。在最近幾年,活動精子細胞器形態學檢查(motile sperm organelle morphology examination,MSOME)技術和胞質內形態學選擇精子注射(intracytoplasmic morphologicall selected injection,IMSI)技術應用于輔助生殖技術領域。有研究表明通過這項技術選擇的無空泡精子用于受精,能夠得到更優質的胚胎、更高的著床率和妊娠率[9],說明存在空泡的精子對胚胎發育是有影響的。另外,一些特殊精子形態異常,如圓頭精子癥[10]等,可導致IVF甚至ICSI完全受精失敗,但是諸如此類的精子發生率非常罕見,因此對整體的影響并不大,即便是形態正常的精子也不能排除精子存在功能上的缺陷。另一方面某些形態異常的精子并非意味著精子功能一定存在異常,有可能與個體差異有關[11]。而且“WHO第五版《人類精液檢查與處理實驗室手冊》對于精子形態的評估,尚不能評估精子細胞器的缺陷,更不能發現精子更細微的結構異常。
從本研究結果來看,精子正常形態百分率對IVF受精率的影響較為明顯。然而由于在IVF/ICSI技術中,用于受精的精子均通過了精液處理技術,將活力較好的精子優選出來,可在一定程度上將形態異常的精子去除,而且這種篩選方法因精液樣本的不同也可能存在差異,同時正常形態精子百分率反映的是比例,當精子濃度、活力均較高時,正常形態精子總數仍可能較多。因此,今后有必要在處理后正常形態精子總數對體外受精結局的影響方面作進一步的研究。
1 World Health Organization. Laboratory Manual for the Examination and Processing of Human Semen. 5th ed. geneva: World Health Organization, 2010: 7-124
2 Ghirelli-Filho M, Mizrahi FE, Pompeo AC, et al. In uence of strict spermmorphology on the results of classic in vitro fertilization. Int Braz J Urol 2012; 38(4): 519-28
3 Demir B, Arikan II, Bozdag G, et al. Effect of sperm morphology on clinical outcome parameters in ICSI cycles. Clin Exp Obstet Gynecol 2012; 39(2): 144-146
4 Kruger TF, Coetzee K. The role sperm morphologyin assisted reproducti-on. Hum Reprod 1999; 5(2): 172-178
5 Menkveld R. Clinical significance of the low normal sperm morphology value as proposed in the fth edition of the WHO Laboratory Manual for the Examination and Processing of Human Semen. Asian J Androl 2010; 12(4): 47-58
6 Lundin K, S?derlund B, Hamberger L. The relationship between sperm morphology and rates of fertilization,pregnancy and spontaneous abortion in an in-vitro fertilization/intracytoplasmic sperm injection programme. Hum Reprod 1997; 12(12): 2676-2681
7 熊承良, 吳明章, 劉繼紅, 等. 人類精子學. 武漢:湖北科學技術出版社, 52-69
8 陸金春. 精子形態學分析的標準化與質量控制. 臨床檢驗雜志 2012; 30(10): 834-836,841
9 Wilding M, Coppola G, Matteo L, et al. Intracytoplasmic injection of morphologically selected spermatozoa ( IMSI)improvesoutcome after assisted reproduction by deselecting physiologicallypoor quality spermatozoa. J Assist Reprod Genet 2011; 28(3): 253-262
10 黃東,蔣凌英,徐維海. 圓頭精子受精能力、胚胎發育潛能及遺傳風險的研究. 中華醫學雜志 2010; 90(33): 2351-2353
11 Franken DR, Oehninger S. Semen analysis and sperm function testing. Asian J Androl 2012; 14(2): 6-13
(2015-05-21收稿)
The in uence of sperm morphology on IVF/ICSI outcome
Liao Hongqing1,2, NieYulin2*, Zhao Kui3, Li Rui2
1.The Second Af liated Hospital of the University of South China, Hengyang 421001, Hunan, China
2. Nanhua Xinghui Reproductive Healt Hospital; 3.The Center Hospital of Lou Di Corresponding author: NieYulin, E-mail: nieyulin200520@sina.com
Objective To investigate the effects of sperm morphology on the fertilization rate, cleavage rate, embryo rate and pregnancy rate of conventional in vitro fertilization (IVF) or intracytoplasmic sperm injection (IVF/ICSI) cycles. Methods The patients who received the IVF/ICSI treatment cycles from June 2011 to June 2014 in our hospital, were divided into groups according to sperm morphology: IVF cycles is divided into group A (normal sperm morphology < 2%)and group B (2% or less of normal sperm morphology < 4%), group C (normal sperm morphology 4% or higher); ICSI cycles divided into D group (normal sperm morphology group < 2%), E (2% or less of normal sperm morphology < 4%),group F (normal sperm morphology 4% or higher). The fertilization rate, cleavage rate, optimal embryo rate, pregnancy rate between differences groups were comparatively analyzed. Results In the IVF cycles,the fertilization rate of group C was signi cantly higher than that of group A and group B. There were no signi cant difference between the group A, B,and C in the cleavage rate, optimal embryo rate and pregnancy rate; In the ICSI cycles, there were no signi cant difference between the group D, E and F in the fertilization rate, cleavage rate, optimal embryo rate and pregnancy rate. Conclusion Teratozoospermia may affect the fertilization rate of IVF cycle, but no signi cant in uence on that of ICSI cycles.
spermatozoa/abnormalities; sperm Injections, intracytoplasmic; treatment outcome
10.3969/j.issn.1008-0848.2015.08.010
R 698.2
*通訊作者, E-mail: nieyulin200520@sina.com

