培門冬酶治療急性淋巴細胞白血病和惡性淋巴瘤中國專家共識
中國臨床腫瘤學會(CSCO) 中華醫學會血液學分會(CHS)白血病·淋巴瘤學組中華醫學會兒科血液學分會(CCHS) 中國抗淋巴瘤聯盟(UCLI)
·專家共識·
培門冬酶治療急性淋巴細胞白血病和惡性淋巴瘤中國專家共識
中國臨床腫瘤學會(CSCO) 中華醫學會血液學分會(CHS)白血病·淋巴瘤學組
中華醫學會兒科血液學分會(CCHS) 中國抗淋巴瘤聯盟(UCLI)
培門冬酶 急性淋巴細胞白血病 惡性淋巴瘤專家共識
淋巴造血組織惡性腫瘤中急性淋巴細胞白血病(acute lymphoblastic leukemia,ALL)、淋巴母細胞淋巴瘤(lymphoblastic lymphoma,LBL)和NK/T細胞淋巴瘤是常見類型之一。ALL和LBL是同一疾病在不同階段的表現。ALL在青少年和兒童中發病率較高[1],占15歲以下兒童白血病的76%及所有兒童惡性腫瘤的35%。近年來惡性淋巴瘤的發病率也逐年上升,全國腫瘤登記中心報道2012年惡性淋巴瘤發病率為5.1/10萬人,是惡性腫瘤發病率的第8位,其中的NK/T細胞淋巴瘤以及前體T淋巴細胞淋巴瘤發病人數也明顯增加。
左旋門冬酰胺酶(L-asparaginase,L-Asp)作為兒童和成人ALL治療方案中的重要藥物之一,研究者對其探索由來已久:1953年Kidd發現豚鼠血清可抑制小鼠淋巴瘤的增長[2]。1958~1962年間Broome證實了豚鼠血清中抑制腫瘤增長的活性物質是L-Asp[3]。隨后Mashburn等[4]發現可從大腸桿菌中提取L-Asp,這也是現今最常用的L-Asp制劑。L-Asp是一種降解血清中門冬酰胺(ASN)的細菌酶,因ALL細胞不能生成ASN,只能依賴于血漿中的ASN進行蛋白質合成,此時L-Asp便可通過耗竭血漿ASN抑制蛋白質合成,最終導致白血病細胞的凋亡。兒童和成人ALL誘導方案中添加L-Asp能夠提高完全緩解率(CR)和治愈率。所以,L-Asp已成為ALL的最主要治療藥物之一。隨后一系列臨床研究證實了L-Asp對ALL和淋巴瘤的重要治療作用,而成為治療該類疾病的基石。
然而,L-Asp是來源于大腸桿菌的一種異源性蛋白,可刺激機體產生抗體,發生過敏反應,嚴重時危及生命,并降低L-Asp療效和患者無病長期生存[5]。其抗藥性產生的機制可能是患者染色體改變導致門冬酰胺合成活性提高,L-Asp活性降低。此外,L-Asp的半衰期短,在臨床上需要多次反復用藥,住院時間長,給患者及醫師帶來不便。上述問題嚴重限制了L-Asp的應用。
為提高L-Asp的有效性和安全性[6],人們把大腸桿菌來源的L-Asp與聚乙二醇及磷脂雙分子層連接成為了脂質體門冬酰胺酶(pegaspargase,PEGAsp)。該藥是一種新型門冬酰胺酶制劑[7],與L-Asp相比,PEG-Asp不但維持了門冬酰胺酶的生物活性,而且藥物在到達腫瘤組織前保持脂質體形態,避免被蛋白質酶分解,使PEG-Asp的半衰期較L-Asp明顯延長到(7±2)天,成為長效門冬酰胺酶制劑。一次用藥可替代L-Asp的多次用藥,縮短了住院時間,給患者及醫師帶來方便。PEG-Asp的另外一個特點是免疫原性降低,過敏反應明顯減少,尤其是速發性過敏反應更少。其他不良反應與L-ASP相似[8-9]。
PEG-Asp(Enzon公司,商品名:Oncaspar)分別于1994年和1996年在美國和歐洲獲得批準上市,目前該藥在美國及其他國家已成為治療ALL的一線藥物,在歐洲作為二線藥物。自2010年起,NCCN指南也推薦以L-Asp為基礎的聯合化療為治療NK/T細胞淋巴瘤的一線方案,2013年開始推薦以PEG-Asp替代L-Asp。2002年我國江蘇恒瑞醫藥公司自主仿制的PEG-Asp注射液進行的多中心Ⅱ期臨床試驗中,完全緩解率與L-Asp相同,但不良反應比L-Asp小。2009年該藥經國家食品和藥品監督管理局(CFDA)批準上市。上市以來,其在兒童和成人ALL以及惡性淋巴瘤中已廣泛使用,并積累了一定的臨床經驗[10]。為更好地掌握和使用PEG-Asp,我們組織了多位國內血液內科、兒科、腫瘤內科醫師及藥理學專家,對2013年《培門冬酶治療急性淋巴細胞白血病和惡性淋巴瘤專家共識》進行更新,形成本共識,供臨床醫師參考。
1 藥理學、藥代動力學及毒理學研究
1.1 藥理學
PEG-Asp與L-Asp治療ALL和惡性淋巴瘤作用機制相似。人體內正常組織細胞能自身合成門冬酰胺(ASN)以保證其生長需要,但某些癌細胞,尤其是ALL細胞由于基因突變導致無法合成ASN,從而強烈依賴于宿主血漿中的ASN供給;而L-Asp能夠將門冬酰胺分解成門冬氨酸和氨,耗盡血漿中的ASN,從而抑制腫瘤細胞的蛋白質合成、細胞分裂以及細胞生長,最終導致細胞程序性死亡,其他正常細胞則不受影響[11]。
PEG-Asp為惰性的、水溶性人工合成的化學聚合體polyethlene glycol(PEG)和門冬酰胺酶蛋白共價連接的產物,不但維持了L-Asp的生物活性,而且藥物在到達腫瘤組織前保持脂質體形態,從而減少蛋白質酶解及腎臟排泄。PEG-Asp中的聚二乙醇允許L-Asp與酶的活性位點自由結合,且限制了L-Asp(從大腸桿菌分離的L-Asp,Asp from Escherichia coli)被網狀內皮系統吸收,從而能夠有效減低人體免疫系統的識別。因此,Asp的聚乙二醇化大幅降低了抗體產生的可能性[12],同時降低或避免過敏等不良反應。此外,研究表明PEG-Asp在人體抗蛋白酶水解的能力比L-Asp提高10倍以上,從而使PEG-Asp的用藥劑量和頻率大幅減低。臨床應用已證實,PEG-Asp保持了L-Asp的抗腫瘤作用,而過敏反應明顯降低。
1.2 藥代動力學
Armstrong等[13]研究表明,大部分PEG-Asp的藥代動力學與L-Asp相似,表現為單相半衰期和單相消除期。在用L-Asp治療急性淋巴細胞白血病和淋巴瘤的成年患者研究中,靜脈注射L-Asp后測定初期血漿水平,其血漿半衰期不受劑量水平的影響,且與年齡、性別、體表面積、肝腎功能、疾病的診斷或程度無關。L-Asp注射后在血管空間內大量殘留,并已在胸水和腹水中檢測到該藥物,但在腦脊液中未檢測到。對于PEG-Asp,其最重要的特征是半衰期延長,約為7天左右[12],較L-Asp的半衰期延長6~7倍,從而可增強藥物療效,降低用藥頻率,減少患者治療的經濟成本及不良反應。
PEG-Asp中的PEG或Asp部分抗體的形成,也可改變藥物的藥代動力學。對L-Asp有過敏反應者,其PEG-Asp半衰期比對Asp不過敏者短。更短的PEGAsp半衰期則可能是Asp抗體產生所致[5]。有PEG抗體者,其體內藥物的清除率比正常人快[13]。值得注意的是,隨著PEG在各種常見產品如化妝品和食品等的應用,可能會使一般人群中的PEG抗體增加[11]。
2 臨床應用
醫源性大腸桿菌和歐文氏桿菌的L-Asp在臨床上應用于ALL治療已將近40年的歷史。自PEG-Asp制劑在美國上市至2009年國產PEG-Asp上市,其應用于淋巴系統惡性腫瘤治療已取得一定的臨床研究成果。研究證實,PEG-Asp不僅可降低抗體發生率及免疫原性,同時也降低過敏反應發生率[14-15]。且因其半衰期長,有效血藥活性時間較長,可減少用藥頻率。其給藥途徑也更靈活、方便,經靜脈滴注和肌肉注射均可[16]。因此,大部分國家已將PEG-Asp替代L-Asp作為一線治療方案[14]。2006年7月24日美國食品和藥物管理局(FDA)批準PEG-Asp(Oncaspar,ENZON制藥公司)作為ALL一線治療組成藥物之一。
2.1 PEG-Asp在ALL中的臨床應用
2.1.1 兒童ALL Dinndorf等[17]在2007年進行的一項隨機、開放、多中心臨床試驗中,對FDA將PEGAsp作為一線治療組成藥物的決策提供了進一步的數據支持。研究納入118例未經治療的標危ALL兒童(年齡1~9歲),在誘導緩解期和延遲強化期治療時采用聯合L-Asp或PEG-Asp的多藥物化療,其中PEG-Asp為單次劑量2 500 IU/m2肌肉注射。試驗結果顯示,無論是PEG-Asp或L-Asp化療,其治療的患者3年無事件生存率均接近80%。誘導期PEG-Asp聯合化療或L-Asp聯合化療下的腦脊液中ASN的消耗水平亦相似。研究再次證實,PEG-Asp可作為治療兒童ALL的一線藥物。此外,Pieters等[14]在一項隨機對照試驗中對天然L-Asp和PEG-Asp給藥后血液中的抗體情況進行了比較。納入377例兒童給予不同劑量的L-Asp:誘導緩解期及再誘導期肌肉注射10 000 IU/m2,誘導緩解期及延遲強化期肌肉注射6 000 IU/m2,誘導緩解期及延遲強化期皮下注射6 000 IU/m2;PEG-Asp:誘導緩解期及強化期肌肉注射2 500 IU/m2,誘導緩解期及延遲強化期肌肉注射2 500 IU/m2。結果顯示,患兒抗體陽性發生率L-Asp分別為35.5%、26%~42%和20%,PEG-Asp分別為11%和2%~11%。研究證實PEG-Asp可降低抗體發生率及免疫原性。
我國培門冬酶Ⅱ期臨床試驗協作組于2008年將135例患者(可評價療效131例)隨機分為試驗組(65例)與對照組(66例)。誘導治療用VDLD方案,試驗組采用國產PEG-Asp注射液,對照組采用L-Asp。結果顯示,在療效和不良事件發生率方面兩組間差異無統計學意義。過敏反應發生率方面,試驗組為4.4%(3/68例),對照組為5.9%(4/67例)。研究證實,采用含PEG-Asp的VDPAP方案與含L-Asp的VDLP方案治療兒童ALL,其療效、不良反應相似,但PEGAsp具有作用時間長和使用方便的優點,尤其對于使用其他門冬酰胺酶制劑過敏或復發難治病例已顯示出優勢[15]。
Silverman等[18]對PEG-Asp的血藥濃度進行了檢測,將197例1~18歲初次診斷為ALL的患者納入PEG-Asp方案治療。受試者分為標危組和高危組。所有患者均使用3天甲潑尼龍(methylprednisolone,MPS)作為誘導緩解的開始,隨后多種藥物聯合治療28天。其中藥物包括每周使用1次長春新堿(vincris?tine,VCR),每天使用潑尼松(prednisone,PDN)或MPS,2劑多柔比星(doxorubicin,DOX),低劑量甲氨蝶呤(methotrexate,MTX)。且在治療的第7天,所有受試者均接受PEG-Asp單劑2 500 IU/m2靜脈滴注1 h。結果表明,在PEG-Asp單劑量2 500 IU/m2靜脈滴注治療下,受試者的門冬酰胺酶有效血藥濃度活性時間可維持2周甚至更久。臨床試驗證據提示,PEGAsp有效的安全劑量為2 000~2 500 IU/m2,可2周給藥1次,從而減少用藥頻率,節省患者治療的成本。
另有研究探索PEG-Asp的給藥途徑。對16例受試者(平均年齡7歲)事先不給予肌肉注射,僅靜脈滴注PEG-Asp平均2個劑量,對照組27例患者僅肌肉注射PEG-Asp平均3個劑量。試驗發現,僅使用PEG-Asp肌肉注射和僅使用靜脈滴注的受試者其過敏反應發生率相似,且PEG-Asp的靜脈滴注劑量與肌肉注射劑量相近(但在發生急性胰腺炎和血栓時,不建議繼續靜脈滴注PEG-Asp)。因此,臨床上采用PEG-Asp治療的患者,給予靜脈滴注或肌肉注射均可[16]。
近年來國內也有其他研究機構及學者對PEGAsp進行探索并得出類似結論。中國醫學科學院血液病醫院兒童血液病診療中心于2013年選取268例初治ALL患兒作為研究對象,其中159例患兒接受L-Asp方案誘導治療,109例接受含PEG-Asp(國產艾陽)的化療。隨后給予VCR、柔紅霉素(daunorubicin,DNR)及地塞米松(dexamethasone,DXM)進行誘導化療。結果顯示兩者的骨髓狀態差異無統計學意義。由此也證實了PEG-Asp治療初治ALL患兒的療效與L-Asp相當[19-20]。此外,國內另一家醫院在2009年7月至2014年7月收治了60例ALL兒童患者進入臨床研究,誘導治療采用VDLD(VCR+DNR+PEG-Asp/L-Asp+PDN),隨機分為2組。觀察組給予PEG-Asp 2 500 IU/m2,對照組給予L-Asp 6 000 IU/m2。VCR、DNR、PDN劑量同觀察組。研究發現觀察組與對照組在完全緩解率、3年無進展生存率及總生存率方面差異無統計學意義。證實PEG-Asp代替L-Asp作為治療方案是可行的[21]。
2.1.2 成人ALL 相對于兒童的藥效學、藥動學和安全性研究,左旋門冬酰胺酶在成人的研究方面則非常有限。Faderl等[22]應用hyper-CVAD為基礎改良方案,加大了VCR、DXM和L-Asp(開始的62例患者應用 L-Asp,其余患者應用 PEG-Asp 2 500 IU/m2,i.v.,d1)的劑量,作為挽救性方案治療90例復發或難治性的成人ALL。試驗發現4例患者(47%)獲得完全緩解(CR),達到CR的中位時間是29(18~80)天,中位CR持續時間、PFS和OS分別為5、6.2和6個月。CR患者中位OS為10.2(1.4~69.5)個月,因此證實PEG-Asp治療成人ALL與L-Asp具有同等療效。
此外,Douer等[23]對25例受試對象進行PEG-Asp的臨床USCⅡ試驗,受試對象年齡為17~55歲,PEG-Asp劑量為2 000 IU/m2,靜脈滴注后16%的受試對象出現肝毒性(3、4度),完全緩解率為96%,4年總生存率為31%,無復發生存率為40%。初診的成人ALL患者采用PEG-Asp治療可產生持久的門冬氨酸耗竭,且安全性、耐受性良好。
Wetzler等[24]針對85例ALL成人患者(年齡17~70歲)進行了CALGB 9511臨床試驗。PEG-Asp誘導期間2 000 IU/m2,d5、d22,早期強化2 000 IU/m2,54%患者發生高膽紅素血癥(3度),完全緩解率為84%,25%患者達到7.8年總生存期。無復發生存率為22%,且未出現過敏反應,無骨髓移植者。
2.2 PEG-Asp在惡性淋巴瘤中的臨床應用
惡性淋巴瘤是近年來發病率增長最快的腫瘤之一,隨著WHO淋巴造血組織腫瘤分類的細化以及人們認識的提高,NK/T細胞淋巴瘤以及前體T淋巴母細胞淋巴瘤的患者明顯增加。這兩種類型的T細胞淋巴瘤發病有明顯的區域分布特點,在歐美國家發病率較低,而在我國及亞洲國家發病率較高。NK/T細胞淋巴瘤約占非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)的6.5%~9%,而前體T淋巴母細胞淋巴瘤約占成人NHL的2%~8%,占兒童NHL的40%左右,大多數為侵襲性,在初診時半數以上患者為Ⅳ期,如無有效治療,患者常在短期內死亡。
2.2.1 兒童惡性淋巴瘤 Winter等[25]在以抗代謝藥物為基礎治療兒童急性T淋巴細胞白血病研究中發現,在初診為急性T淋巴細胞白血病(29例)和非霍奇金淋巴瘤(16例)的兒童中,采用MTX、巰嘌呤(mer?captopurine,MP)替代替尼泊苷(teniposide,VM-26)、阿糖胞苷(cytarabine,Ara-C),PEG-Asp取代天然LAsp的方案是可行的。另有研究人員分別于CCLG-2008及NHL-BFM90方案中使用PEG-Asp治療ALL與LBL患兒211例,結果提示以PEG-Asp替代L-Asp作為一線治療安全有效[26]。
2.2.2 成人惡性淋巴瘤 Muss等[27]每2周1次肌肉注射2 000 IU/m2的PEG-Asp治療21例難治性非霍奇金淋巴瘤患者的研究顯示,在此劑量下治療有效。
Wen等[28]對2009年1月至2013年8月期間納入的20例結外NK/T細胞淋巴瘤患者進行研究,所有患者均在第1天肌肉注射PEG-Asp 2 500 IU/m2,每21天為1個周期。同時接受聯合化療:CHOP(5例),EP?OCH(7例),GEMOX(7例),CHOP聯合博來霉素(bleomycin,BLM)(1例)。結果顯示,在2~5個周期之后(中位4個周期),CR為25%,ORR為60%,無過敏反應發生,無治療相關死亡報道。
國內一項研究在2009年6月至2012年3月采用改良SMLIE方案治療7例Ⅲ~Ⅳ期的結外NK/T細胞淋巴瘤,CR 5例,PR 1例,PD 1例,近期總有效率為85.7%,CR率為71.4%。該結果提示改良的SMILE方案治療初治或難治性NK/T細胞淋巴瘤療效較好,毒性可耐受,值得臨床進一步探討。
平凌燕等[29]回顧性分析2008年1月至2012年3月接受PEG-Asp聯合化療的32例淋巴瘤患者的臨床資料,其中NK/T細胞淋巴瘤患者22例,淋巴母細胞淋巴瘤患者10例。NK/T細胞淋巴瘤患者使用CHOP-L[環磷酰胺(cyclophosphamide,CP)、VCR、DOX、醋酸潑尼松、PEG-Asp]方案或L-OP(PEG-Asp、VCR、DXM)方案;淋巴母細胞淋巴瘤患者使用BFM-90方案,包括VDLP(VCR、DNR、PEG-Asp、PDN)、CAT(CP、Ara-C、6-MP)、大劑量MTX,其中VDLP部分的PEG-Asp劑量均為2 500 IU/m2,分3個部位肌肉注射,給藥前30min靜脈輸注DXM5 10mg,同時給予鹽酸異丙嗪12.5mg,每2~3周重復1次,預防超敏反應。試驗發現,總有效率為71.9%(23/32),完全緩解率為40.6%(13/32),部分緩解率為31.3%(10/32)。該臨床結果提示PEG-Asp的過敏發生率較L-Asp明顯降低,雖然存在較多其他不良反應,但均在可耐受和可控范圍內。因此,該藥安全性較好,給藥簡單,臨床使用方便。對于復發難治NK/T細胞淋巴瘤及淋巴母細胞淋巴瘤患者均屬于可選擇藥物。
3 不良反應及處理
PEG-Asp與L-Asp所引起的不良反應相似,主要包括過敏反應、肝功能損害、出血凝血或纖溶障礙、血栓形成、急性胰腺炎、電解質紊亂及糖代謝紊亂等。
3.1 PEG-Asp抗體產生
L-Asp治療的一個嚴重問題在于產生抗門冬酰胺酶抗體(Ab),該抗體可以中和酶活性,并常導致對L-Asp耐藥,是否影響預后還有待進一步臨床研究[30]。PEG-Asp中聚乙二醇的聚合,降低了抗體產生的可能性[18](表1)。
以學生干部名義加入各級學生社團組織、年級、班級的學生骨干,在學校各種評先評優、黨員發展、就業單位推薦上處于一定的優勢地位而從中獲益。這些學生骨干,在不同程度上存在“官本位”思想,理想信念淡漠,華而不實,脫離群眾,缺乏主動為同學們服務的主人翁意識。因此,往往被貼上“精致利己主義者”的標簽。
3.2 過敏反應
PEG-Asp過敏反應發生率為天然L-Asp的30%[34]。接受PEG-Asp治療患者出現過敏反應者極少,較L-Asp安全,但仍有極少數患者發生急性過敏反應,尤其有L-Asp過敏史者發生率較高,給藥時須備常見的搶救藥物及設備。
鑒于PEG-Asp較少發生過敏反應,使用前不需做藥物過敏源皮試,但在使用前應酌情給予地塞米松、開瑞坦及鹽酸異丙嗪等,以預防過敏反應的發生。
過敏反應一般表現為蕁麻疹、急性喉頭水腫、支氣管痙攣、血清病和過敏性休克。用藥前后應密切監測呼吸、血壓、心率及出入量。一般給藥后嚴密觀察3小時,防止過敏反應的發生。搶救措施與處理青霉素過敏相同,應采用腎上腺素、糖皮質激素(琥珀酸氫化可的松等)、抗組胺藥物及吸氧等進行治療。
此外,在避免過敏反應方面聯合治療被認為比單一療法更加有效,因其治療過程可抑制天冬酰胺酶的免疫反應。

表1 門冬酰胺酶誘導的特異性抗體發生率Table1 Antibody positivity rate induced by L-asparaginasum
3.3 肝功能損害
PEG-Asp安全耐受性較好,肝功能異常一般為Ⅰ和Ⅱ級不良反應。最常見的是肝臟轉氨酶升高,膽紅素升高。Ⅲ和Ⅳ級不良反應僅0.1%~1%。一般在應用PEG-Asp時應嚴密注意肝功能及膽紅素。發生肝功能異常者,可給予一般的保肝對癥治療。對于應用PEG-Asp前肝功異常患者應進行降酶、保肝治療,待肝功能恢復正常時再應用。
3.4 止血、凝血或纖溶障礙
應用PEG-Asp的患者可發生凝血酶原時間延長、部分凝血活酶生成時間延長、低纖維蛋白原血癥等凝血纖溶異常。有報道L-Asp凝血纖溶異常的發生率約為50%~96%,而PEG-Asp約為25%~60%。一般凝血纖溶異常但致命的出血較少見,但一定要與血栓相鑒別。當纖維蛋白原下降引起出血癥狀時可給予新鮮血漿及纖維蛋白制劑治療,定期監測凝血指標及纖維蛋白原定量。
PEG-Asp在治療ALL或惡性淋巴瘤時易發生血栓,主要為腦血栓及深部靜脈血栓,偶可發生極少見的肺栓塞。臨床表現多在L-Asp化療期間或停藥后1周內出現,可有不同程度出血傾向或血栓形成等,其中顱內出血及血栓發生率為1%~2%[32]。蛋白S水平可作為腦血栓形成監測指標之一[33]。
一般對血栓高危患者,尤其是同時聯合化療的成年患者,可以給予小劑量低分子肝素2 000~4 000 IU/d預防治療,但尚無循證醫學證據證明在給予抗凝預防后血栓形成發生率降低。一般發生腦血栓及深部靜脈血栓時應給予抗血栓治療。
臨床上停用L-Asp時,需及時給予維生素K、凝血物質治療。治療出血癥狀可給予新鮮血漿及纖維蛋白原制劑,并定期監測凝血指標及纖維蛋白原定量。據歐美學者報道,對于高危血栓形成的成人患者,應用PEG-Asp的同時可用阿司匹林預防血栓形成。
3.6 急性胰腺炎
PEG-Asp應用中也可發生胰腺炎。門冬酰胺酶治療后發生的急性胰腺稱為AAP,尤其見于成年患者,是PEG-Asp主要不良反應之一。AAP可發生于PEG-Asp化療的各個階段,發生率0.4%~2%,聯合化療可達10%左右[35-36]。
預防性低脂肪飲食,嚴密觀察患者的臨床癥狀,以及血、尿淀粉酶濃度、胰腺超聲及CT影像學檢查,是預防和發現胰腺炎的重要措施。國外學者對成人應用PEG-Asp常給予多肽類,如奧曲肽預防治療。由于血、尿淀粉酶指標無特異性,應進行血漿胰島素、胰肽酶監測,一般可作為早期診斷指標。
使用PEG-Asp過程中,患者一旦出現腹痛、血壓下降、血淀粉酶>125U/L,彩色B超及CT提示胰腺增大及水腫,應立即按胰腺炎急癥處理。確診AAP后禁食、補液、維持水電解質酸堿平衡,給予奧美拉唑抑制胃酸,奧曲肽、烏司他丁抑制胰酶分泌,小劑量甲強龍(MPS)減輕炎癥反應,并給予中藥芒硝腹部外敷消腫止痛、早期使用碳青霉烯類廣譜抗生素,糾正低蛋白血癥,維持主要臟器功能。
3.7 電解質紊亂
在應用PEG-Asp時要注意電解質平衡。PEGAsp直接引起離子紊亂較罕見,因此這與聯合化療及感染相關。注意低鈉血癥、低鉀血癥及低蛋白血癥,應早期發現及時對癥治療。
3.8 糖代謝紊亂
抑制胰島素功能可能導致2%~3%使用PEGAsp的患者出現高血糖癥[37]。且在誘導治療階段糖皮質激素的應用,將會加重并延長高血糖癥[38]。因此,治療前應詢問是否有糖尿病史,并告知患者高血糖的癥狀,在治療中應監測患者血糖情況。若在治療中出現血糖增高,可采用胰島素進行治療,此類患者通常對胰島素較為敏感,可從小劑量開始。此外,少數患者還可出現低血糖。
3.9 兒童不良反應
L-Asp治療過程中過多消耗血液中門冬酰胺的同時,機體內某些代謝旺盛的器官,如肝、胰等正常細胞代謝也受到影響,可產生多種不良反應,甚至包括壞死性胰腺炎、藥物性糖尿病、凝血功能障礙、肝功能損害等。此外,L-Asp作為異種蛋白制劑,由于其高免疫原性,可引起機體較高的過敏反應發生率。曾有報道顯示,兒童初次接受L-Asp治療的急性過敏反應發生率可達24%,甚至出現過敏性休克等危重情況。雖然L-Asp可明顯改善兒童ALL療效,但因其嚴重的過敏反應及眾多的毒副作用,在一定程度上限制了其臨床應用和療效。PEG-Asp通過對Asp的聚乙二醇化,在很大程度上克服了L-Asp過敏反應致使用受限的弱點[39]。
李穎等[39]對PEG-Asp在兒童ALL臨床應用中的安全性進行了評估。2009年10月至2011年8月先后共有32例患兒由于對大腸桿菌L-Asp過敏而使用PEG-Asp替代化療共46次,所有患兒均使用CCLGALL 2008方案規范診治。研究結果顯示,46例次PEG-Asp治療中,僅1例(2%)發生典型的過敏反應,以明顯的風團樣皮疹伴瘙癢為主要表現,有一過性喉頭異物感,經吸氧、鎮靜等處理后很快緩解。其他不良反應發生率均未超過報道中的L-Asp不良反應發生率,且程度輕。研究表明,PEG-Asp應用于兒童ALL治療中,具有較高的安全性和較輕的不良反應,患兒依從性好,推薦作為對L-Asp過敏患兒的替代治療。
4 兒童/成人ALL及惡性淋巴瘤治療方案
4.1 兒童ALL治療方案
4.1.1 CCLG-ALL 2008多中心協作治療方案 我國目前大多數采用中國兒童白血病協作組CCLG-ALL 2008多中心協作方案治療兒童ALL。有研究2008年4月至2011年3月收治198例ALL患兒采用CCLGALL 2008治療研究,受試對象的中位年齡為4歲。
標危組治療方案:1)誘導緩解治療:VDLD2(表2)。2)早期強化治療:CAM(表3)。3)鞏固治療:HD-MTX+6-MP。4)延遲強化治療:VDLD3→CAM。5)維持治療:6-MP+MTX/VD+IT。總療程均2年。

表2 VDLD方案Table2 VDLD chemotherapy regimens

表3 CAM方案Table3 CAM chemotherapy regimens
中危組治療方案:1)誘導緩解治療:VDLD4。2)早期強化治療:CAM 2次。3)鞏固治療:HD-MTX+6-MP。4)延遲強化治療Ⅰ:VDLD3至CAM。5)中間維持治療:6-MP/MTX。6)延遲強化治療Ⅱ:VDLD3→CAM。7)維持治療:6-MP+MTX/VD+TIT。總療程女性2年,男性2.5年。
高危組治療方案:1)誘導緩解治療:VDLD4。2)早期強化治療:CAM 2次。3)鞏固治療:(HR-1,HR-2,HR-3)2 次循環。4)延遲強化治療:VDLD4→CAM。5)維持治療:6-MP+MTX/CA/VD+TIT。總療程女性2年,男性2.5年。
療效:研究發現197例平均生存時間(19.2±0.6)個月。病死率5.1%,標危組2例,中危組1例,高危組7例。化療相關病死率占0.5%。復發率10.2%,其中185例在33天內完全緩解。CR率為94.4%,平均緩解時間(23.4±9.7)天。可見CCLG-ALL 2008方案治療兒童ALL的完全緩解率較高,早期復發率低,化療相關病死率低。若在治療早期進行評估再調整化療強度可提高完全緩解率,降低復發率,提高長期生存率,減少化療相關病死率和不良反應[40]。
4.1.2 PEG-Asp聯合化療治療兒童ALL的其他治療方案 地西他濱(decitabine)、PEG-Asp和伏立諾他(vorinostat)聯合化療治療復發型ALL。伏立諾他230mg/m2口服、地西他濱15mg/m2靜脈注射,PDN 40 mg/m2、VCR 1.5 mg/m2、DOX 60 mg/m2、PEG-Asp 2 500 IU/m2、鞘內阿糖胞苷 70mg[41]。
PEG-Asp和氯法拉濱(clofarabine)聯合用藥:潑尼松龍60mg/m2口服,d1~28;每周4個劑量的長春新堿1.5mg/m2和4個劑量的柔紅霉素36mg/m2,均靜脈注射。中樞神經系統無白血病細胞的患兒前7天接受單劑量鞘內甲氨蝶呤(MTX);已發生白血病細胞侵襲中樞神經系統的患兒則接受額外2個劑量的鞘內MTX;鞏固方案包括環磷酰胺(cyclophospha?mide)900mg/m2,MTX 1 g/m2,PEG-Asp 2 500 IU/m2,氯法拉濱 40mg/m2[42]。
4.2 成人ALL治療方案
MOAP方案是難治性或復發性成人急性淋巴細胞白血病的治療方案,有良好的耐受性和有效性。
MOAP方案:在d1,d14,MTX 100mg/m2靜脈注射至少15min;之后PEG-Asp 2 500 IU/m2靜脈滴注(最大劑量3 750 IU)持續4~6 h。d1、7、14,VCR 1.4mg/m2(最大劑量2mg)持續滴注至少15min。在d1~5,d14~19,潑尼松龍200mg口服/d[43]。
另外,成人ALL還有以下經典治療方案(表4)。
4.3 惡性淋巴瘤治療方案
4.3.1 PEG-Asp+Gemox+Thalidomide方案用于初治Ⅲ/Ⅳ期及難治復發NK/T細胞淋巴瘤 見表5。
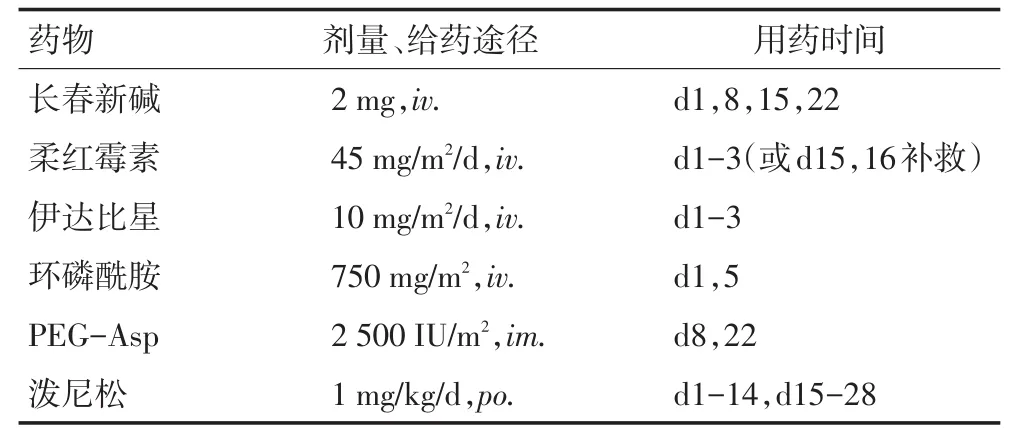
表4 VDCLP或VICLP誘導化療方案Table4 VDCLPor VICLP reduction chemotherapy regimens

表5 PEG-Asp+Gemox+Thal idomide方案Table5 PEG-Asp+Gemox+Thalidomide chemotherapy regimens
劑量調整:1)第1次出現4級骨髓毒性持續大于7天或3級骨髓毒性伴發熱,化療藥物(DXM、PEGASP除外)劑量減少25%。2)第2次出現4級骨髓毒性持續大于7天或3級骨髓毒性伴發熱,化療藥物(DXM、PEG-ASP除外)劑量減少50%。最多允許2次劑量調整。3)第1次出現≥2級轉氨酶、總膽紅素增高、白蛋白下降、APTT延長、纖維蛋白原下降,且下次化療前未能恢復至1級以內,PEG-ASP劑量減少25%。4)第2次出現≥2級轉氨酶、總膽紅素增高、白蛋白下降、APTT延長、纖維蛋白原下降,且下次化療前未能恢復至1級以內,PEG-ASP劑量減少50%。最多允許2次劑量調整。5)當出現≥3級的非血液學毒性(如惡心、嘔吐、乏力、體重下降等),且下次化療前未能恢復至1級以內,化療推遲,直至毒性下降至1級以內,最多允許推遲14天。如14天內毒性恢復至1級以內,下程化療所有藥物劑量減少25%。
4.3.2 改良SMILE方案用于NK/T細胞淋巴瘤 見表6。
4.3.3 AspaMetDex方案用于NK/T細胞淋巴瘤 見表7,表8。
4.3.4 改良BFM-90方案治療T淋巴母細胞淋巴瘤 見表9。

表6 改良SMILE方案Table6 Modified SMILE chemotherapy regimens

表7 AspaMetDex方案Table7 AspaMetDex chemotherapy regimens

表8 COEP-L方案Table8 COEP-L chemotherapy regimens
以上方案2周重復,共6個周期。

表9 北京腫瘤醫院T淋巴母細胞淋巴瘤改良BFM-90方案Table9 modified BFM-90 chemotherapy regimens for T-lymphoblastic lymphoma in Beijing Cancer Hospital
5 藥物經濟學
聚乙二醇的聚合使PEG-Asp不良反應大幅降低,并顯著增強藥物的療效。此外,由于其半衰期延長,較長時間內只需一次性注射,減少了用藥頻率,患者依從性較好。謝淑佩等[44]在一項單中心、隨機、對照試驗中共納入100例2~14歲的ALL患兒,結果顯示PEG-Asp組(1.9次)的用藥次數明顯少于L-Asp組(7.5次)。王岳等[45]在另一項單中心、隨機、對照試驗中共納入100例確診為ALL且完全緩解半年以上的患兒,結果顯示PEG-Asp組的平均住院時間[(11.5±7.1)d]明顯短于L-Asp組[(18.5±4.9)d]。研究證實,PEG-Asp可減少住院時間,節省住院開支,從而降低患者治療的經濟成本。因此,在保證療效和安全性的前提下,PEG-Asp較L-Asp的藥物經濟學更優。
編寫人員
馬 軍 哈爾濱血液病腫瘤研究所
沈志祥 海瑞金醫院
朱 軍 北京大學腫瘤醫院
吳敏媛 北京兒童醫院
趙維蒞 上海瑞金醫院
黃慧強 中山大學附屬腫瘤醫院
郭 曄 復旦大學附屬腫瘤醫院
[1]Pui CH,EvansW E.T reatment of acute lymphoblastic leukem ia[J].N Engl JMed,2006,354(2):166-178.
[2] Kidd JG.Regression of transplanted lymphomas induced in vivo by means of normal guinea pig serum.I.Course of transplanted cancers of various kinds in m ice and rats given guinea pig serum,horse serum,or rabbit serum[J].JExp M ed,1953,98(6):565-582.
[3] Broome JD.Evidence that the L-asparaginase of guinea pig se?rum is responsible for its antilymphoma effects.I.Properties of the L-asparaginase of guinea pig serum in relation to those of the antilymphoma substance[J].JExp M ed,1963,118:99-120.
[4]M ashburn LT,W riston JC.TUMOR INH IBITORY EFFECT OF L-ASPARAGINASE FROM ESCHERICH IA COLI[J].Arch Biochem Biophys,1964,105:450-452.
[5] Panosyan EH,Seibel NL,Martin-Aragon S,et al.Asparaginase antibody and asparaginase activity in children w ith higher-risk acute lymphoblastic leukem ia:Children's Cancer Group Study CCG-1961[J].JPediatr HematolOncol,2004,26(4):217-226.
[6]Hawkins DS,Park JR,Thomson BG,etal.Asparaginase pharma?cokinetics after intensive polyethylene glycol-conjugated L-as?paraginase therapy for children w ith relapsed acute lymphoblastic leukem ia[J].C lin Cancer Res,2004,10(16):5335-5341.
[7]Hempel G,Müller HJ,Lanvers-Kam insky C,et al.A popu lation pharmacokineticmodel for pegylated-asparaginase in children[J].Br JHaematol,2010,148(1):119-125.
[8] Ho DH,Brown NS,Yen A,et al.C linical pharmacology of poly?ethylene glycol-L-asparaginase[J].D rug M etab Dispos,1986,14(3):349-352.
[9] Ettinger LJ,Kurtzberg J,Vo?te PA,et al.An open-label,multi?center study of polyethylene glycol-L-asparaginase for the treat?ment of acute lymphoblastic leukem ia[J].Cancer,1995,75(5):1176-1181.
[10]Liu F,Zou Y,Zhang L,et al.Long-term efficacy of polyethylene glycol conjugated asparaginase(PEG-Asp)in new ly diagnosed childhood acute lymphoblastic leukem ia(ALL)[J].Journal of Chi?na Pediatric Blood and Cancer,2010,15(6):254-257.[劉 芳,鄒 堯,張 麗,等.培門冬酶治療兒童初發急性淋巴細胞白血病的遠期療效[J].中國小兒血液與腫瘤雜志,2010,15(6):254-257.]
[11]Rytting M.Peg-asparaginase for acute lymphoblastic leukem ia[J].ExpertOpin Biol Ther,2010,10(5):833-839.
[12]Zeidan A,W ang ES,W etzler M.Pegasparaginase:where do we stand[J]?ExpertOpin Biol Ther,2009,9(1):111-119.
[13]Armstrong JK,Hempel G,Koling S,et al.Antibody against poly(ethylene glycol)adversely affects PEG-asparaginase therapy in acute lymphoblastic leukem ia patients[J].Cancer,2007,110(1):103-111.
[14]Pieters R,Hunger SP,Boos J,et al.L-asparaginase treatment in acute lymphoblastic leukem ia:a focus on Erw inia asparaginase[J].Cancer,2011,117(2):238-249.
[15]The Cooperation Group of PhaseⅡClinical T rial of PEG-Asp.Comparison of polyethylene glycol con jugated asparaginase and L-asparaginase for treatment of childhood acute lymphoblastic leukem ia[J].Chinese Journal of Hematology,2008,29(1):29-33.[培門冬酶Ⅱ期臨床試驗協作組.培門冬酶與左旋門冬酰胺酶治療兒童急性淋巴細胞白血病的隨機對照研究[J].中華血液學雜志,2008,29(1):29-33.]
[16]August KJ,M illerW P,Dalton A,et al.Comparison of hypersensi?tivity reactions to PEG-asparaginase in children after intrave?nous and intramuscular adm inistration[J].JPediatr Hematol On?col,2013,35(7):e283-e286.
[17]Dinndorf PA,Gootenberg J,Cohen MH,et al.FDA drug approv?al summary:pegaspargase(oncaspar)for the first-line treatment of children w ith acute lymphoblastic leukem ia(ALL)[J].Oncolo?gist,2007,12(8):991-998.
[18]Silverman LB,Supko JG,Stevenson KE,et al.Intravenous PEG-asparaginase during rem ission induction in children and adoles?cents w ith new ly diagnosed acute lymphoblastic leukem ia[J].Blood,2010,115(7):1351-1353.
[19]Kurtzberg J,Asselin B,Bernstein M,et al.Polyethylene Glycolconjugated L-asparaginase versus native L-asparaginase in com?bination w ith standardagents for children w ith acute lymphoblas?tic leukem ia in second bonemarrow relapse:a Children'sOncolo?gy Group Study(POG 8866)[J].JPediatr Hematol Oncol,2011,33(8):610-616.
[20]Liu F,W an Y,Chang LX,etal.Efficacy observation of polyethyl?ene glycol conjugated asparaginase for inductiontreatment of chil?dren w ith new ly diagnosed acute lymphoblastic leukem ia[J].Chi?nese Journal of Pediatrics,2014,52(3):215-217.[劉 芳,萬 揚,常麗賢,等.培門冬酶誘導治療兒童初發急性淋巴細胞白血病的療效觀察[J].中華兒科雜志,2014,52(3):215-217.]
[21]Zhang SH.Clinical analysis of Pegaspargase on early onset of acute lymphoblastic leukem ia in chindren[J].Chinese Journal of T rauma and Disability M edicine,2015,23(4):32-33.[張世恒.培門冬酶誘導治療兒童初發急性淋巴細胞白血病臨床分析[J].中國傷殘醫學,2015,23(4):32-33.]
[22]Faderl S,Thomas DA,O'brien S,et al.Augmented hyper-CVAD based on dose-intensified vincristine,dexamethasone,and asparaginase in adult acute lymphoblastic leukem ia salvage therapy[J].C lin Lymphoma M yeloma Leuk,2011,11(1):54-59.
[23]Douer D,Yampolsky H,Cohen LJ,et al.Pharmacodynam ics and safety of intravenous pegaspargase during rem ission induction in adults aged 55 years or younger w ith new ly diagnosed acute lym?phoblastic leukem ia[J].Blood,2007,109(7):2744-2750.
[24]W etzler M,Sanford BL,Kurtzberg J,et al.Effective asparagine de?pletion w ith pegylated asparaginase resu lts in improved outcom es in adult acute lymphoblastic leukem ia:Cancer and Leukem ia Group BStudy 9511[J].Blood,2007,109(10):4164-4167.
[25]W inter SS,Holdsworth MT,Devidas M,et al.Antimetabolitebased therapy in childhood T-cell acute lymphoblastic leukem ia:a reportof POG study 9296[J].Pediatr Blood Cancer,2006,46(2):179-186.
[26]W ang HS,ZhaiXW,Lu FJ,etal.Pegasparginase as first line treat?mentof children w ith leukem ia and lymphoma[J].Chinese Oncol?ogy,2014,24(5):374-380.[王宏勝,翟曉文,陸鳳娟,等.培門冬酶一線治療兒童淋巴系統腫瘤的臨床研究[J].中國癌癥雜志,2014,24(5):374-380.]
[27]MussHB,SpellN,Scudiery D,etal.A phase IItrialof peg-L-as?paraginase in the treatmentof non-hodgkins lymphoma[J].Invest New D rugs,1990,8(1):125-130.
[28]W en JY,LiM,LiX,etal.Efficacy and tolerance of pegaspargasebased chemotherapy in patients w ith nasal-type extranodal NK/T-cell lymphoma:a pilotstudy[J].Asian Pac JCancer Prev,2014,15(15):6275-6281.
[29]Ping LY,ZhengW,W ang XP,etal.Safety and adverse event pro?filing of pegylated L-asparaginase combined chemotherapy in the treatment of lymphoma[J].National M edical Journal of Chi?na,2012,92(46):3257-3260.[平凌燕,鄭 文,王小沛,等.培門冬酶聯合化療治療淋巴瘤的安全性分析[J].中華醫學雜志,2012,92(46):3257-3260.]
[30]W oo MH,Hak LJ,Storm MC,et al.Anti-asparaginase antibod?ies follow ing E.coli asparaginase therapy in pediatric acute lym?phoblastic leukem ia[J].Leukem ia,1998,12(10):1527-1533.
[31]W oo MH,Hak LJ,Storm MC,et al.Hypersensitivity or develop?ment of antibodies to asparaginase does not impact treatment out?come of childhood acute lymphoblastic leukem ia[J].JC lin Oncol,2000,18(7):1525-1532.
[32]Larson RA,Fretzin MH,Dodge RK,et al.Hypersensitivity reac?tions to L-asparaginase do not impact on the rem ission duration of adu lts w ith acute lymphoblastic leukem ia[J].Leukem ia,1998,12(5):660-665.
[33]Lee JH,Kim SW,Sung Kim J.Sagittalsinus thrombosisassociated w ith transient free protein Sdeficiency after L-asparaginase treat?ment:case reportand review of the literature[J].Clin Neurol Neu?rosurg,2000,102(1):33-36.
[34]Sun LL,Xue XW,W ang GY,etal.Induction therapy effectofGCSF in childhood acute lymphoblastic leukem ia[J].Acta Academ i?aeM edicine Qingdao Univsersitatis,2007,43(3):242-243,246.[孫莉莉,薛學溫,王桂云,等.G-CSF對兒童急性淋巴細胞白血病誘導緩解治療作用[J].青島大學醫學院學報,2007,43(3):242-243,246.]
[35]Samarasinghe S,Dhir S,Slack J,et al.Incidence and outcome of pancreatitis in children and young adults w ith acute lymphoblas?tic leukaem ia treated on a contemporary protocol,UKALL 2003[J].Br JHaematol,2013,162(5):710-713.
[36]Raja RA,Schm iegelow K,Albertsen BK,et al.Asparaginase-asso?ciated pancreatitis in children w ith acute lymphoblastic leukaem ia in the NOPHO ALL2008 protocol[J].Br JHaematol,2014,165(1):126-133.
[37]Capizzi RL.Asparaginase revisited[J].Leuk Lymphoma,1993,10(Suppl):147-150.
[38]Capizzi RL,Bertino JR,Handschumacher RE.L-asparaginase[J].Annu Rev M ed 1970,21:433-444.
[39]Li Y,Xian Y,Su YC,et al.Safety assecssment of pegaspargase in the clinical treatment of acute lym phoblastic leukem ia in children[J].Journalof Chian Pediatric Blood and cancer,2012,17(4):157-160.[李 穎,憲 瑩,蘇庸春,等.培門冬酶在兒童急性淋巴細胞白血病臨床應用中的安全性評估[J].中國小兒血液與腫瘤雜志,2012,17(4):157-160.]
[40]Sun YN,Cai YH,He HL,et al.The efficacy of CCLG-ALL 2008 protocol in treatin childhood acute lymphoblastic leukem ia[J].Jiangsu M edical Journal,2011,37(24):2922-2925.[孫伊娜,柴憶歡,何海龍,等.CCLG-ALL2008方案治療兒童急性淋巴細胞性白血病的臨床療效[J].江蘇醫藥,2011,37(24):2922-2925.]
[41]Burke M J,Lamba JK,Pounds S,et al.A therapeutic trial of decitabine and vorinostat in combination w ith chemotherapy for relapsed/refractory acute lymphoblastic leukem ia[J].Am JHema?tol,2014,89(9):889-895.
[42]Escherich G,Zur Stadt U,Zimmermann M,et al.Clofarabine in combination w ith pegylated asparaginase in the frontline treat?ment of childhood acute lymphoblastic leukaem ia:a feasibility re?port from the CoALL 08-09 trial[J].Br JHaematol,2013,163(2):240-247.
[43]Aguayo A,Cortes J,Thomas D,et al.Combination therapy w ith methotrexate,vincristine,polyethylene-glycolconjugated-aspara?ginase,and prednisone in the treatment of patientsw ith refracto?ry or recurrent acute lymphoblastic leukem ia[J].Cancer,1999,86(7):1203-1209.
[44]X ie SP,Liang CD,Zhong XH.The sideeffcts and clinicalefficacy of Pegaspargase and L-asparaginase in the treatment of child?hood acute lympoblastic leukem ia[J].National M edical Frontiers of China,2013,8(15):60-61.[謝淑佩,梁昌達,鐘小紅.培門冬酶與左旋門冬酰胺酶在兒童急性淋巴細胞白血病誘導化療中的毒副作用和療效分析[J].中國醫療前沿,2013,8(15):60-61.]
[45]W ang Y,LiXR,Zhong R,etal.Efficacy and safety of pegasparga?se and L-asparaginase in treatment of children w ith acute lym?phocytic leukem ia[J].Adverse D rug Reactions Jounal,2011,13(5):278-282.[王 岳,李學榮,仲 任,等.培門冬酶和左旋門冬酰胺酶治療兒童急性淋巴細胞白血病的療效和安全性[J].藥物不良反應雜志,2011,13(5):278-282.]
(2015-11-01收稿)
(2015-12-01修回)
(編輯:鄭莉)
10.3969/j.issn.1000-8179.2015.24.289
馬軍 m ajun0322@126.com

