例談四大平衡常數
2015-07-06 08:32:55張友偉
中學生數理化·高三版
2015年7期
關鍵詞:化學
張友偉


新課標實施以來一項較大的變化就是化學由定性描述走向定量研究,其中體現之一就是四大平衡常數的引入給化學反應原理增加了有力的分析依據。“用數據來說話”讓化學變得富有活力,同時也帶來了一系列思維的發(fā)展與能力的考查,所以從一定意義上講,掌握了四大平衡常數,就握住了一把解決化學問題的金鑰匙。
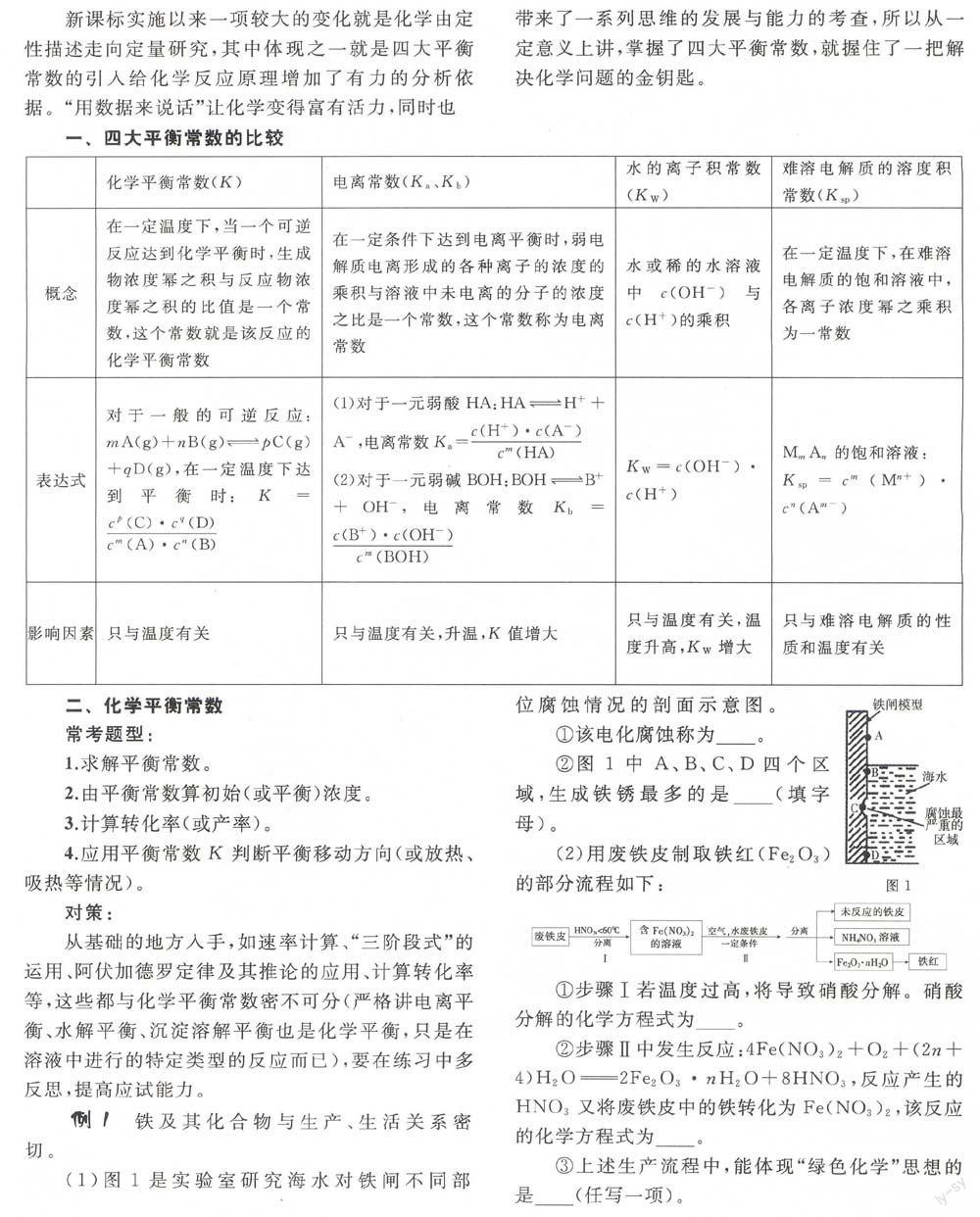
一、四大平衡常數的比較
二、化學平衡常數
常考題型:
1.求解平衡常數。
2.由平衡常數算初始(或平衡)濃度。
3.計算轉化率(或產率)。
4.應用平衡常數K判斷平衡移動方向(或放熱、吸熱等情況)。
對策:
從基礎的地方人手,如速率計算、“三階段式”的運用、阿伏加德羅定律及其推論的應用、計算轉化率等,這些都與化學平衡常數密不可分(嚴格講電離平衡、水解平衡、沉淀溶解平衡也是化學平衡,只是在溶液中進行的特定類型的反應而已),要在練習中多反思,提高應試能力。
例1 鐵及其化合物與生產、生活關系密切。
(l)圖1是實驗室研究海水對鐵閘不同部位腐蝕情況的剖面示意圖。
①該電化腐蝕稱為______。
②圖1中A、B、C、D四個區(qū)域,生成鐵銹最多的是_____(填字母)。
(2)用廢鐵皮制取鐵紅(Fe203)的部分流程如下:
①步驟I若溫度過高,將導致硝酸分解。硝酸分解的化學方程式為_______。
②步驟Ⅱ中發(fā)生反應:,反應產生的HN03又將廢鐵皮中的鐵轉化為Fe(N03)2,該反應的化學方程式為_____。
③上述生產流程中,能體現“綠色化學”思想的是_____(任寫一項)。
(3)已知t℃時,反應的平衡常數K=0.25。
①t℃時,反應達到平衡時
②若在1 L密閉容器中加入0.02mol FeO(s),并通人x mol CO,t℃時反應達到平衡。……
登錄APP查看全文
猜你喜歡
小學科學(學生版)(2021年3期)2021-04-13 08:26:20
中學生天地(C版)(2016年2期)2016-08-23 12:06:30
考試周刊(2016年63期)2016-08-15 22:51:06
發(fā)明與創(chuàng)新(2015年25期)2015-02-27 10:39:25
化學教與學(2012年5期)2012-03-20 14:05:44
棋藝(2001年19期)2001-11-25 19:55:34

