RRM1蛋白表達(dá)與體外藥敏實(shí)驗(yàn)檢測(cè)對(duì)指導(dǎo)非小細(xì)胞肺癌化療的價(jià)值
黃 娟 劉 浩 鄧 沖
·短篇論著·
RRM1蛋白表達(dá)與體外藥敏實(shí)驗(yàn)檢測(cè)對(duì)指導(dǎo)非小細(xì)胞肺癌化療的價(jià)值
黃 娟1劉 浩2鄧 沖3
肺癌,非小細(xì)胞; 核苷酸還原酶亞單位MI; 吉西他濱; 藥敏實(shí)驗(yàn); 個(gè)體化治療
非小細(xì)胞肺癌(non-small cell lung cancer, NSCLC)是目前威脅人類健康與生命最大的惡性腫瘤之一。即使可切除的NSCLC患者5年生存率仍令人失望,改善術(shù)后NSCLC患者局部控制率及遠(yuǎn)期生存率一直是臨床關(guān)注的焦點(diǎn),個(gè)體化化療是21世紀(jì)胸外科臨床發(fā)展的方向和理想治療模式[1]。本研究采用免疫組織化學(xué)檢測(cè)40例NSCLC患者手術(shù)切除的新鮮組織標(biāo)本中核苷酸還原酶M1亞基(ribonucleotide reductase subunit M1, RRM1)蛋白表達(dá)水平,同時(shí)進(jìn)行體外原代培養(yǎng),MTT藥敏試驗(yàn),檢測(cè)臨床常用非小細(xì)胞肺癌一線化療藥物吉西他濱(Gemcitabine)的敏感性,比較分析RRM1表達(dá)與吉西他濱耐藥的相關(guān)性。旨在探討其在NSCLC個(gè)體化治療中療效的意義,為敏感藥物的選擇提供參考。
材料與方法
一、 實(shí)驗(yàn)材料
1. 肺癌細(xì)胞: 收集2012年3月至2013年9月我科NSCLC患者手術(shù)切除的新鮮組織標(biāo)本40例。患者年齡38~68歲,平均年齡53歲,其中,男29例,女11例,均為Ⅰ-ⅢA期,肺腺癌23例、肺鱗癌15例,大細(xì)胞癌2例。
2. 化療藥物: 吉西他濱規(guī)格為200 mg/支,產(chǎn)地江蘇豪森藥業(yè),試驗(yàn)藥物濃度按文獻(xiàn)[1]配制,用無菌生理鹽水配成母液,按照實(shí)驗(yàn)藥物濃度的0.5倍、1.0倍、2倍的劑量進(jìn)行配制,保存于-20 ℃。
3. 主要試劑: RRM1多克隆抗體(美國PROTEINTECH公司);免疫組化(SP)試劑盒(美國DACO公司);DAB顯色試劑盒(美國DACO公司);RPMI-1640(美國Gibco公司);胰蛋白酶(美國Amresco公司);淋巴細(xì)胞分離液:(天津市秀鵬生物技術(shù)開發(fā)有限公司);小牛血清:(杭州四季青生物工程材料有限公司);MTT(四甲基氮唑藍(lán)):(美國Amresco公司);DMSO: 二甲基亞砜。
4. 實(shí)驗(yàn)儀器: 分析純(美國Sigma公司);離心機(jī)(Anke TGL-16B, 上海安亭科學(xué)儀器廠);超低溫冰箱(Revco Value Series, thermo fisher scientific LLC);電子天平(AUY220, SHMADZU);CO2培養(yǎng)箱(HARRIS-301T, HARRIS);倒置光學(xué)顯微鏡(南京江南永新光學(xué)有限公司);96孔細(xì)胞培養(yǎng)板(Costar公司);酶聯(lián)免疫檢測(cè)儀((Freedom Evolyzer-2,TeCan);電子恒溫三用水箱(達(dá)佳,廣東省汕頭市醫(yī)用設(shè)備廠有限公司);蠕動(dòng)泵(MILLPORE公司);微量振蕩器(MH-1型,江蘇海門市其林貝爾儀器制造有限公司)
二、研究方法
1. MTT法吉西他濱體外藥敏檢測(cè): 單細(xì)胞懸液按文獻(xiàn)[1]制備,取手術(shù)切除的新鮮癌組織約1.0 cm3大小,選取無壞死部分,立即浸入無菌培養(yǎng)瓶中,10 min內(nèi)轉(zhuǎn)運(yùn)至實(shí)驗(yàn)室。在超凈臺(tái)上,用無菌PBS液沖洗2次,切除組織包膜,結(jié)締組織與壞死組織,剪成盡可能小的組織碎塊,大小約1 mm3。將組織小塊置于0.25%胰酶40 ml中,裝入培養(yǎng)瓶,置于37 ℃水浴箱中30 min,并不時(shí)搖動(dòng),使其充分消化,期間在鏡下觀察,當(dāng)細(xì)胞變圓接近脫壁時(shí),棄消化液,用10 ml完全-1640終止消化。用200目篩網(wǎng)將消化后的細(xì)胞懸液過濾收集,用無菌PBS液洗滌2次(離心半徑 8 cm,1500 r/min,離心 20 min),懸于20 ml完全-1640中,鏡下觀察細(xì)胞。于無菌離心管中依次輕輕加入100%及60%的淋巴細(xì)胞分離液各10 ml,其上再沿管壁輕輕加入細(xì)胞懸液(離心半徑 8 cm,2000 r/min,離心20 min),收集60%分離液界面上的細(xì)胞,加5倍無菌PBS液(離心半徑 8 cm,2000 r/min,離心20 min),去上清,加15ml無菌PBS液,離心前進(jìn)行細(xì)胞計(jì)數(shù),再次離心,(離心半徑 8 cm 2000 r/min,離心20 min)去上清,調(diào)整細(xì)胞濃度為(1×105~2×105/ml)。種96孔板,分別設(shè)加藥孔,陰性對(duì)照孔,空白孔,并設(shè)3復(fù)孔。在7 ℃、5%CO2培養(yǎng)箱中培養(yǎng)24 h后,加藥孔加入吉西他濱,陰性對(duì)照孔與空白孔均加完全-1640,繼續(xù)培養(yǎng)48 h,MTT法進(jìn)行藥敏檢測(cè),參照《細(xì)胞培養(yǎng)》[2]計(jì)算活性抑制率,當(dāng)加藥組血漿高峰濃度水平時(shí)的抑制率大于50%時(shí),即為高敏,小于30%為耐藥,介于2者之間為中敏。
2. SP法RRM1蛋白表達(dá)水平檢測(cè): 手術(shù)切除的新鮮組織標(biāo)本40例,用10%中性福爾馬林固定,石蠟包埋,鏈霉素抗生物素蛋白-過氧化物酶連接法(SP 法)進(jìn)行免疫組化檢測(cè)其RRM1蛋白,實(shí)驗(yàn)步驟按SP試劑盒說明書進(jìn)行。
三、統(tǒng)計(jì)學(xué)方法
采用SPSS13.0軟件對(duì)數(shù)據(jù)進(jìn)行χ2檢驗(yàn),組間比較用四格表的確切概率法,P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
結(jié) 果
40例新鮮組織標(biāo)本體外藥敏實(shí)驗(yàn)對(duì)吉西他濱敏感者22例,耐藥18例。40例石蠟包埋標(biāo)本RRM1高表達(dá)17例,低表達(dá)23例。17例RRM1高表達(dá)組,對(duì)吉西他濱敏感7例,敏感率41.2%,而23例RRM1低表達(dá)組,對(duì)吉西他濱敏感17例,敏感率73.9%,見表1。對(duì)同時(shí)滿足RRM1低表達(dá)組中MTT藥敏提示對(duì)吉西他濱敏感者選用GP(順鉑+吉西它濱)方案化療4個(gè)療程,其余選用可接受的二線方案(順鉑+多西他賽)化療4個(gè)療程。對(duì)照組40例以國際公認(rèn)標(biāo)準(zhǔn)方案或經(jīng)驗(yàn)用藥為主,包括順鉑+長春瑞濱,順鉑+紫杉醇,順鉑+長春花堿,順鉑+吉西它濱,順鉑+多西他賽等化療方案。隨訪6個(gè)月~2年,實(shí)驗(yàn)組與對(duì)照組完全緩解(CR)+部分緩解(PR)即有效率分別為44.5%和42.4%、疾病穩(wěn)定(SD)分別為32.5%和28.1%、疾病進(jìn)展(PD)分別為25.3%和28.5%,差異均無統(tǒng)計(jì)學(xué)意義。而中位生存時(shí)間(MST)分別為19.3個(gè)月和14.8個(gè)月(P<0.05),中位無進(jìn)展生存(PFS)為6.7個(gè)月和6.5個(gè)月(P>0.05),見表2。
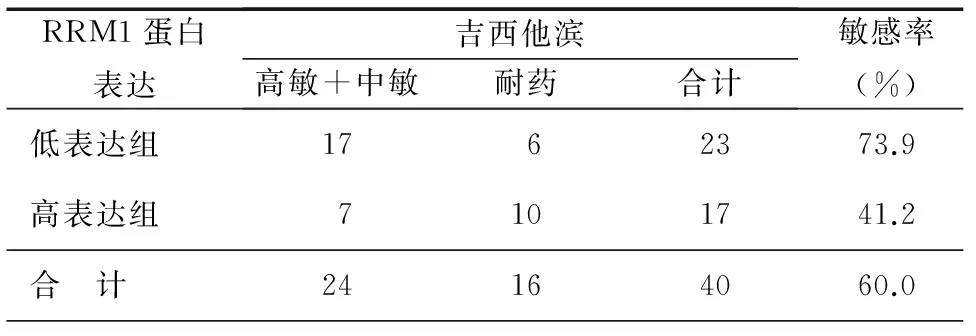
表1 RRM1蛋白表達(dá)與吉西他濱體外藥敏實(shí)驗(yàn)的相關(guān)性
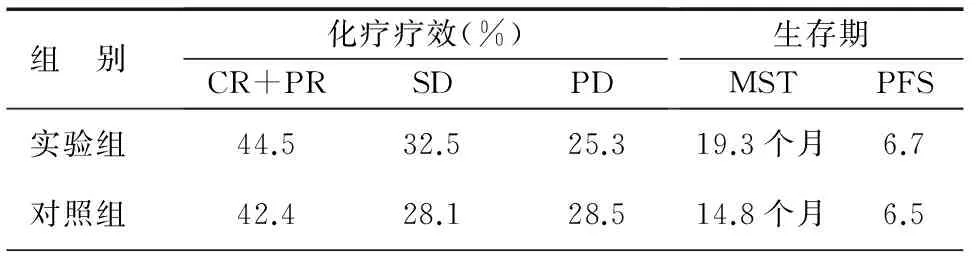
表2 兩組化療效果比較
注:CR:完全緩解;PR:部分緩解;SD:疾病穩(wěn)定;PD:部分緩解;MST:中位生存時(shí)間;PFS:中位無進(jìn)展生存
討 論
肺癌是目前最常見的惡性腫瘤之一,惡性程度很高,其發(fā)病率及病死率均居首位[2]。其中80%的肺癌是NSCLC,手術(shù)已成為早期NSCLC的標(biāo)準(zhǔn)治療。但約1/3甚至近1/2的NSCLC就診時(shí)已屬晚期,可手術(shù)切除的患者5年生存率僅為30%~40%[3],故化療在術(shù)后局部控制及提高遠(yuǎn)期生存方面起著重要作用。但選擇對(duì)NSCLC有效的化療藥物,一直是臨床腫瘤化療關(guān)注的問題。
針對(duì)NSCLC術(shù)后化療藥物的選擇,國內(nèi)外多采用耐藥蛋白的測(cè)定,藥敏實(shí)驗(yàn)或經(jīng)驗(yàn)用藥等提高療效,但術(shù)后10%~15%的患者經(jīng)歷復(fù)發(fā),15%~60%的患者發(fā)生遠(yuǎn)處轉(zhuǎn)移[4]。究其原因,NSCLC不同患者對(duì)同一種化療藥物敏感性可能不同,并與肺癌細(xì)胞的生物學(xué)特性、患者個(gè)體差異、化療藥物的毒性反應(yīng)等多因素相關(guān)。目前,各級(jí)醫(yī)院采用同一個(gè)化療方案治療不同的NSCLC患者,帶有一定的盲目性。患者因病理類型及個(gè)體差異的原因?qū)熕幬锏拿舾行杂休^大差異,因此越來越多的耐藥蛋白的檢測(cè)以及不同的體外藥敏試驗(yàn)方法應(yīng)用于臨床,作為選擇敏感化療方案,實(shí)行個(gè)體化治療的手段。
吉西他濱作為NSCLC化療的一線藥物,具有一定優(yōu)勢(shì)得到普遍認(rèn)可[5-6]。但耐藥的發(fā)生減弱了吉西他濱在NSCLC治療中的療效。RRM1是核苷酸還原酶(ribonucleotide reductase, RR)的一個(gè)亞單位,RR使核糖核酸轉(zhuǎn)變成的脫氧核苷酸是DNA合成和修復(fù)所必需的物質(zhì)。RRMl定位于染色體11ql5.5區(qū)域,以上特性決定了 RRMl可能與NSCSL患者的化療耐藥與預(yù)后相關(guān)[7-8]。Rosell等[9]研究認(rèn)為RRMl是吉西他濱的分子作用靶點(diǎn),多項(xiàng)研究顯示吉西他濱耐藥與RRM1蛋白表達(dá)相關(guān),但臨床治療NSCLC可選擇的藥物有很多種,進(jìn)行單一生物學(xué)標(biāo)志物RRM1的檢測(cè)其預(yù)測(cè)能力是不足的。故本實(shí)驗(yàn)加入了更精細(xì)的細(xì)胞培養(yǎng)技術(shù)與體外藥敏試驗(yàn)技術(shù)相結(jié)合的方法進(jìn)行聯(lián)合檢測(cè),期望達(dá)到更精確的個(gè)體化治療[10-16]。
我們將80例患者隨機(jī)分為2組,患者均在自愿接受不同治療方案前簽署知情同意書,我們用免疫組織化學(xué)方法檢測(cè)40例NSCLC手術(shù)切除的新鮮組織標(biāo)本的核苷酸還原酶M1亞基(RRM1)蛋白表達(dá)水平,RRM1低表達(dá)23例,同時(shí)對(duì)新鮮腫瘤組織進(jìn)行體外原代培養(yǎng),并作了MTT藥敏試驗(yàn),其中17例對(duì)吉西他濱敏感,RRM1高表達(dá)17例,其中7例對(duì)吉西他濱敏感,差異具有統(tǒng)計(jì)學(xué)意義。結(jié)果顯示RRM1低表達(dá)多數(shù)對(duì)吉西他濱敏感,RRM1高表達(dá)多數(shù)對(duì)吉西他濱耐藥,針對(duì)低表達(dá)組中對(duì)吉西他濱敏感的患者我們選用標(biāo)準(zhǔn)一線化療方案吉西他濱+順鉑,而其余患者選用二線方案多西他賽+順鉑。另外40例對(duì)照患者在經(jīng)驗(yàn)用藥方案下接受治療,結(jié)果顯示實(shí)驗(yàn)組有效率分為44.5%,對(duì)照組為42.4%、實(shí)驗(yàn)組SD為32.5%,對(duì)照組為28.1%、實(shí)驗(yàn)組PD為25.3%,對(duì)照組PD為28.5%,實(shí)驗(yàn)組PFS為6.7個(gè)月,對(duì)照組為6.5個(gè)月,4組數(shù)據(jù)進(jìn)行統(tǒng)計(jì)學(xué)分析,差異均無統(tǒng)計(jì)學(xué)意義,而實(shí)驗(yàn)組MST為19.3個(gè)月,對(duì)照組為14.8個(gè)月,P<0.05。表明將RRM1蛋白的表達(dá)與吉西他濱體外藥敏實(shí)驗(yàn)相結(jié)合的治療方法可使患者獲得更長的生存期。
本研究結(jié)果顯示:將RRM1蛋白表達(dá)與吉西他濱體外藥敏實(shí)驗(yàn)相結(jié)合,可作為NSCLC個(gè)體化治療的選擇之一。將該方法應(yīng)用于臨床,建立肺癌藥敏檢測(cè)系統(tǒng),可使患者獲得更長的生存期,在肺癌的綜合治療中具有一定的臨床實(shí)用價(jià)值。本研究中涉及的免疫組化方法,肺癌細(xì)胞原代培養(yǎng)及MTT試驗(yàn)均為常見試驗(yàn)技術(shù),該方法重復(fù)性好、操作簡便、利于推廣。
但本研究也有不足之處:試驗(yàn)病例較少,前述結(jié)論需在以后的病例收集中進(jìn)一步驗(yàn)證。實(shí)驗(yàn)組選用多西他賽+順鉑方案未做耐藥蛋白檢測(cè)及體外藥敏試驗(yàn),部分患者也可能耐藥。該方法中的難點(diǎn)在于肺癌細(xì)胞的原代培養(yǎng),尤其是滿足藥敏試驗(yàn)的肺癌細(xì)胞數(shù)是關(guān)鍵,若要推廣還需進(jìn)一步簡化試驗(yàn)流程,才能使該方法更加成熟。
1 劉 浩, 洪志鵬, 尹小川, 等. 人非小細(xì)胞肺癌細(xì)胞的原代培養(yǎng)及個(gè)體化藥敏實(shí)驗(yàn)研究[J/CD]. 中華肺部疾病雜志:電子版, 2011, 4(2): 94-97.
2 Alberg AJ, Ford JG, Samet JM, et al. Epidemiology of lung cancer:ACCP evidence-based clinical practice guidelines(2nd edition)[J]. Chest, 2007, 132(3 suppl): 29S-55S.
3 Jemal A, Siegel R, Xu J, et al. Cancer Statistic, 2010[J]. CA Cancer J Clin, 2010, 60(5): 277-300.
4 Roth JA, Cox JD, Hong WK. 主編. 張?zhí)m軍, 張 力, 龍 浩, 等主譯. 肺癌[M]. 第3版. 北京:世界圖書出版公司, 2011: 222.
5 Le Chevalier T, Scagliotti G, Natale R, et al. Efficacy of gemcitabine plus platinum chemotherapy compared with other platinum containing regimens in advanced non-small cell lung cancer:a meta-analysis of survival outcomes[J]. Lung Cancer, 2005, 47(1): 69-80.
6 Grossi F, Aita M, Dcffcrrari C, et al. Impact of third-generation drugs on the activity of first-line chemotherapy in advanced non-small cell lung cancer:a meta-analytical approach[J]. Oncologist, 2009, 14(5):497-510.
7 Torrents E, Aloy P, Gibert I, et al. Ribonucleotide reductases:diverngeng evolution of an ancient enzyme[J]. J Mol Evol, 2002, 55(2): 138-152.
8 Bepler G. Using translational research to tailor the use of chemotherapy in the treatment of NSCLC[J]. Lung Cancer, 2005, 50(Suppl 1): S13-14.
9 Rosell R, Cobo M, Isla D, et al. Pharmacogenomics and gemcitabine [J]. Ann Oncol, 2006, 17(s5): v13-16.
10 Goan YG, Zhou B, Hu E, et al. Overexpression of ribonucleotide reductase as a mechanism of resistance to 2, 2-difluorodeoxy-cytidine in the human KB cancer cell line[J]. Cancer Res, 1999, 59(17): 4204.
11 Dumontet C, Fabianowska-Majewsda K, Mantincic D, et al. Common resistance mechanisms to deoxynucleoside analogues in variants of the human erythroleuk- aemic line K562[J]. Br J Haematol, 1999, 106(1): 78.
12 Davidson JD, M aL, Flagela M, et al. An increase in the expression ofribonucleo-tide reductase large subunit1 is associated with gemcitabine resistance in non-small cell lung cancer cell lines[J]. Cancer Res, 2004, 64(11): 3761.
13 Boukovinas I, Papadaki C, Mendez P, et al. Tumor RRCA1, RRMl and RRM2 mRNA expression levels and clinical response to first-line gemcitabine plus docetaxel in non-small-cell lung cancer patients[J]. PLoS One, 2008, 3(11): e3695.
14 Simon G, Sharma A, Li X, et al. Feasibility and efficacy of molecular analysis-directed individualized therapy in advanced non-small-cell lung cancer[J]. J Clin Oncol, 2007, 25(19): 2741-2746.
15 Bepler G, Sharma H, Greenherg A, at al. Prospective evaluation of RRMl as a predictor of response to gemcitabine/carboplatin in non-small cell lung cancer[J]. J Clin OncoL, 2006, 24(18s Partl):377s.
16 Bepler G, Kusmartseva I, Sharma S, et al. RRM1 modulated in vitro and in vivo efficacy of Gemcitabine and Platinum in non-small-cell lung cancer[J]. J Clin Oncol, 2006, 24(29): 4731-4737.
(本文編輯:黃紅稷)
黃 娟,劉 浩,鄧 沖. RRM1蛋白表達(dá)與體外藥敏實(shí)驗(yàn)檢測(cè)對(duì)指導(dǎo)非小細(xì)胞肺癌化療的價(jià)值[J/CD]. 中華肺部疾病雜志: 電子版, 2015, 8(1): 76-78.
·醫(yī)學(xué)動(dòng)態(tài)·
科學(xué)家最新發(fā)現(xiàn):注射細(xì)菌殺滅癌細(xì)胞
近日,在好萊塢舉辦的年度臨床介入腫瘤學(xué)研討會(huì)上,來自Anderson癌癥研究中心的研究人員通過研究揭示了,利用細(xì)菌或許可以幫助治療癌癥。研究人員將一種名為諾維氏芽孢桿菌-NT(Clostridium novyi-NT)的細(xì)菌的孢子注射入6位病人機(jī)體的腫瘤中,隨后細(xì)菌就可以在腫瘤中生長并且殺滅癌細(xì)胞。
在將諾維氏芽孢桿菌-NT注射入癌癥病人機(jī)體之前,研究人員首先通過移除該細(xì)菌的危險(xiǎn)毒素來降低細(xì)菌的危險(xiǎn)性;研究結(jié)果顯示6位病人均存活下來了,但其中有一位病人在細(xì)菌注射后因一些非相關(guān)的原因發(fā)生了死亡。研究者Ravi Murthy表示,當(dāng)腫瘤生長達(dá)到一定尺寸后,其中一部分腫瘤組織就不再需要氧氣了,其就會(huì)對(duì)常規(guī)的癌癥療法產(chǎn)生耐受性,比如對(duì)放療和化療產(chǎn)生耐受等;而諾維氏芽孢桿菌-NT則可以在無氧狀態(tài)下生存從而在不影響正常組織的情況下破壞腫瘤細(xì)胞,同時(shí)該細(xì)菌也會(huì)誘發(fā)機(jī)體對(duì)癌癥產(chǎn)生免疫反應(yīng)。
從本質(zhì)上來講,諾維氏芽孢桿菌-NT在腫瘤組織中可以引發(fā)潛在的殺滅癌細(xì)胞的感染過程,本文研究對(duì)于后期開發(fā)新型的抗癌療法提供了新的研究思路和依據(jù)。
10.3877/cma.j.issn.1674-6902.2015.01.020
四川省瀘州市科技局基金資助(2012-177)
646000 四川,瀘州醫(yī)學(xué)院附屬醫(yī)院病理科1646000 四川,瀘州醫(yī)學(xué)院附屬中醫(yī)醫(yī)院胸外科2、 中心實(shí)驗(yàn)室3
劉 浩, Email: liuhaoer@sina.com
R563,R734.2
B
2014-06-22)

