慢性阻塞性肺疾病合并肺癌122例臨床特征分析
廖 晨 余祖濱 張 萍 陳 敏 李亞斐 白 莉
·論著·
慢性阻塞性肺疾病合并肺癌122例臨床特征分析
廖 晨1余祖濱2張 萍3陳 敏1李亞斐4白 莉1
目的探討慢性阻塞性肺疾病(COPD)合并肺癌的臨床特征,為肺癌的早期診斷及治療創造最佳時機。方法采用病例對照研究,回顧性分析122例COPD合并肺癌患者,匹配年齡、性別后選擇同期收治的124例單純肺癌患者為對照組,記錄二組患者的性別、年齡、體重指數(BMI)、吸煙史、吸煙指數,肺癌的臨床癥狀、病理類型、分期、肺功能指標、確診方法、治療方法及化療效果等資料,采用SPSS13.0統計軟件對上述結果進行統計分析。結果COPD合并肺癌組年齡、性別、BMI較單純肺癌組無統計學差異(P>0.05),吸煙者中COPD合并肺癌組(均數910.8支/年)吸煙指數明顯高于單純肺癌組(均數764.7支/年)(P<0.05);吸煙COPD合并肺癌患者中,病理類型為腺癌患者(均數46.8%)第一秒用力呼氣容積占預計值百分比(FEV1.0%pred)明顯低于鱗癌(均數54.7%)和小細胞肺癌患者(均數58.0%)(P<0.05);COPD合并肺癌組中央型肺癌83例,占68.0%,病理類型以鱗癌(49.2%)為主,與單純肺癌組比較差異有統計學意義(P<0.05)。結論COPD合并肺癌組患者以中央型鱗癌較為常見,確診時以Ⅲ、Ⅳ期為主,臨床特征缺乏特異性,早期診斷困難。
肺疾病,慢性阻塞性; 原發性支氣管肺癌; 對照研究
大量流行病學研究表明,慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是肺癌的獨立危險因素[1],盡管二者共同的發病機制尚未完全闡明。目前的研究推測兩種疾病合并存在可能與煙霧暴露、氧化應激、慢性炎癥反應、肺功能下降、遺傳易感性等因素有關[2]。由于COPD患者原有呼吸道癥狀較多,很容易掩蓋肺癌的早期表現,從而導致肺癌的誤診和漏診,在臨床確診時已是肺癌晚期。已經確診的COPD合并肺癌的患者,常常由于其肺功能和體能狀況(PS)評分差,喪失治療機會。本研究收集2008年1月至2012年12月我院收治的122例COPD 合并肺癌患者的臨床資料,并以對照方式分析患者的一般資料、肺功能檢查結果及臨床診治情況,現報道如下。
資料與方法
一、一般資料
二、納入及排除標準
1.納入標準:①所以患者經過組織病理學確診為原發性支氣管肺癌,按國際肺癌研究協會2009年第七版分期標準進行TNM分期[3];②所有納入的COPD患者均符合中華醫學會呼吸病學分會制定的COPD診斷標準[4]。
2.排除標準:合并其他部位惡性腫瘤患者。
三、研究方法
回顧性分析122例COPD合并肺癌患者和124例單純肺癌患者的臨床病例資料,記錄患者的年齡、性別、BMI、吸煙史(包括現在吸煙者和既往吸煙者)、吸煙指數(每天吸煙支數×吸煙年數),肺癌的臨床癥狀、病理類型、TNM分期、肺功能指標、確診肺癌的方法、治療方法及化療療效等資料。
四、統計學方法
采用SPSS 13.0軟件對結果進行統計學分析。計數資料比較采用χ2檢驗,計量資料的比較采用t檢驗,以P<0.05為差異有統計學意義。
結 果
一、不同病理類型肺功能比較
COPD合并肺癌組患者按COPD全球創議(GOLD)肺功能分級[5]:Ⅰ級(輕度):7例(5.7%);Ⅱ級(中度):60例(49.2%);Ⅲ級(重度):45例(36.9%);Ⅳ級(極重度):10例(8.2%)。在檢出的107例COPD合并肺癌的吸煙者中,病理類型主要為鱗癌;鱗癌、腺癌、小細胞未分化癌三組之間年齡、BMI、吸煙指數比較未見統計學差異。肺功能相關指標中,FVC、FEV1.0占預計值百分比(FEV1.0%pred)、FEV1.0/FVC各組內比較無顯著差異(P>0.05)。而FEV1.0% pred組內兩兩比較中,腺癌與鱗癌、小細胞肺癌比較差異顯著(分別為46.8±16.7vs. 54.7±16.6,P=0.045; 46.8±16.7vs. 58.0±20.4,P=0.037),即合并腺癌的COPD患者,與鱗癌和小細胞肺癌患者相比肺通氣功能明顯下降,見表1。

表1 107例吸煙COPD合并肺癌患者一般資料及肺功能比較
注:FVC:用力肺活量;FEV1.0:第一秒用力呼氣容積;FEV1.0%pred:第一秒用力呼氣容積占預計值的百分比
二、兩組的臨床特征表現
COPD合并肺癌患者中,其就診時最主要的臨床表現是原有的咳嗽、咳痰、呼吸困難癥狀較基線水平加重,咯血、進行性消瘦等癥狀與單純肺癌組有統計學差異(P<0.05);胸痛、聲音嘶啞等癥狀與單純肺癌組比較差異無統計學意義(P>0.05),見表2。
三、確診方法及解剖學分型
122例COPD合并肺癌患者中,支氣管鏡活檢診斷77例(63.1%),CT引導經皮穿刺活檢診斷39例(32.0%),淋巴結活檢4例(3.3%),超聲引導經皮穿刺活檢診斷1例(0.8%),胸水脫落細胞學診斷1例(0.8%)。單純肺癌組患者中,支氣管鏡活檢診斷57例(46.0%),CT引導經皮穿刺活檢診斷50例(40.3%),淋巴結活檢10例(8.1%),內科胸腔鏡活檢診斷4例(3.2%),超聲引導經皮穿刺活檢診斷2例(1.6%),胸膜活檢診斷1例(0.8%),兩組比較差異有統計學意義(P<0.05),見表3。COPD合并肺癌組中胸部CT表現示中央型肺癌83例(68.0%),周圍型肺癌39例(32.0%);單純肺癌組中央型58例(46.8%),周圍型66例(53.2%),兩組比較差異有統計學意義(P<0.05),即COPD合并肺癌組中央型肺癌明顯多于單純肺癌組,見表4。

表2 兩組患者臨床癥狀比較
注:a為連續性校正χ2值及P值

表3 兩組患者肺癌確診方法比較[n(%)]
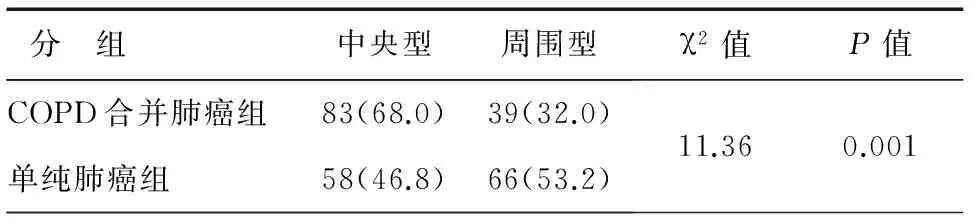
表4 兩組患者胸部CT表現[n(%)]
四、肺癌分期及治療方法
兩組246例患者中,203例患者為晚期肺癌,治療主要以非手術治療為主。COPD合并肺癌組比較單純肺癌組TNM分期無統計學差異(P>0.05);治療方法有全身化療、放化療結合治療、化療聯合靶向藥物治療及未治療,兩組比較均無統計學差異(P>0.05),見表5。

表5 COPD合并肺癌組和單純肺癌組患者一般資料比較
注:BMI:體重指數;a為連續變量,均數±標準差描述,檢驗值為t值
五、化療療效評估
兩組246例患者中,119例患者在我科接受全身化療,化療周期數在2次以上,并在第3周期化療前進行全身評估,其中COPD合并肺癌組52例,單純肺癌組67例,化療反應性無完全緩解(CR),分別為病灶部分緩解(PR)、病灶穩定(SD)和病灶進展(PD),兩組間比較無明顯統計學差異(P>0.05),見表6。

表6 兩組化療療效比較[n(%)]
注:PR:部分緩解;SD:病灶穩定;PD:病灶進展
討 論
大量的流行病學證據顯示,在校正年齡、性別、職業及吸煙史等因素后,吸煙COPD患者肺癌發生率是吸煙非COPD患者的4~5倍[6-7]。COPD是肺癌圍手術期死亡和呼吸系統并發癥的主要預測因子[8-9]。對于合并嚴重COPD的肺癌患者,由于肺功能限制,不能給予根治性治療。只有充分了解這部分病例的臨床特征,給予充分評估,才能制定個體化的有效治療。
吸煙是導致肺癌和COPD發生的共同危險因素。85%~90%的肺癌或COPD患者與香煙煙霧暴露有關,吸煙史是促使發生支氣管上皮鱗癌的重要危險因素[10]。另外COPD引起氣道上皮組織增生、纖維化,使上皮細胞對致癌原包括香煙煙霧敏感而促成癌變[11]。本資料中發現122例COPD合并肺癌患者中,有116例患者有吸煙史,且本組在有吸煙史的患者中,COPD合并肺癌組吸煙指數明顯高于單純肺癌組,差異有統計學意義。但本組在對不同病理類型鱗癌、腺癌、小細胞肺癌的比較中,顯示差異無統計學意義。COPD合并肺癌組中以中央型肺癌多見,且病理類型以鱗癌為主(60例,49.2%),其次是腺癌和小細胞癌,與既往國內外相關報道一致[12]。
FEV1.0/FVC、FEV1.0%pred是診斷COPD和肺功能分級評估的主要指標。研究表明FEV1.0降低的吸煙者與FEV1.0正常的吸煙者相比,肺癌發病率增加[13]。吸煙的COPD患者肺癌的發病率是吸煙非COPD患者的2~5倍[14],高度提示FEV1.0下降是肺癌重要的獨立危險因素。然而FEV1.0指標與肺癌發病率并非完全呈正相關,de Torres等[15]的研究發現,肺癌發生率在輕中度(GOLDⅠ-Ⅱ)COPD患者明顯高于(GOLD Ⅲ-Ⅳ)COPD患者,有研究者認為這可能與生存效應有關[16]。另一個可能的解釋是COPD患者在Ⅰ-Ⅱ級肺功能時向兩個方向發展,要么導致COPD程度加重,要么促進腫瘤的發生,究竟發生何種轉歸可能與其炎癥微環境有關。本研究中,肺癌發生率在中度COPD(GOLD Ⅱ級)患者中最高,可高達49.2%,與de Torres等的研究結果一致。de Torres等[15]的研究發現肺CO彌散量也是肺癌的獨立危險因素,在氣道阻塞程度較輕的COPD患者中其意義尤其值得關注。但本組病例中大多數患者未行彌散功能的檢測,無法對其進行分析。
本組COPD合并肺癌122例患者臨床表現多為COPD急性加重癥狀:如咳嗽、咳痰、呼吸困難為主,缺乏特異性,但是咯血和進行性消瘦癥狀較單純肺癌組增多。因此,COPD患者如出現咯血、進行性消瘦的癥狀,應高度警惕,及時進行肺癌相關檢查。在COPD患者中建立有效的肺癌篩查方法和預防措施是非常必要的。有研究報道低劑量胸部CT篩查能早期診斷肺癌,使肺癌病死率減低20%[17],雖然該項檢查對健康體檢者常規進行胸部CT檢查花費高、代價大,未得到廣泛認可。結合本研究結果,COPD合并肺癌患者確診時以Ⅲ-Ⅳ期為主,鱗癌居多,確診時常常失去手術機會,化療效果差,其預后明顯較單純肺癌差[18]。因此,對于COPD患者定期進行胸部CT篩查對于COPD合并肺癌的早期診斷、早期治療、改善預后十分必要。需要指出的是,由于本研究為回顧性病例對照研究,大部分患者失訪,其預后資料尚未獲得,無法對其預后進行分析。
盡管有研究提出慢性炎癥是COPD合并肺癌的重要機制[19],且提示長期吸入糖皮質激素可以減少COPD患者肺癌的發生率和病死率,證實抑制炎癥可阻止肺癌細胞生長[20]。但在COPD疾病進程中,炎癥信號如何誘導肺癌的發生發展,其分子機制尚不清楚。未來的研究仍需進一步揭示COPD和肺癌共同的分子機制,這將有助于為COPD疾病管理和肺癌的早期防治提供新的思路。
1 Young RP, Hopkins RJ, Christmas T, et al. COPD prevalence is increased in lung cancer, independent of age, sex and smoking history[J]. Eur Respiratory J, 2009, 34(2): 380-386.
2 Houghton AM. Mechanistic links between COPD and lung cancer[J]. Nat Rev Cancer, 2013, 13(6): 233-245.
3 葉 波, 楊龍海, 劉向陽. 最新國際肺癌tnm分期標準(第7版)修訂稿解讀[J]. 中國醫刊, 2008, 43(1): 21-23.
4 中華醫學呼吸病分會慢性阻塞性肺病學組. 慢性阻塞性肺疾病診治指南(2007年修訂版) [J]. 中華結核和呼吸雜志, 2007, 46(3): 254-261.
5 Gómez FP, Rodriguez-Roisin R. Global Initiative for Chronic Obstructive Lung Disease (GOLD) guidelines for chronic obstructive pulmonary disease[J]. Curr Opin Pulm Med, 2002, 8(2): 81-86.
6 Cappello F, Di Stefano A, David S, et al. Hsp60 and Hsp10 down-regulation predicts bronchial epithelial carcinogenesis in smokers with chronic obstructive pulmonary disease[J]. Cancer, 2006, 107(10): 2417-2424.
7 Skillrud DM, Offord KP, Miller RD. Higher risk of lung cancer in chronic obstructive pulmonary disease. A prospective, matched, controlled study[J]. Ann Intern Med, 1986, 105(4): 503-507.
8 Kondo R, Yoshida K, Eguchi T, et al. Clinical features of lung cancer in smokers with light and mild chronic obstructive pulmonary disease: a retrospective analysis of Japanese surgical cases[J]. Eur J Cardiothorac Surg, 2011, 40(6): 1439-1443.
9 Licker MJ, Widikker I, Robert J, et al. Operative mortality and respiratory complications after lung resection for cancer: impact of chronic obstructive pulmonary disease and time trends[J]. Ann Thorac Surg, 2006, 81(5): 1830-1837.
10 Stayner LT, Wegman DH. Smoking, occupation, and histopathology of lung cancer: a case-control study with the use of the Third National Cancer Survey[J]. J Natl Cancer Inst, 1983, 70(3): 421-426.
11 Lin WW, Karin M. A cytokine-mediated link between innate immunity, inflammation, and cancer[J]. J Clin Invest, 2007, 117(5): 1175-1183.
12 Papi A, Casoni G, Caramori G, et al. COPD increases the risk of squamous histological subtype in smokers who develop non-small cell lung carcinoma[J]. Thorax, 2004, 59(8): 679-681.
13 Wasswa-Kintu S, Gan WQ, Man SF, et al. Relationship between reduced forced expiratory volume in one second and the risk of lung cancer: a systematic review and meta-analysis[J]. Thorax, 2005, 60(7): 975-975.
14 Mayne ST, Buenconsejo J, Janerich DT. Previous lung disease and risk of lung cancer among men and women nonsmokers[J]. Am J Epidemiol, 1999, 149(1): 13-20.
15 de Torres JP, Marin JM, Casanova C, et al. Lung cancer in patients with chronic obstructive pulmonary disease-incidence and predicting factors[J]. Am J Respir Crit Care Med, 2011, 184(8): 913-919.
16 Barnes PJ, Adcock IM. Chronic obstructive pulmonary disease and lung cancer: a lethal association[J]. Am J Respir Crit Care Med, 2011, 184(8): 866-867.
17 National Lung Screening Trial Research Team, Aberle DR, Adams AM, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409.
18 Kiri VA, Soriano J, Visick G, et al. Recent trends in lung cancer and its association with COPD: an analysis using the UK GP Research Database[J]. Prim Care RespirJ, 2010, 19(1): 57-61.
19 Lee G, Walser TC, Dubinett SM. Chronic inflammation, chronic obstructive pulmonary disease, and lung cancer[J]. Curr Opin Pulm Med, 2009,15(4):303-307.
20 Kiri VA, Fabbri LM, Davis KJ, et al. Inhaled corticosteroids and risk of lung cancer among COPD patients who quit smoking[J]. Respir Med, 2009, 103(1): 85-90.
(本文編輯:王亞南)
廖 晨,余祖濱,張 萍,等. 慢性阻塞性肺疾病合并肺癌122例臨床特征分析[J/CD]. 中華肺部疾病雜志: 電子版, 2015, 8(1): 30-34.
Clinical features of 122 cases of lung cancer with chronic obstructive pulmonary disease:a retrospective case-control analysis
LiaoChen1,YuZubin2,ZhangPing3,ChenMin1,LiYafei4,BaiLi1(1DepartmentofRespiratoryDisease,2DepartmentofThoracicSurgery,3DepartmentofInformationSection,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China;4DepartmentofEpidemiology,CollegeofPreventiveMedicine,ThirdMilitaryMedicalUniversity,Chongqing400038,China)
BaiLi,Email:blpost@126.com
Objective To investigate the clinical features of chronic obstructive pulmonary disease (COPD) complicated with lung cancer (LC), and to optimize the early diagnosis and treatment in the coexistence of COPD and lung cancer. Methods Through a retrospective case-control study, the data of clinical-pathological information were collected from 122 patients of COPD complicated with newly diagnosed LC (COPD-LC group), and 124 non-COPD patients of LC (LC group) that matched age and gender as control group. These clinical data (sex, age, BMI, Smoking history, Smoking Index, the clinical symptoms of lung cancer, pathological type, classification, lung function, diagnostic method, treatment, chemotherapy and so on) were analyzed using the SPSS 13.0. Results There were no significant difference in age, sex, BMI between COPD-LC and LC group respectively (P>0.05). The smoking index in COPD-LC group (mean 910.8) was higher than that of LC group (mean 764.7) (P<0.05). In COPD-LC group, FEV1.0%pred was lower in patients with adenocarcinoma (mean 46.8%) than squamous carcinoma (mean 54.7%) and small cell lung cancer (mean 58.0%) (P<0.05). There were significant difference in types and pathological types between COPD-LC and LC group, the most frequent anatomical type was central type, 83 cases (68.0%) and the most frequent histological type was squamous carcinoma in COPD-LC group (49.2%) (P<0.05). Conclusion The central squamous cell carcinoma is the most frequent type in patients with COPD-LC. Most of them were identified in late-stage (stage Ⅲ-Ⅳ) when the diagnosis of lung cancer was confirmed. Lack of specific clinical symptoms might delay the early diagnosis of lung cancer among patients with COPD.
Chronic obstructive pulmonary disease; Lung cancer; Retrospective case-control analysis
10.3877/cma.j.issn.1674-6902.2015.01.007
國家自然科學基金面上項目(81370139)
400037 重慶,第三軍醫大學新橋醫院呼吸內科1、胸外科2、信息資料科3400038 重慶,第三軍醫大學流行病學教研室4
白 莉,Email: blpost@126.com
R563
A
2014-11-19)

