miR-17表達對內皮細胞氧化應激作用的影響
楊碩,陳靜,胡琦,江洪
論著·基礎
miR-17表達對內皮細胞氧化應激作用的影響
楊碩,陳靜,胡琦,江洪
目的 探討microRNA-17(miR-17)表達對內皮細胞氧化應激作用的影響。方法 培養原代人臍靜脈內皮細胞(HUVEC),分別轉染陰性對照病毒[Ad(N)組]、上調miR-17腺病毒(Ad-Pre-miR-17組)及下調miR-17腺病毒(Ad-Antagomir-17組),用硝酸銀法檢測細胞內源性NO的釋放,DAF FM探針檢測細胞內NO含量,以及采用DHE探針檢測細胞內超氧化物(ROS)的含量,并進行統計分析。結果 與Ad(N)組比較,Ad-Antagomir-17組細胞內NO含量提高(P<0.05),細胞內ROS含量降低(P<0.05);而Ad-Pre-miR-17組細胞內NO含量降低(P<0.05),細胞內ROS含量增加(P<0.05)。結論 降低miR-17可以改善冠心病患者血流供應,降低氧化應激反應,有助于其血管功能的改善。
miR-17;內皮細胞;一氧化氮;氧化應激
經皮冠狀動脈介入術(PCI)是冠心病治療的重要手段,術后主要問題是容易出現支架內再狹窄和晚期支架內血栓[1,2],可以導致再次血運重建及心臟不良事件發生率明顯升高[3,4]。研究證實內皮損傷修復延遲是其共同的病理生理基礎[5,6],促使損傷部位早期形成功能完全的完整內皮層對于提高PCI 的有效性和安全性都具有重要意義。
microRNA 是一類內源性的具有調控功能的非編碼RNA,長約20~25 個核苷酸,成熟的microRNA 通過2 種途徑負向調節基因表達,即在翻譯水平上阻止蛋白合成和引起目的基因mRNA 的剪切降解[7]。有研究表明miR-17在內皮細胞(EC)中含量非常豐富[8],在腫瘤組織中發現miR-17 具有抗血管形成的能力,抑制其表達可提高內皮細胞體外血管生成密度[9,10]。由此我們推斷,對于損傷后血管內皮細胞,miR-17過表達可能導致內皮細胞損傷修復延遲。現從氧化應激方面闡述miR-17對內皮細胞的作用及機制。
1 材料與方法
1.1 材料 人臍靜脈內皮細胞(HUVEC)購買于美國Sciencell公司(Cat:8000),內皮細胞專用培養基(ECM)(美國Sciencell公司),DAF FM探針及DHE探針購買于美國invitrogen公司,NO試劑盒購買于南京建成公司。
1.2 內皮細胞培養 原代HUVEC用內皮細胞專用培養基(ECM)進行細胞培養,培養基中含有5%胎牛血清(FBS),1%內皮細胞生長因子(ECGS)以及1%雙抗。每2天換一次液,細胞融合達80%~90%時用胰酶消化傳代,傳至4~6代時進行病毒轉染。
1.3 實驗方法 病毒轉染:委托上海吉凱公司成功構建攜帶miR-17表達序列的腺病毒(Ad-Pre-miR-17),用于上調內皮細胞中miR-17的表達水平;同時構建攜帶miR-17反義序列的腺病毒(Ad-Antagomir-17),用于抑制miR-17的活性,下調內皮細胞中miR-17的含量;用含有相同基因片段,但不對體內microRNA產生干擾的腺病毒[Ad(N)]作為陰性對照。上述培養細胞,融合達80%~90%時,用胰酶消化計數,種于直徑60 mm的小皿之中,每皿調整細胞計數為6×105個,放入培養箱中培養過夜,使之貼壁。用不含血清及生長因子的基礎培養基同步化24 h后,分別按感染復數MOI=15/20/30/40轉入上述3組腺病毒,分為Ad-Pre-miR-17組、Ad-Antagomir-17組以及Ad(N)組。在無血清的培養基中培養4 h后,去除含病毒的培養液,加入完全培養基繼續培養72 h,熒光顯微鏡檢測轉染效率。
1.4 觀測項目
1.4.1 一氧化氮(NO)測定:(1)硝酸銀法測細胞內源性NO釋放:收集上述轉染病毒72 h后的細胞培養液,用南京建成公司的NO檢測試劑盒檢測上清液中的NO含量,具體做法參照說明書進行。(2)DAF-FM探針測細胞內NO含量:用DAF FM探針檢測細胞內NO的含量。將上述轉染病毒的細胞分別消化計數,種于24孔板中,每孔調整細胞計數為105,過夜使之貼壁,吸去原有培養基,加入含有DAF-FM的無血清培養基5 μmol/ml,在培養箱中培養30 min后,在熒光顯微鏡下觀察細胞的平均熒光強度,每孔隨機拍取6張照片,取平均熒光強度。
1.4.2 ROS熒光探針-DHE探針測內皮細胞氧化應激水平:用DHE探針檢測細胞內超氧化物(ROS)的含量。將上述轉染病毒的細胞分別消化計數,種于24孔板中,每孔調整細胞計數為105,過夜使之貼壁,吸去原有培養基,加入含有DHE(10 μmol/ml)的無血清培養基,在培養箱中培養30 min后,在熒光顯微鏡下觀察細胞的平均熒光強度,每孔隨機拍攝6張照片,取平均熒光強度。

2 結 果
2.1 病毒轉染效率 熒光顯微鏡下隨機選取6個視野計算綠色熒光細胞數及總細胞數檢測轉染效率,計算得出在MOI=30時轉染效率較高并且細胞狀態較好,漂浮細胞數少。Ad-Antagomir-17組轉染效率為81.2%,Ad(N)組轉染效率為79.8%,Ad-Pre-miR-17組轉染效率為80.6%,各組間差異無統計學意義(P>0.05)。見圖1(見封3)。
2.2 miR-17對內皮細胞一氧化氮(NO)的影響
2.2.1 硝酸銀法檢測結果:下調miR-17可以促進內皮細胞內源性NO的釋放,Ad(N)組NO釋放量為(113.0±3.1)μmol/L,Ad-Antagomir-17組NO釋放量為(138.7±4.2) μmol/L,比Ad(N)組增加了(22.7±5.236)%;相反,上調miR-17可以抑制內皮細胞內源性NO 的釋放,Ad-Pre-miR-17組NO釋放量為(35.23±1.0) μmol/L,比Ad(N)組下降了(68.8±3.3)%,2組比較具有統計學意義(P<0.05)。見圖2A。
2.2.2 DAF-FM探針檢測結果:下調miR-17可以促進內皮細胞內NO 的產生,Ad(N)組DAF-FM平均熒光強度為28.3 ± 1.7,Ad-Antagomir-17組DAF-FM平均熒光強度為44.4 ± 2.1,比Ad(N)組增加了(57.0±2.8)%;相反,上調miR-17可以抑制內皮細胞內NO 的產生,Ad-Pre-miR-17組DAF-FM平均熒光強度為18.3 ± 1.3,比Ad(N)組下降了(35.3±2.1)%,2組比較具有統計學意義(P<0.05)。見圖2B,圖3(見封3)。
2.3 miR-17對內皮細胞內超氧化物(ROS)含量的影響 下調miR-17可以降低內皮細胞內ROS的含量,Ad(N)組DHE平均熒光強度為28.3 ± 1.7,Ad-Antagomir-17組DHE平均熒光強度為18.0 ± 1.4,與Ad(N)組相比降低了(36.5±2.2)%,而上調miR-17則可以使內皮細胞內超氧化物含量增加,Ad-Pre-miR-17組DHE平均熒光強度為45.5 ± 3.7,與Ad(N)組相比增加了(60.8±4.2)%(P<0.05)。DHE探針檢測結果見圖4,圖5(見封3)。
2 討 論
目前已發現miR-17在腫瘤組織中具有抗血管形成的能力,下調miR-17還可以促進糖皮質激素介導的成骨細胞的分化和功能,此外其還與B細胞淋巴瘤、急性自身免疫性疾病等疾病有關[11~13]。近來研究發現,一些miRNA與心臟疾病的病理生理過程相關[14]。但是關于miR-17與心臟疾病的研究并不多。在大鼠頸總動脈損傷修復過程中,研究提示miR-17 表達持續升高;而促血管形成的miR-18a 和miR-19a 表達無明顯改變,之前還有研究證實miR-17與腫瘤組織的增殖和凋亡有關,我們前期實驗也證實miR-17可能與內皮細胞的遷移增殖有關[15]。由此我們猜測,miR-17可能與內皮細胞的其他功能如氧化應激等有關。

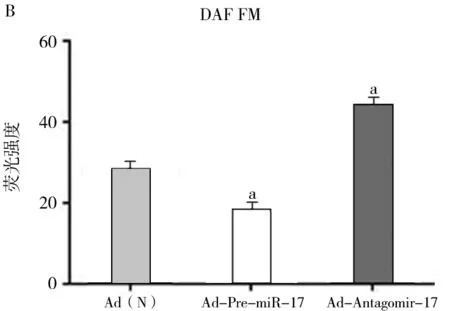
注:與Ad(N)組比較,aP<0.05
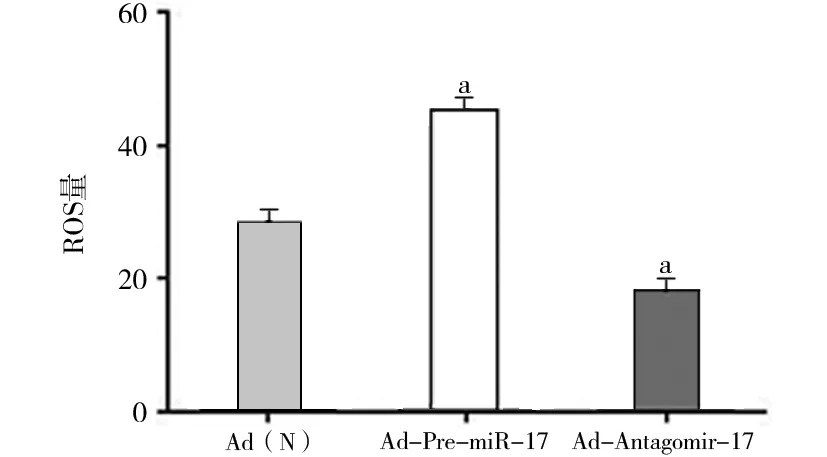
注:與Ad(N)組比較,aP<0.05
大多數情況下,內皮功能紊亂都是由于體內ROS過多導致的。ROS的體內生理平衡是由O2-生成酶和抗氧化劑共同決定的[16]。氧化應激形成是體內抗氧化系統如SOD、GSH-PX、GSH等防御機能減弱或是體內ROS產生過多的結果[17],使機體處于易損狀態。實驗證實ROS可導致內皮細胞生物膜脂質過氧化,降低膜的流動性,增加內皮細胞膜的通透性,引起內皮細胞腫脹,從而導致冠狀動脈血流量下降,加重血管及心肌損傷[18]。ROS還破壞內皮細胞源性一氧化氮合酶和四氫葉酸(一氧化氮合酶的重要輔助因子)的生物活性,導致NO合成減少[19]。此外,ROS還可以激活轉錄因子,促進黏附分子的表達,促進白細胞與內皮細胞的黏附作用,進而加重白細胞聚集,微血管阻塞。此外,ROS抑制細胞Na+-K+-ATP酶和內質網Ca2+-ATP酶的活性,從而導致細胞內鈣超載,從而進一步導致冠狀動脈血流量減少[20]。NO不但可以使血管舒張,阻止血小板聚集,抑制黏附分子(CD11/CD18)表達[21]。因此,NO合成減少可引起冠狀動脈血管收縮,血小板黏附、聚集形成微血栓,白細胞對內皮細胞的損傷增強,從而加重血管損傷并延遲其修復。
研究證實,氧化應激與多條通路有關,比如STAR、p38MAPK、PI3K/AKT、MEK/ERK等[22]。與內皮相關的通路大多為PI3K/AKT通路和MEK/ERK通路,本實驗證實,miR-17對內皮細胞ROS及NO具有調節作用,是否通過上述通路亦或者是通過多條通路共同作用目前尚不清楚,需要進一步研究證實。
綜上所述,下調miR -17對冠心病患者具有保護作用,而上調miR-17則作用相反。miR-17對冠心病患者血流供應的改變究竟只是通過氧化應激的作用還是通過對損傷血管的修復作用,還有待進一步的研究,而其對內皮細胞氧化應激的作用機制目前亦尚不明確,還需后續實驗進一步研究證實。
1 Al SJ,Berger PB,Holmes DJ.Coronary artery stents[J].JAMA,2000,284(14):1828-1836.2 Dangas GD,Claessen BE,Caixeta AA,et al.In-Stent restenosis in the Drug-Eluting stent era[J].J Am Coll Cardiol,2010,56(23):1897-1907.3 Farb A,Boam AB.Stent thrombosis redux-The FDA perspective[J].N Engl J Med,2007,356(10):984-987.
4 Joner M,Finn AV,Farb A,et al.Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk[J].J Am Coll Cardiol,2006,48(1):193-202.
5 Inoue T,Croce K,Morooka T,et al.Vascular inflammation and repair implications for Re-Endothelialization, restenosis, and stent thrombosis[J].JACC Cardiovasc Interv,2011,4(10):1057-1066.
6 Finn AV, Joner M, Nakazawa G, et al. Pathological correlates of late drug-eluting stent thrombosis: strut coverage as a marker of endothelialization[J].Circulation,2007,115 (18): 2435-2441.
7 Van Rooij E.The art of MicroRNA research[J].Circ Res,2011,108(2):219-234.
8 Bonauer A,Carmona G,Iwasaki M,et al.MicroRNA-92a controls angiogenesis and functional recovery of ischemic tissues in mice[J].Science,2009,324(5935):1710-1713.
9 Doebele C,Bonauer A,Fischer A,et al.Members of the microRNA-17-92 cluster exhibit a cell-intrinsic antiangiogenic function in endothelial cells[J].Blood,2010,115(23):4944-4950.
10 Yu Z,Willmarth NE,Zhou J,et al.microRNA 17/20 inhibits cellular invasion and tumor metastasis in breast cancer by heterotypic signaling[J].Proc Natl Acad Sci U S A,2010,107(18):8231-8236.
11 Jiang H,Chen J,Wang L,et al.Downregulation of CREB-binding protein expression inhibits thrombin-induced proliferation of endothelial cells:possible relevance to PDGF-B[J].Cell Biol Int,2010,34(12):1155-1161.
12 Chen J,Jiang H,Zhu LH,et al.Downregulation of CREB-binding protein expression sensitizes endothelial cells to serum-deprived apoptosis: important role of nitric oxide[J].Mol Cell Biochem,2010,337(1/2):159-166.
13 Changgui S,Jin Q,Ping HA,et al.MicroRNA-17/20a inhibits glucocorticoid-induced osteoclast differentiation and function through targeting RANKL expression in osteoblast cells[J].Science Direct,2014,67(11):67-75.
14 Du WJ,Pan ZW,Chen X,et al.By targeting Stat3 microRNA-17-5p promotes cardiomyocyte apoptosis in response to ischemia followed by reperfusion[J].Cellular Physiology and Biochemistry,2014,34(3):955-965.
15 Ji R,Cheng Y,Yue J,et al.MicroRNA expression signature and antisense-mediated depletion reveal an essential role of MicroRNA in vascular neointimal lesion formation[J].Circ Res,2007,100(11):1579-1588.
16 Paravicini TM,Touyz RM.Redox signaling in hypertension[J].Cardiovasc Res,2006,247(71):e58.
17 Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].Int J Biochem Cell Biol,2007,39(1):44-84.
18 Ansley DM,Wang BH.Oxidative stress and myocardial injury in the diabetic heart[J].Journal of Pathology,2013,229(2):232-241.
19 Vrillts CJ.Pathophvsiology of the no-reflow phenomenon[J].Acute Cald Care,2009,11(2):69-76.
20 Widgerow AD.Ischemia-Reperfusion injury influencing the microcirculatory and cellular environment[J].Ann Plast Surg,2014,72(2):253-260.
21 Musicki B,Zhang YX,Chen HL,et al.Mechanism of testosterone deficiency in the transgenic sickle cell mouse[J].PLoS One,2015,10(5):e0128694.
22 Chen J,Zhang J,Xu L,et al.Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor[J].Atherosclerosis,2012,224(2):332-339.
The effect of microRNA-17 expression on oxidative stress in endothelial cells
YANGShuo,CHENJing,HUQi,JIANGHong.DepartmentofCardiology,RenminHospital,WuhanUniversity,HubeiProvince,Wuhan430060,China
Correspondingauthor:JIANGHong,E-mail:phyhongj@163.com
Objective To investigate the effect of microRNA-17 (miR-17) expression on endothelial cell oxidative stress.Methods Cultured original generation umbilical vein endothelial cells (HUVEC), they were transfected to negative control virus [Ad(N) group], up-regulation of miR-17 adenovirus (Ad-Pre-miR-17) and down-regulation of miR-17 adenovirus (Ad-Antagomir-17 group), the release of endogenous nitric oxide (NO) is detected by the silver nitrate method, the content of NO in DAF FM probe for the detection of cell, and used DHE probe for the detection of cell super oxide (ROS) content and analyzed.Results Compared to Ad (N) group, the content of NO in Ad-Antagomir-17 cell group increased (P<0.05), intracellular ROS content decreased (P<0.05); and reduce the content of NO in Ad-pre-miR-17 cells (P<0.05), intracellular ROS increased (P<0.05). Conclusion Reduce miR-17 can improve blood supply in patients with coronary heart disease, reduce oxidative stress and help to improve vascular function.
MicroRNA-17; Endothelial cells; Nitric oxide ; Oxidative stress
國家自然科學基金資助項目(No.81170195;81200156)
430060 武漢大學人民醫院心血管內科
江洪,E-mail:phy-hongj@163.com
10.3969 / j.issn.1671-6450.2015.11.023
2015-04-23)

