短期頸動脈壓力感受器電刺激對犬心肌缺血再灌注損傷的影響
陽 康,廖 凱,薩仁高娃,黃 兵,江 洪
(武漢大學人民醫院心內科,湖北 武漢 430060)
·論 著·
短期頸動脈壓力感受器電刺激對犬心肌缺血再灌注損傷的影響
陽 康,廖 凱,薩仁高娃,黃 兵,江 洪
(武漢大學人民醫院心內科,湖北 武漢 430060)
目的 評價短期頸動脈壓力感受器電刺激(Carotid baroreceptors stimulation,CBS)對犬心肌缺血再灌注損傷的影響。方法36只成年雜種犬隨機分為三組(n=12):假手術組(Sham組),缺血再灌注組(I/R組)和頸動脈壓力感受器刺激組(CBS組)。I/R組和CBS組分別結扎左冠脈前降支1 h和再灌注6 h完成心肌缺血再灌注損傷模型,Sham組只穿線不結扎冠脈。CBS組在心肌缺血前2 h對右側頸動脈竇開始進行高頻電刺激,一直持續到實驗結束,刺激參數:頻率50 Hz,脈寬0.5 ms,刺激強度隨血壓進行調整,以保持血壓較刺激前下降10%。于缺血前(基礎狀態)、缺血15 min、30 min、60 min和再灌注0.5 h、2 h、6 h時記錄心率(HR)和平均動脈壓(MAP)。各組隨機抽取6只犬于于再灌注6 h后采用依文斯蘭-氯化三苯基氮唑(TTC)雙染色法檢測心肌缺血和心肌梗死面積。各組剩余6只犬于再灌注6 h分別經頸內靜脈采血,采用ELISA法檢測血清TNF-α、IL-1β、IL-6。采血后,迅速取出缺血區心肌組織,檢測髓過氧化物酶(MPO)活性觀察中性粒細胞浸潤情況。結果與Sham組比較,I/R組和CBS組心肌梗死面積,MPO活性,血清TNF-α、IL-1β、IL-6含量升高(P<0.05);與I/R組比較,CBS組心肌梗死面積,MPO活性,血清TNF-α、IL-1β、IL-6含量降低(P<0.05)。結論短期頸動脈壓力感受器電刺激可減輕犬心肌缺血再灌注損傷,其機制與抑制中心粒細胞向缺血組織浸潤以及抑制炎癥反應有關。
頸動脈壓力感受器電刺激;心肌缺血再灌注損傷;炎癥反應
在發達國家,心肌梗死是引起死亡的主要原因[1]。再灌注治療是應對急性心肌梗死的最佳方法,但是挽救缺血心肌的同時也會導致再灌注損傷[2]。炎癥反應在心肌缺血再灌注(I/R)損傷的發生和發展過程中發揮著極為重要的作用。在心肌缺血時炎癥介質對損傷組織的愈合必不可少,但是當缺血部位再灌注后,過度的炎癥反應反而會加重心肌損傷[3]。現已證明,迷走神經刺激能夠減小心肌I/R損傷,其機制與激活迷走神經后通過膽堿能抗炎通路(CAP)抑制炎癥反應有關[4-5]。
動脈壓力感受性反射(ABR)是心血管活動最重要的調節機制。既往的研究表明長期頸動脈壓力感受器電刺激(CBS)治療頑固性性高血壓安全可行[6-9]。在犬心衰模型中,長期CBS可改善心功能,逆轉心肌重塑,并與上調心臟β受體活性和NO合酶有關,提示長期CBS可能具有抗炎的作用[10-11]。因此,我們提出一個假設,短期CBS可能在心肌缺血再灌注損傷時同樣具有保護心肌的作用,其機制可能與CBS抑制炎癥反應有關。
1 材料與方法
1.1 實驗動物及模型的建立 健康成年雜種犬36只,體重14~22 kg,均為雄性,由武漢大學人民醫院動物中心提供。戊巴比妥鈉30 mg/kg前肢靜脈麻醉,以后每小時追加2 mg/kg維持麻醉狀態。氣管插管接動物呼吸機,分離一側股、動靜脈置入6F鞘管,動脈通道連接壓力換能器監測血壓,靜脈通道用于滴注生理鹽水補液。頸部脫毛備皮消毒后,在左側鎖骨上水平暴露左側頸內靜脈備采血標本。空調室溫控制在25℃~30℃,整個實驗過程中,犬下方放置電熱板以維持犬正常體溫。持續記錄體表心電圖(LEAD2000)。右頸動脈竇位于右頸總動脈和頸內動脈分叉處的膨大組織。在右側下頜骨下方暴露左頸動脈竇,用一小片封口膜隔離周圍組織。將一個特制的銀-氯化銀刺激電極圍繞頸動脈竇植入,并連接到脈沖發生器(SEN-7103,日本光電,日本東京)。在3~5 min內預先刺激3~4次確認血壓和心率明顯下降,然后再妥善安置電極。頸動脈竇的刺激參數為:頻率50 Hz,脈寬0.5 ms,刺激強度為引起血壓下降10%的電壓強度(3~7 V)[11]。然后經左側第4肋間開胸,剪開心包,暴露心臟。于冠狀動脈左前降支第對角支、第二對角支之間穿針引線(2-0#無創絲線),連同一小段硬質圓鈍頭的塑料管一起結扎,造成缺血,及時記錄心電圖的改變。結扎成功的標準:心肌缺血區局部發紺,同步Ⅱ導聯ECG顯示ST段明顯抬高,缺血期間出現室性心律失常。結扎1 h后,在硬質塑料管上切斷結扎線,恢復冠脈血流再灌注6 h。再灌注成功的標準:缺血區局部顏色變紅,同步Ⅱ導聯ECG顯示ST段逐漸恢復到缺血前水平,并出現再灌注室性心律失常[12]。
1.2 實驗分組及干預 36只犬隨機分為3組(每組12只):(1)Sham組:分離右頸動脈竇,植入電極,不開啟頸動脈竇刺激儀;開胸,分離左冠狀動脈并穿線,但不結扎。(2)I/R組:分離右頸動脈竇,植入電極,不開啟頸動脈竇刺激儀;結扎左冠脈前降支1 h,再灌注6 h。(3)CBS組:分離右頸動脈竇,植入電極,結扎冠脈前先預刺激頸動脈竇2 h,直至再灌注6 h;缺血1 h,再灌注6 h。
1.3 血流動力學監測 在實驗全程中,采用LEDE2000多導電生理儀連續監測犬的心率(HR)、動脈收縮壓,舒張壓、平均動脈壓(MAP)和Ⅱ導聯心電圖。記錄心肌缺血前的HR和MAP,將該數值作為基礎值。然后記錄缺血15 min、30 min、60 min和再灌注0.5 h、2 h、6 h時的HR和MAP。
1.4 心肌梗死面積的測定 各組隨機抽取6只犬,于再灌注6 h后處死動物,立即取下心臟,用生理鹽水沖洗干凈。采用依文斯蘭-TTC雙染色法測定心肌梗死面積。正常非缺血區染為藍色,梗死區(AN)呈灰白色,缺血非梗死區呈磚紅色,缺血心肌面積(AAR)為灰白色和磚紅色之和。對獲得的數碼相片采用Photoshop CS3 Extended軟件(Adobe公司,美國)進行測量處理,分別計算各部分的面積。缺血范圍用AAR與左室面積之比表示,梗死范圍以AN與AAR之比表示。
1.5 血清炎癥因子和心肌MPO活性的檢測 各組剩下的6只犬,于再灌注6 h經頸內靜脈采血,采用ELISA法檢測血清TNF-α、IL-1β、IL-6的濃度。具體操作步驟完全按照試劑盒說明書進行。采血結束后處死動物,迅速缺血區心肌組織,并用生理鹽水沖洗干凈。采用分光光度法測定髓過氧化物酶(MPO)活性,試劑盒均由武漢博士德生物工程有限公司提供。
1.6 統計學方法 所有計量資料首先采用進行正態分布檢驗,符合正態分布的計量資料采用均數±標準差(±s)表示。應用SPASS17.0統計軟件對實驗數據進行分析。多組間比較采用單因素方差分析,組間兩兩比較應用q檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 各組犬血流動力學檢測結果比較 各組犬的HR、MAP比較差異均無統計學意義(P>0.05),見表1。
2.2 各組犬心肌梗死面積檢測結果比較 Sham組未觀察到心肌梗死,CBS組心肌梗死面積和缺血面積明顯低于I/R組,差異有統計學意義(P<0.05),見表2。
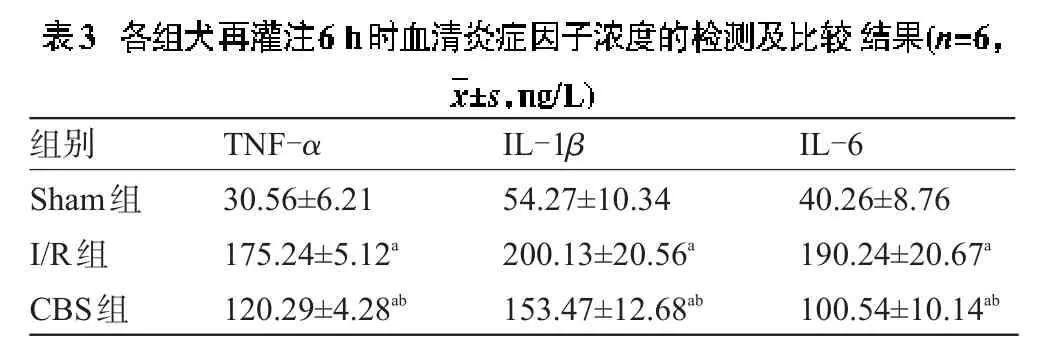
2.3 各組犬再灌注6 h時血清炎癥因子濃度的檢測結果比較 I/R組和CBS組心肌再灌注6 h時血清TNF-α、IL-1β和IL-6均明顯高于Sham組,CBS組心肌再灌注6 h時血清TNF-α、IL-1α和IL-6濃度均明顯低于I/R組,差異均有統計學意義(P<0.05),見表3。
表1 各組犬缺血期和再灌注期血流動力學指標(±s)
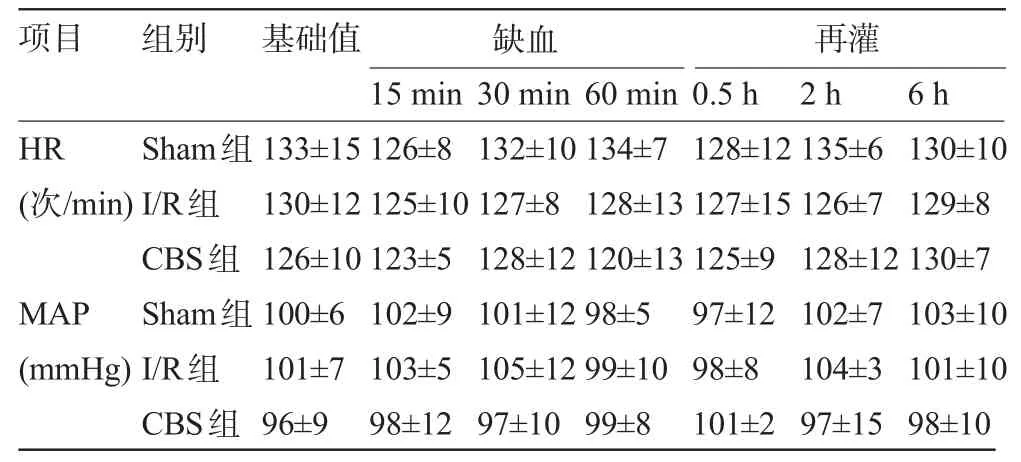
表1 各組犬缺血期和再灌注期血流動力學指標(±s)
注:1 mmHg=0.133 kPa。
130±10 129±8 130±7 103±10 101±10 98±10 HR (次/min) MAP (mmHg) Sham組I/R組CBS組Sham組I/R組CBS組133±15 130±12 126±10 100±6 101±7 96±9 126±8 125±10 123±5 102±9 103±5 98±12 132±10 127±8 128±12 101±12 105±12 97±10 134±7 128±13 120±13 98±5 99±10 99±8 128±12 127±15 125±9 97±12 98±8 101±2 135±6 126±7 128±12 102±7 104±3 97±15
表2 各組犬心肌梗死面積的檢測及比較結果(n=6,±s,%)

表2 各組犬心肌梗死面積的檢測及比較結果(n=6,±s,%)
注:與Sham組比較,aP<0.05;與I/R組比較,bP<0.05。
I/R組CBS組0±0 25.6±3.2a15.4±3.6ab0±0 32.4±5.1a20.5±3.2ab
注:與Sham組比較,aP<0.05;與I/R組比較,bP<0.05。
2.4 各組犬心肌缺血區中性粒細胞浸潤情況比較 Sham組未進行心肌缺血,因此未見中性粒細胞浸潤。I/R組可觀察到大量密集的中性粒細胞浸潤到心肌缺血區。CBS組心肌缺血區可見中性粒細胞的浸潤程度顯著下降。Sham組、I/R組、CBS組犬心肌缺血區MPO活性分別為(2.27±0.58)U/g,(20.14±3.27)U/g,(13.62±4.17)U/g。與Sham組比較,I/R組、CBS組MPO活性均顯著增高(P<0.05)。CBS組的MPO活性顯著低于I/R組(P<0.05)。
3 討論
既往研究證實長期CBS能有效治療頑固性性高血壓和心力衰竭[6-11],但還沒有研究報道短期CBS是否能夠減低心肌I/R損傷。本研究結果表明短期CBS能明顯減低心肌I/R損傷,表現為CBS降低心肌梗死面積。其次,短期CBS可以抑制心肌缺血區中性粒細胞的浸潤,抑制全身炎癥因子的表達,從而減輕缺血再灌注引起的組織損傷。
缺血再灌注時過度的炎癥反應是導致心肌I/R損傷主要的致病機制之一[13]。再灌注后形成的大量活性氧自由基(ROS)和補體激活可以直接觸發炎癥反應,誘發心肌組織內大量炎癥細胞浸潤和炎癥因子表達,進而導致心肌損傷[14-15]。在再灌注的早期階段,大量募集至缺血區心肌組織的中性粒細胞可釋放蛋白水解酶,氧化劑,表達炎癥細胞因子,粘附分子和趨化因子等致病物質,最終導致心肌I/R損傷的形成[16]。既往研究也證實,通過抑制缺血區心肌組織內中性粒細胞聚集與浸潤,降低MPO活性,能夠減輕I/ R損傷所引起心肌細胞凋亡,減輕心肌梗死面積和改善再灌注后心功能[17]。中性粒細胞的活化和浸潤是介導炎癥反應的關鍵環節[18],我們的研究發現,在缺血再灌注6 h后心肌缺血區可見大量中性粒細胞浸潤,MPO活性顯著升高,說明中性粒細胞在炎癥反應介導的心肌細胞損傷中發揮了重要作用。
再灌注早期階段,可在犬心肌梗死區及周圍發現大量由炎癥細胞釋放的細胞因子[19-20](TNF-α、IL-1β、IL-6等),細胞粘附分子[21](ICAM-1等)和趨化因子[22](IL-8等)及其他炎癥介質。TNF-α、IL-1α可以結合至細胞表面受體并觸發細胞內信號級聯反應,激活NF-кB進一步誘導大量促炎因子的釋放,包括TNF-α、IL-1β、IL-6等,從而引發“炎癥瀑布”,促進細胞凋亡,加重心肌損傷[23]。
頸動脈壓力感受器是ARB的感受裝置。當動脈血壓升高時,通過頸動脈壓力感受器和ARB傳入神經,中樞神經系統可感受刺激信號,隨后減少ABR傳出神經神經沖動,導致血壓和交感神經活性降低。電刺激頸動脈壓力感受器可以明顯降低血壓正是基于這一機理。近年來,利用新一代頸動脈壓力感受器刺激儀Rheos,展開了一系列的動物實驗和臨床研究。研究表明,慢性CBS可以明顯抑制血管、心臟、腎臟的交感神經活性,同時提高迷走神經活性,從而起到長期降低血壓的作用[24]。Sabbah等[11]的研究提示CBS具有局部抗炎的作用并能改善心力衰竭衰犬的心功能。而本研究利用犬缺血再灌注模型證實了CBS能通過抑制急性炎癥反應及細胞凋亡,減輕心肌I/R損傷,從而發揮心肌細胞保護作用。我們推測,CBS能夠調控炎癥反應的機制可能是激活迷走神經后通過膽堿能抗炎通路(CAP)抑制炎癥反應[4-5],或是通過激活下丘腦-垂體-腎上腺(HPA)軸抗炎[25],或是兩者之間的協同作用。這有待于我們進一步研究明確。
本研究的不足之處在于我們并不清楚電刺激左側頸動脈壓力感受器是否具有同樣的效果。由于我們觀察到電刺激右側頸動脈竇對血壓和心率的影響更加明顯,且為了在一個給定的水平調整刺激強度,所以我們只選擇了電刺激右側頸動脈壓力感受器。其次,我們并沒有設置將心率固定的對照組用以研究CBS的心肌保護。既往研究表明,降低心率能夠降低心肌氧耗量、增加心臟舒張灌注時間和增加側枝冠脈血流分布,從而減輕心肌I/R損傷[26-27]。本研究中CBS對心肌的保護作用是否含有心率降低的效應?由于心率降低的幅度小于10%,因此我們推測心率減慢可能并不是主要機制。
綜上所述,CBS同迷走神經刺激一樣,具有明顯調節炎癥反應,維持機體穩態的功能。與應用藥物抑制單純某個炎癥介質或細胞相比,CBS發揮機體生理功能的調節,具有快速、直接、局限、整合地調節炎癥反應的特點。我們的研究結果加深了對CBS調節心血管疾病發揮的潛在作用及其機制的認識,同時為治療缺血再灌注提供一個新策略,為臨床治療提供了試驗依據和全新的研究思路。
[1]Roger VL,Go AS,Lloyd-Jones DM,et al.Executive summary:heart disease and stroke statistics—2012 update a report from the American HeartAssociation[J].Circulation,2012,125(1):188-197.
[2]Yellon DM,Hausenloy DJ.Myocardial reperfusion injury[J].New England Journal of Medicine,2007,357(11):1121-1135.
[3]Entman ML,Smith CW.Postreperfusion inflammation:a model for reaction to injury in cardiovascular disease[J].Cardiovascular research,1994,28(9):1301-1311.
[4]Steffens S,Montecucco F,Mach F.The inflammatory response as a target to reduce myocardial ischaemia and reperfusion injury[J]. Thromb Haemost,2009,102(2):240-247.
[5]Ottani A,Giuliani D,Galantucci M,et al.Melanocortins counteract inflammatory and apoptotic responses to prolonged myocardial ischemia/reperfusion through a vagus nerve-mediated mechanism[J]. European Journal of Pharmacology,2010,637(1):124-130.
[6]Wustmann K,Kucera JP,Scheffers I,et al.Effects of chronic baroreceptor stimulation on the autonomic cardiovascular regulation in patients with drug-resistant arterial hypertension[J].Hypertension, 2009,54(3):530-536.
[7]Heusser K,Tank J,Engeli S,et al.Carotid baroreceptor stimulation, sympathetic activity,baroreflex function,and blood pressure in hypertensive patients[J].Hypertension,2010,55(3):619-626.
[8]Scheffers IJM,Kroon AA,Schmidli J,et al.Novel baroreflex activation therapy in resistant hypertension results of a European multi-center feasibility study[J].Journal of the American College of Cardiology,2010,56(15):1254-1258.
[9]Bisognano JD,Bakris G,Nadim MK,et al.Baroreflex activation therapy lowers blood pressure in patients with resistant hypertensionresults from the double-blind,randomized,placebo-controlled rheos pivotal trial[J].Journal of the American College of Cardiology,2011,58(7):765-773.
[10]Zucker IH,Hackley JF,Cornish KG,et al.Chronic baroreceptor activation enhances survival in dogs with pacing-induced heart failure [J].Hypertension,2007,50(5):904-910.
[11]Sabbah HN,Gupta RC,Imai M,et al.Chronic electrical stimulation of the carotid sinus baroreflex improves left ventricular function and promotes reversal of ventricular remodeling in dogs with advanced heart failure[J].Circulation:Heart Failure,2011,4(1):65-70.
[12]Schulze CJ,Wang W,Suarez-Pinzon WL,et al.Imbalance between tissue inhibitor of metalloproteinase-4 and matrix metalloproteinases during acute myoctardial ischemia-reperfusion injury[J].Circulation,2003,107(19):2487-2492.
[13]Hausenloy DJ,Yellon DM.Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J].The Journal of Clinical Investigation,2013,123(1):92-100.
[14]Zweier JL,Talukder MAH.The role of oxidants and free radicals in reperfusion injury [J].Cardiovascular Research,2006,70(2): 181-190.
[15]Hill JH,Ward PA.The phlogistic role of C3 leukotactic fragment in myocardial infarcts of rats[J].J Exp Med,1971,133(4):885-890.
[16]Vinten-Johansen J.Involvement of neutrophils in the pathogenesis of lethal myocardial reperfusion injury[J].Cardiovascular Research,2004,61(3):481-497.
[17]Zhang Y,Sun Q,He B,et al.Anti-inflammatory effect of hydrogen-rich saline in a rat model of regional myocardial ischemia and reperfusion[J].International Journal of Cardiology,2011,148(1): 91-95.
[18]Jordan JE,Zhao ZQ,Vinten-Johansen J.The role of neutrophils in myocardial ischemia-reperfusion injury[J].Cardiovascular Research,1999,43(4):860-878.
[19]Frangogiannis NG,Lindsey ML,Michael LH,et al.Resident cardiac mast cells degranulate and release preformed TNF-α,initiating the cytokine cascade in experimental canine myocardial ischemia/reperfusion[J].Circulation,1998,98(7):699-710.
[20]Gwechenberger M,Mendoza LH,Youker KA,et al.Cardiac myocytes produce interleukin-6 in culture and in viable border zone of reperfused infarctions[J].Circulation,1999,99(4):546-551.
[21]Youker KA,Hawkins HK,Kukielka GL,et al.Molecular evidence for induction of intracellular adhesion molecule-1 in the viable border zone associated with ischemia-reperfusion injury of the dog heart[J].Circulation,1994,89(6):2736-2746.
[22]Frangogiannis NG,Mendoza LH,Lindsey ML,et al.IL-10 is induced in the reperfused myocardium and may modulate the reaction to injury[J].The Journal of Immunology,2000,165(5):2798-2808.
[23]Kleinbongard P,Schulz R,Heusch G.TNFα in myocardial ischemia/ reperfusion,remodeling and heart failure[J].Heart Failure Reviews,2011,16(1):49-69.
[24]Lohmeier TE,Iliescu R.Chronic lowering of blood pressure by carotid baroreflex activation mechanisms and potential for hypertension therapy[J].Hypertension,2011,57(5):880-886.
[25]De Herdt V,Puimège L,De Waele J,et al.Increased rat serum corticosterone suggests immunomodulation by stimulation of the vagal nerve[J].Journal of Neuroimmunology,2009,212(1):102-105.
[26]Maroko PR,Kjekshus JK,Sobel BE,et al.Factors influencing infarct size following experimental coronary artery occlusions[J].Circulation,1971,43(1):67-82.
[27]Redwood DR,Smith ER,Epstein SE.Coronary artery occlusion in the conscious dog effects of alterations in heart rate and arterial pressure on the degree of myocardial Ischemia[J].Circulation, 1972,46(2):323-332.
Effect of short-term carotid baroreceptors stimulation on myocardial ischemia reperfusion injury in dogs.
YANG Kang,LIAO Kai,SA Ren-gao-wa,HUANG Bing,JIANG Hong.
Department of Cardiology,People's Hospitial of Wuhan University,Wuhan 430060,Hubei,CHINA
ObjectiveTo evaluate the effect of short-term carotid baroreceptors stimulation(CBS)on myocardial ischemia reperfusion injury(IRI).MethodsThirty-six adult dogs were randomly divided into three groups (n=12):Sham group,ischemia reperfusion group(I/R group)and carotid baroreceptors stimulation group(CBS group). Dogs in I/R group and CBS group were given respectively 1 h left anterior descending coronary artery(LAD)ligation and 6 h reperfusion to complete IRI models,while dogs in Sham group received only threading.In CBS group,high frequency stimulations were performed on the right carotid sinus from 2 h before myocardial ischemia to the end of experiment(stimulation parameters:frequency 50 Hz,pulse width:0.5 ms,stimulation intensity adjusted according to blood pressure so as to keep the blood pressure down 10%before stimulation).Heart rate(HR)and mean arterial pressure(MAP)were recorded before ischemia,15 min,30 min and 60 min after ischemia,and 0.5 h,2 h and 6 h after reperfusion.Six dogs from each group were randomly selected to test the area of myocardial ischemia and myocardial infarction by Evans blue-triphenyl tetrazolium chloride(TTC)double-staining method at 6h after reperfusion.Internal jugular vein blood of the rest 6 dogs from each group were collected at 6 h after reperfusion,and serum TNF-α,IL-1β and IL-6 were tested by ELISA.After blood collection,we quickly took out the ischemic myocardial tissues to detect the infiltration of neutrophil cells through myeloperoxidase(MPO)activity observation.ResultsCompared with Sham group,the infarction area,MPO activity,serum levels of TNF-α,IL1-β and IL-6 of I/R group and CBS group were increased(P<0.05);compared with IR group,all the above indexes of CBS group were lower(P<0.05).ConclusionCarotid baroreceptors stimulation can reduce myocardial ischemia reperfusion injury.And the mechanism may be associated with the suppression of neutrophil infiltration and inflammatory reaction.
Carotidbaroreceptorsstimulation;Myocardialischemiareperfusioninjury;Inflammatoryreaction
R-332
A
1003—6350(2015)02—0157—04
10.3969/j.issn.1003-6350.2015.02.0056
2014-10-07)
國家自然科學基金(編號:81270339;81170195;81300812)、湖北省自然科學基金(編號:2013CFB302)、武漢市科技攻關項目(編號:2013060602010271)、武漢大學青年教師自主科研項目(編號:2042012121087)、武漢大學2012年博士研究生自主科研項目(編號:2012302020206)
江 洪。E-mail:jianghong58@gmail.com

