遮陰對樟葉槭容器苗生長和生理特性的影響
錢萍仙, 李學孚,2, 吳月燕, 饒慧云, 劉 蓉, 李美芹,2, 付 濤
(1.浙江萬里學院生物與環境學院,浙江 寧波315100;2.上海海洋大學水產與生命學院,上海201306;3.寧波城市職業技術學院,浙江 寧波315502)
樟葉槭(Acer cinnamomifolium Hayata)為槭樹科(Aceraceae)槭屬(Acer. L)樹種,為常綠樹種,葉密集,樹蔭濃密,是優良的庭園樹和行道樹種。樟葉槭耐半蔭,喜溫暖濕潤氣候,不耐寒,主要分布于長江以南。樟葉槭繁殖方式主要為種子或扦插繁殖,但成苗率較低、質量較差,直接影響園林景觀效果和生態效益,也難以滿足定向、優質和標準化培育需要,而容器育苗對提高樟葉槭成活率和標準化育苗起到極為重要的作用。在中國南方,夏季強光是影響容器育苗生長發育的關鍵因素,對苗木的生長、光合作用、蒸騰作用、呼吸作用、物資運輸與合成等均會產生深刻影響,適當的遮陰有利于苗木的生長發育[1]。目前關于樟葉槭容器育苗報道較少,尤其對樟葉槭容器苗光的適應性缺乏系統研究。本試驗通過研究樟葉槭容器苗在不同遮陰條件下生長及生理的變化,探討適合樟葉槭容器苗生長的遮陰條件,以期為其科學栽培管理提供理論依據。
1 材料與方法
1.1 試驗材料
以2 年生樟葉槭幼苗為試驗材料,材料來自浙江萬里學院葡萄大棚栽培試驗地,試驗時間為2014年5 月~2014 年8 月。
1.2 試驗設計
2014 年5 月2 日,選擇200 株2 年生樟葉槭幼苗,栽于無紡布網袋容器(直徑為15 cm×15 cm,高度20 cm)。采用泥炭:珍珠巖(7∶ 3)為基質,每盆裝基質460 g,可控性緩釋肥(N∶ P2O5∶ K2O=18∶18∶ 8)施肥量2 kg/m3,基質有機質42 g/kg,堿解氮125 mg/kg,速效磷94 mg/kg,速效鉀213 mg/kg,pH 6.5。待幼苗長至40 cm,選擇160 株生長狀況良好的樟葉槭植株,2014 年5 月15 日進行遮陰處理,共設3 個處理:處理Ⅰ為1 層膜遮陰,遮陰率約30%;處理II 為2 層膜遮陰,遮陰率約55%;處理III 為3層膜遮陰,遮陰率約75%;以無遮蓋作為對照(CK)。每個處理40 株,在第0 d、30 d、60 d、90 d 進行光合作用參數以及各種生理生化指標的測定,第90 d 進行形態特征的觀測。采樣時各處理隨機選取10 株植株,于每株植株莖的中上部采集葉片,清潔干凈,立即置于-80 ℃冰箱,用于各種生理生化指標的測定。
1.3 測定方法
采用LA-S 全能型植物圖像分析儀系統統計株高、葉片數、單株葉面積、根系總長、根直徑和須根數,再將根系剪下稱質量,每個處理隨機選取6 株,重復5 次。
葉綠素含量的測定采用丙酮提取分光光度法[2]。丙二醛含量的測定采用硫代巴比妥酸法[3]。還原型谷胱甘肽的測定采用間接分光光度法[3]。過氧化氫酶活性的測定采用高錳酸鉀滴定法[2],過氧化物酶活性的測定采用愈創木酚比色法[4],超氧化物歧化酶的測定采用氮藍四唑法[3]。
采用GFS-3000 光合測定儀于12∶ 00 -14∶ 00在充足陽光下隨機測定植株中部功能葉片的光合速率(Pn)、蒸騰速率(Tr)、胞間CO2濃度(Ci)和氣孔導度(Gs)。測定條件為:葉片溫度24 ℃,相對濕度(RH)70% ~80%,光合有效輻射(PAR)900 μmol/(m2·s),photons。測定時,每個處理隨機選取6 片,重復3 次。
2 結果與分析
2.1 遮陰處理對樟葉槭容器苗形態特征的影響
如表1 所示,在弱光脅迫下,樟葉槭容器苗形態特征發生了顯著變化。與無遮陰對照相比,處理Ⅰ生長狀況良好,株高、葉片數、單株葉面積、根系質量、根直徑、根系總長和須根數均顯著增加(P <0.05);處理Ⅱ和處理Ⅲ株高、葉片數、單株葉面積、根系質量、根直徑、根系總長以及須根數均顯著下降(P <0.05),試驗結果表明,適當的遮陰有利于樟葉槭容器苗的生長,而隨著弱光脅迫強度的增強,樟葉槭容器苗生長顯著受到影響。
2.2 遮陰處理對樟葉槭容器苗葉片光合作用參數的影響
2.2.1 遮陰處理對樟葉槭容器苗葉片葉綠素含量的影響 如圖1 所示,不同遮陰處理對樟葉槭容器苗葉綠素總量、葉綠素a(Chl.a)、葉綠素b(Chl.b)和葉綠素a/b(Chl.a/Chl.b)有顯著影響。處理Ⅰ葉片葉綠素總量、Chl. a、Chl. a/Chl. b 均顯著高于對照(P <0.05),Chl.b 與對照差異不顯著(P >0.05);處理Ⅱ、處理Ⅲ葉片葉綠素總量、Chl.a、Chl.b、Chl.a/Chl.b均顯著低于對照(P <0.05)。表明,夏季適當的遮陰有利于葉綠素的合成,促進葉片的光合作用,而光照強度過低不利于葉片的光合作用。
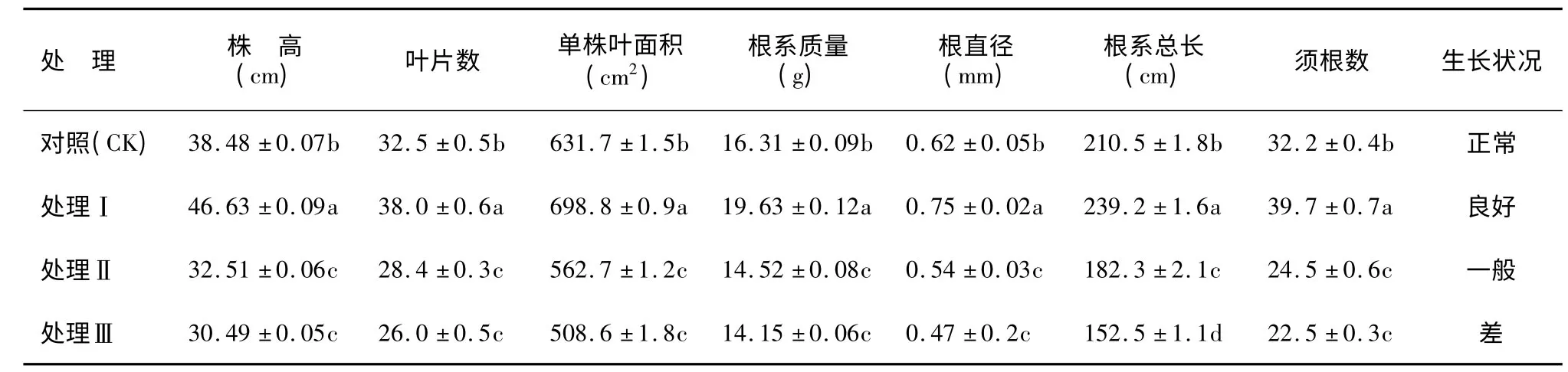
表1 遮陰處理對樟葉槭容器苗形態特征的影響Table 1 Effects of shading on the morphological characteristics of container seedlings
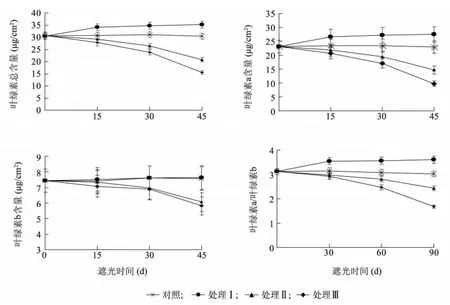
圖1 遮陰處理對樟葉槭容器苗葉片中葉綠素含量的影響Fig.1 Effects of shading on the chlorophyll contents in container seedling leaves
2.2.2 遮陰處理對樟葉槭容器苗氣體交換參數的影響 如圖2 所示,不同遮陰處理對樟葉槭容器苗葉片氣體交換參數有顯著的影響。處理Ⅰ葉片凈光合速率(Pn)、蒸騰速率(Tr)和氣孔導度(Gs)均顯著高于對照(P <0.05);處理Ⅱ、處理Ⅲ葉片Pn、Tr、Gs均顯著低于對照(P <0.05)。處理Ⅰ葉片胞間CO2濃度(Ci)顯著高于對照(P <0.05);處理Ⅱ、處理Ⅲ葉片Ci均先下降后升高。結果表明,夏季適當的遮陰會促進樟葉槭容器苗葉片光合作用,而光照強度過低會抑制葉片光合作用。
2.3 遮陰處理對樟葉槭容器苗丙二醛含量及保護酶活性的影響
2.3.1 遮陰處理對樟葉槭容器苗葉片丙二醛含量的影響 葉片中丙二醛(MDA)含量的高低是細胞膜系統結構是否遭受破壞的重要指標之一。圖3 顯示,不同遮陰處理對樟葉槭容器苗丙二醛含量有顯著的影響。處理I 葉片MDA 含量顯著低于對照(P <0. 05);處理Ⅱ和處理Ⅲ葉片MDA含量均顯著高于對照(P <0. 05)。表明光照強度過低會加快樟葉槭容器苗生物膜的損害。
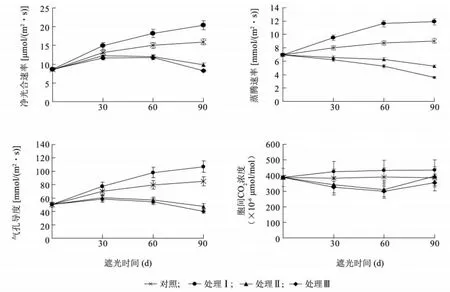
圖2 遮陰處理對樟葉槭容器苗葉片氣孔交換參數的影響Fig.2 Effects of shading on stomatal exchange parameters in container seedling leaves
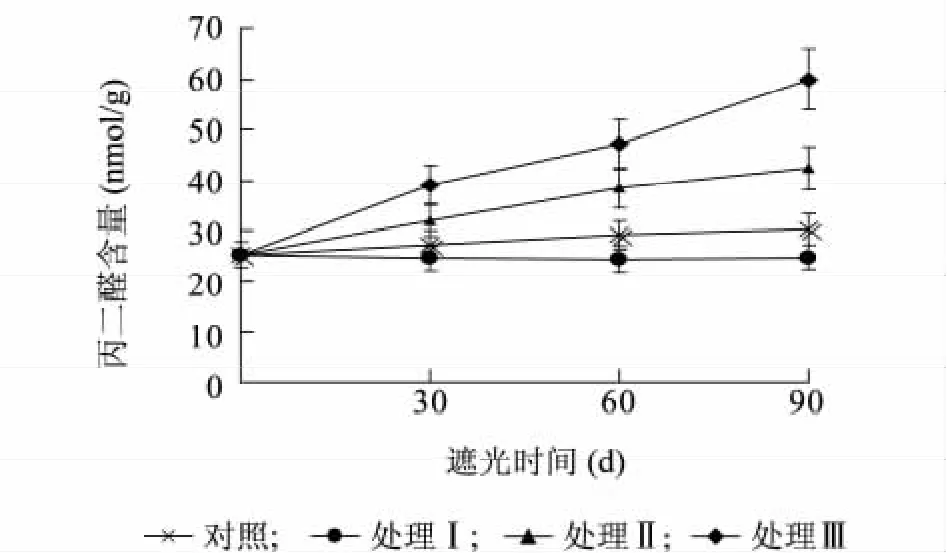
圖3 遮陰處理對樟葉槭容器苗葉片丙二醛含量的影響Fig.3 Effects of shading on the MDA content in container seedling leaves
2.3.2 遮陰處理對樟葉槭容器苗葉片保護酶活性的影響 圖4 顯示,弱光脅迫下,處理I 葉片還原性谷胱甘肽酶(GSH)、過氧化物酶(POD)、過氧化氫酶(CAT)、超氧化物歧化酶(SOD)均顯著高于對照(P <0.05);處理Ⅱ、處理Ⅲ葉片GSH、POD、CAT、SOD 均顯著低于對照(P <0.05)。表明夏季適當的遮陰有利于保護酶的合成與積累,而隨著脅迫強度的增加,保護酶活性會遭到破壞。
3 討論
根系作為植物吸收水分和營養并進行物質轉化和儲藏的重要器官,其發育情況直接影響地上部的形態建成,良好的根系發育對地上部的生長具有重要意義[5-9]。在本研究中,1 層遮陰處理的樟葉槭容器苗根系生長良好,2 層和3 層遮陰處理的根系生長受到影響。表明夏季適當的遮陰有利于樟葉槭容器苗根系生長,而光照度過低會抑制其根系生長。
葉片是進行光合作用和呼吸作用等生理代謝活動的重要器官,對光照度變化最敏感[10]。吳月燕等[1]對木荷等樹種葉片特征研究結果表明,30%遮陰條件可有效促進葉片的生長,使葉片整體的生長發育最好,且生產力指數最大。在本研究中,1 層遮陰處理促進樟葉槭容器苗葉片生長,2 層和3 層遮陰處理抑制葉片生長。
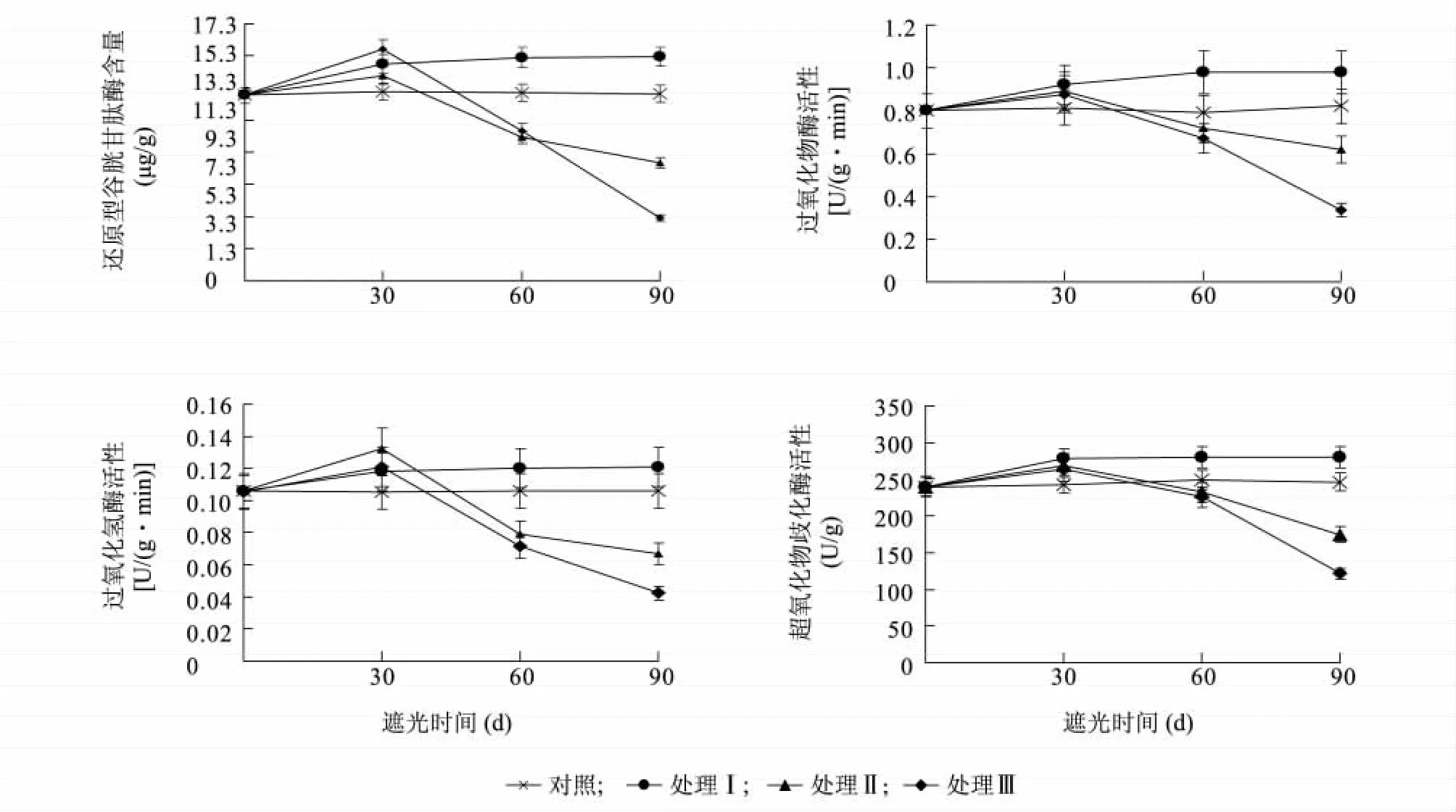
圖4 遮陰處理對樟葉槭容器苗葉片保護酶的影響Fig.4 Effects of shading on the protective enzyme activities in container seedling leaves
光合作用是植物生長和產量形成的重要基礎,而葉綠素是植物進行光合作用的主要色素,其合成和降解處于動態平衡,其含量的大小可以表明植物在弱光脅迫下光合作用的強弱[11-12]。葉綠素a 的功能主要是將匯聚的光能轉變為化學能進行光化學反應,而葉綠素b 則主要是收集光能[13]。在本研究中,1 層遮陰處理葉綠素總量、Chl. a 均顯著升高,2層和3 層遮陰處理葉綠素總量、Chl.a、Chl.b 均顯著下降,可能是由于夏季光照度較高導致了葉綠素分解,而適當的遮陰有利于樟葉槭容器苗葉綠體基粒的形成,這與吳正鋒[14]等人對于花生的研究結果一致。不同光環境中,植物通常會通過改變這2 種光合色素的比例適應環境因子的變化,葉綠素a/b 是植物耐蔭性的重要指標之一[15]。在本研究中,1 層遮陰處理Chl.a/Chl.b顯著升高,而2 層和3 層遮陰處理Chl.a/Chl.b 顯著下降,可能是由于弱光脅迫下,Chl.a 比Chl.b 更敏感。
光合作用是植物最基本的生命活動,是植物合成有機質和獲取能量的根本來源,是對逆境脅迫響應最為敏感的生理過程之一,常常被用來快速鑒定植物的抗逆性[16-19]。凈光合速率是植株光合作用的重要指標之一,而凈光合速率的下降受氣孔限制和非氣孔限制兩個因素影響[20]。在本研究中,Gs和Tr的變化基本與Pn一致,表明弱光脅迫下氣孔限制是導致樟葉槭容器苗凈光合速率降低的主要原因之一,這與前人對于高粱的研究結果[21]基本一致。但弱光脅迫后期(脅迫后90 d 時)Ci有所升高,表明在脅迫后期,非氣孔限制占了主導因素,可能是由于隨著脅迫加重,葉肉細胞中葉綠體結構受到破壞[22]。
弱光脅迫后樟葉槭容器苗葉片的生理生化過程發生了一系列變化。丙二醛是生物膜系統脂質過氧化作用的主要產物之一,其含量的高低常被作為反映細胞膜脂過氧化作用強弱和質膜被破壞程度的一個重要指標[23]。在植物細胞遭受逆境脅迫時,細胞膜發生氧化分解,MDA 大量積累,其含量越高表明植物抗逆境能力越差[24]。在本研究中,1 層遮陰處理的葉片MDA 含量最低,而隨著遮陰強度的增加,MDA 含量顯著升高,可能是由于光照過強或過弱都會引起植物細胞膜透性增大,胞內電解質外滲,同時出現膜脂過氧化,進而導致MDA 含量升高,而夏季適當的遮陰可以避免光照過強對葉片細胞生物膜的損害。
植物體內存在著一套抗氧化系統,負責清除活性氧的產生,其清除能力是衡量植物抗逆性的關鍵指標之一[25-27]。過氧化物酶(POD)、過氧化氫酶(CAT)和超氧化物歧化酶(SOD)是植物體內清除活性氧自由基的3 種關鍵酶[28]。SOD 是植物抗氧化系統的第一道防線,它可以使Mehler 反應中產生的活性氧轉化成H2O2,然后通過CAT、POD 等將H2O2轉化為H2O 和O2,從而減少細胞膜的傷害[29]。普遍存在于植物體內的谷胱甘肽酶有利于維持組織的抗氧化特性,此外,在調節對氧化還原敏感的信號傳導中也起著關鍵性的作用。還原性谷胱甘肽酶(GSH)含量與植物對各種生物異源物質及非生物環境脅迫的忍耐密切相關,是胞內代謝過程和植物遭受氧化脅迫時產生的過氧化物的最有效的清潔劑之一[11]。在本研究中,1 層遮陰處理樟葉槭容器苗GSH、POD、CAT、SOD 活性均顯著升高,而2 層和3層遮陰處理樟葉槭容器苗GSH、POD、CAT、SOD 活性均先升高后快速下降,可能是由于夏季適當的遮陰提高了植物抗氧化能力,而光照度過低直接損害了植物抗氧化系統。
綜合以上研究結果發現,1 層遮陰條件下,樟葉槭容器苗根系和葉片生長都優于對照,過度遮陰使其生長受迫。因此,在中國南方地區,夏季可以對樟葉槭容器苗進行適當的遮陰以促進其生長。
[1] 吳月燕,項錫娜,王忠華,等. 光脅迫對容器幼苗生長和生理生化特性的影響[J]. 植物生理學報,2013,49 (5):469-476.
[2] 劉 萍,李明軍. 植物生理學實驗技術[M]. 北京:科學出版社,2007:39-42,125-130.
[3] 李 玲. 植物生理學實驗指導[M]. 北京:科學出版社,2009:80-82,100-102,98-99.
[4] 鄭柄松. 現代植物生理生化研究技術[M]. 北京:氣象出版社,2006:41-42.
[5] 孫三杰,李建明,宗建偉,等. 亞低溫與干旱脅迫對番茄幼苗根系形態及葉片結構的影響[J]. 應用生態學報,2012,23(11):3027-3032.
[6] 季 楊,張新全,彭 燕,等. 干旱脅迫對鴨茅幼苗根系生長及光合特性的影響[J]. 應用生態學報,2013,24(10):2763-2769.
[7] 喬俊卿,夏彥飛,劉郵洲,等.Bacillus subtilis PTS-394 對番茄根系及根圍微生態的影響[J]. 江蘇農業學報,2014,30(6):1304-1308.
[8] 崔世鋼,楊莉莉,吳興利,等.圖像分析法測量植物生長柜中的根系形態[J].江蘇農業科學,2014,42(10):383-385.
[9] 郭 瑾,薛永來,杜道林. 植物激素調控擬南芥根系發育的研究進展[J].江蘇農業科學,2014,42(5):7-10.
[10] 孫 璐,周宇飛,李豐先,等. 鹽脅迫對高粱幼苗光合作用和熒光特性的影響[J]. 中國農業科學,2012,45(16):3265-3272.
[11] 吳月燕,崔 鵬,李 波. 薄膜覆蓋對葡萄生長和生理特性的影響[J]. 果樹學報,2011,28(6):991-997.
[12] 富 軍,趙長星,閆萌萌,等. 栽培方式對夏直播花生葉片光合特性及產量的影響[J]. 應用生態學報,2013,24(3):747-752.
[13] 王建華,任士福,史寶勝,等. 遮蔭對連翹光合特性和葉綠素熒光參數的影響[J]. 生態學報,2011,31(7):1811-1817.
[14] 李應旺,吳正鋒,萬書波,等. 弱光脅迫對花生生長發育和生理特性的影響[J]. 花生學報,2009,38(3):41-45.
[15] 張 云,夏國華,馬 凱,等. 遮陰對堇葉紫金牛光合特性和葉綠素熒光參數的影響[J]. 應用生態學報,2014,25(7):1940-1948.
[16] MASSACCI A,NABIV S M,PIETROSANTI L,et al. Response of photosynthesis apparatus of cotton to the onset of drought stress under field conditions by gas change analysis and chlorophyll fluorescence imaging[J]. Plant Physiol Biochem,2008,46:189-195.
[17] 薛惠云,張永江,劉連濤,等. 干旱脅迫與復水對棉花葉片光譜、光合和熒光參數的影響[J]. 中國農業科學,2013,46(11):2386-2393.
[18] FLOWERS M D,FISCUS E L,BURKEY K O,et al. Photosynthesis,chlorophyll fluorescence,and yield of snap bean (Phaseolus vulgaris L.)genotypes differing in sensitivity to ozone[J]. Environ Exp Bot,2007,61:190-198.
[19] NAUMANN J C,YOUNG D R,ANDERSON J E. Linking leaf chlorophyll fluorescence properties to physiological responses for detection of salt and drought stress in coastal plant species[J].Physiol Plant,2007,131:422-433.
[20] SINGH S K,REDDY K R. Regulation of photosynthesis,fiuorescence,stomatal conductance and water-use efficiency of cowpea(Vigna unguiculata L.)under drought[J]. Journal of Photochemistry and Photobiology B:Biology,2011,105(1):40-50.
[21] 王 鑫,李志強,谷衛彬,等. 鹽脅迫下高粱新生葉片結構和光合特性的系統調控[J]. 作物學報,2010,36(11):1941-1949.
[22] 秦玉芝,邢 錚,鄒劍鋒,等. 持續弱光脅迫對馬鈴薯苗期生長和光合特性的影響[J]. 中國農業科學,2014,47(3):537-545.
[23] 張智猛,戴良香,宋文武,等. 干旱處理對花生品種葉片保護酶活性和滲透物質含量的影響[J]. 作物學報,2013,39(1):133-141.
[24] 周曙光,孔祥生,張妙霞,等. 遮蔭對牡丹光合及其他生理生化特性的影響[J]. 林業科學,2010,46(2):56-60.
[25] 尹承苗,張先富,胡艷麗,等. 不同濃度有機物料發酵流體對連作蘋果幼樹葉片光合熒光參數和根系抗氧化酶活性的影響[J]. 中國農業科學,2014,47(9):1847-1857.
[26] 崔豫川,張文輝,李志萍. 干旱和復水對栓皮櫟幼苗生長和生理特性的影響[J]. 林業科學,2014,50(7):66-73.
[27] 曹永慧,周本智,陳雙林. 弱光下水分脅迫對不同產地披針葉茴香幼苗生理特性的影響[J]. 生態學報,2014,34(4):814-822.
[28] AHMAD P,JALEEL C A,SALEM M A,et al. Roles of enzymatic and nonenzymatic antioxidants in plants during abiotic stress[J]. Critical Reviews in Biotechnology,2010,30(3):161-175.
[29] 劉 偉,艾希珍,梁文娟,等. 低溫弱光下水楊酸對黃瓜幼苗光合作用及抗氧化酶活性的影響[J]. 應用生態學報,2009,20(2):441-445.

