白酒酒糟中產纖維素酶菌株的篩選及其酶活力特性檢測
董 丹,車振明,關統偉*
(西華大學微生物研究所,食品生物技術四川省高校重點實驗室,四川 成都 610039)
纖維素是植物細胞壁的主要組成成分,廣泛分布于自然界中。據統計,每年全球通過光合作用產生的纖維素總量達1.7×1012kg[1]。自然界中能產纖維素酶的微生物種類繁多,主要包括真菌,放線菌和部分酵母菌、部分細菌等[2]。纖維素酶多為糖蛋白,酶分子的一級結構由核心催化域(catalytic domain,CD)、纖維素結合域(cellulose binding domain,CBD)和將這兩部分相連的鏈接區(linker)三部分組成,也有僅含核心催化區而無CBD區的纖維素酶,這類酶主要是水解水溶性纖維素[3-4]。
纖維素酶除了用于谷物發酵產酒外,還有很廣泛的用途(應用于如食品、紡織、飼料、石油勘探、中藥成分提取等領域[5-6]),作為一種綠色飼料添加劑,將飼料中的部分纖維素降解成可消化吸收的還原糖,提高飼料利用率[7-12]。目前,纖維素應用最成功的領域就是纖維素在工業上的大規模應用,如用酸性纖維素酶水洗整理牛仔布,這也是目前纖維素酶應用用量最大的領域[13]。目前纖維素酶制造成本還相對較貴,但其應用卻日益廣泛,因而要想其大量運用于商業領域,降低其成本就尤為重要。高產纖維素菌能大大降低纖維素酶的制造成本,因此高產纖維素酶菌株的篩選是關鍵問題之一。白酒是用谷物釀造而成的,但是目前僅僅是利用谷物中的淀粉來發酵生產酒,對谷物和谷物殼中的纖維素利用卻很少。利用微生物發酵的方法,使纖維素在纖維素酶的酶促反應下水解成二糖和葡萄糖,從而不僅使谷物的利用率增加,提高了出酒率,也使得酒糟的營養價值提高和減輕了環境污染問題。
本實驗從白酒糟中篩選產纖維素酶的菌株,并通過測定酶活力大小得出其最適生長pH值和溫度,可為酒廠實際生產過程中充分利用纖維素酶提供參考依據。
1 材料與方法
1.1 材料與試劑
1.1.1 材料
白酒酒糟:瀘州老窖釀酒廠,采自2014年7月,密封保存于-20 ℃備用。
1.1.2 試劑
牛肉膏、蛋白胨、硫酸氫氨、氯化鈉、羧甲基纖維素鈉(carboxymethylcellulose sodium-Na,CMC-Na)、磷酸氫二鉀、硫酸鎂、葡萄糖(均為分析純):成都科龍化工試劑廠;3,5-二硝酸水楊酸(3,5-dinitrosalicylic acid,DNS)(化學純):南京歐特化工試劑廠。
1.1.3 培養基
篩選培養基:CMC-Na 1 g,瓊脂2 g,(NH4)2SO40.25 g,K2HPO40.3 g,MgSO4·7H2O 0.05 g,定容至100 mL,pH值為7.2。
種子培養基:牛肉膏1 g,蛋白胨0.3 g,NaCl 0.5 g,定容至100 mL,pH值為7.0。
發酵產酶培養基:(NH4)2SO40.25 g,K2HPO40.3 g,MgSO4·7H2O 0.05 g,CMC-Na 0.6 g,葡萄糖0.4 g,定容至100 mL,pH值為7.0。
1.2 儀器與設備
DHP-9052電熱恒溫培養箱、DHG-9075A電熱恒溫鼓風干燥箱:上海一恒科學儀器有限公司;ZWY-1102C恒溫培養振蕩器:上海智城分析儀器制造有限公司;TDZS-WS冷凍離心機:上海盧湘儀;LDZX-75KB立式壓力蒸汽滅菌器:上海中安醫療器械廠;DYY-8C雙定時電泳儀:北京市六一儀器廠。
1.3 實驗方法
1.3.1 產纖維素酶菌株的初篩
稱取10 g白酒酒糟置于100 mL的錐形瓶中,加入90 mL無菌水,搖勻。取混合后溶液的上清液按10倍稀釋法依次稀釋成10-2、10-3、10-4倍的稀釋溶液,用無菌移液槍分別移取100 μL各稀釋液于篩選培養基,用涂布棒將菌液均勻涂布于培養基表面,放置于37 ℃恒溫培養箱中培養2~3 d,觀察有無水解圈的產生,通過測定水解圈的大小來初步判定菌株酶活力的大小。
1.3.2 產纖維素酶菌株的復篩
(1)選取培養基上呈單菌落的菌,用無菌的竹簽分別挑取不同形態的菌落進行分離純化。放置于37 ℃恒溫培養箱中培養2~3 d[14],重復此步驟直至每種菌為純菌落。
(2)當培養的菌純化后,向培養基里加入適量的2%剛果紅溶液[15],染色15 min后用蒸餾水和1 mol/L氯化鈉溶液清洗[16]。觀察菌團周圍有無水解圈,有水解圈的菌可初步判定為產纖維素酶菌株。菌落若產生羧甲基纖維素酶(CMCase),培養基中的羧甲基纖維素(CMC)將被分解,剛果紅將不能吸附并著色,再用1 mol/L氯化鈉溶液洗滌后,菌落周圍就會形成透明圈,而平板中沒有產生CMCase的菌落和其他部位仍為紅色[17-18]。
(3)將產纖維素酶菌菌株保藏于-20 ℃冰箱中備用。
1.3.3 產纖維素酶菌株的鑒定
DNA的提取:DNA的提取采用改良十六烷基三甲基溴化銨法(cetyltrimethyl ammonium bromide,CTAB)[19-20]法。得到的樣品總DNA于-20 ℃保存,作為后續PCR的模板。
PCR及產物的純化:以提取得到的DNA為模板,細菌選擇通用引物Eμ27F(5'-AGAGTTTGATCCTGGCTCAG-3');1490R(5'-GGTTACCTTGTTACGACTT-3')。反應條件:95 ℃、4 min,95 ℃、60 s,56 ℃、60 s,72 ℃、120 s,35個循環;72 ℃、10 min。PCR反應體系為50 μL:10×Buffer 5 μL、dNTP4μL、Taq酶0.5 μL、上下游引物各1μL、ddH2O37.5μL、DNA模板1 μL。PCR產物用1.4%瓊脂糖凝膠電泳檢測,電泳時間40 min。純化過程按照DNA膠回收試劑盒中的步驟進行,具體步驟參照OMEGA公司E.Z.N.A.TM Gel Extraction Kit試劑盒說明。
測序:PCR產物純化后送往生工生物工程(上海)股份有限公司測序,測序結果提交NCBI(http://www.ncbi.nlm.nih.gov/)進行Blast序列分析。
1.3.4 纖維素酶活力測定
(1)纖維素粗酶液的制備
將產纖維素酶菌株接種于種子培養基中,37 ℃、200 r/min搖床培養24 h后,取發酵液以2%的加樣量加入發酵培養基,37 ℃、200 r/min 搖床培養24 h。培養后8 000 r/min常溫離心10 min,取上清液為粗酶液測定纖維素酶活力。
(2)纖維素酶活力的測定方法
DNS試劑的配制:稱取DNS 3.15 g,加水500 mL,攪拌5 s,45 ℃水浴。然后逐步加入100 mL 0.2 g/mL氫氧化鈉溶液,同時不斷攪拌。直到溶液清澈透明(在加入氫氧化鈉的過程中,溶液的溫度不能超過48 ℃)。再逐步加入四水酒石酸鉀鈉91.0 g、苯酚2.50 g和無水硫酸鈉2.50 g。繼續45 ℃水浴加熱,同時補水300 mL,不斷攪拌,直到加入的物質完全溶解。停止加熱,冷卻至室溫后,用水定容至1 000 mL。用燒結玻璃過濾器過濾。取濾液,儲存在棕色瓶中,避光保存。室溫條件下保存7 d后使用,有效期6個月。
葡萄糖標準曲線的測定見參考文獻[21]。
羧甲基纖維素酶活定義:1 g固體酶(或1 mL液體酶),在指定溫度和pH條件下,水解CMC-Na底物0.5 h,產生相當于1 mg葡萄糖的還原糖量,為一個酶活力單位,以U/g(或U/mL)表示。簡寫成CMCA-DNS[17]。
羧甲基纖維素(還原糖法)酶活測定過程:取1 mL粗制酶液與2 mL CMC-Na溶液(底物)在50 ℃水浴下混合反應30 min,取出后加入DNS試劑3.0 mL[18],放入沸水浴中加熱10 min,取出后用流水迅速冷卻至室溫,蒸餾水定容至20 mL,分光光度計在波長540 nm處測定OD值,通過葡萄糖標準曲線求出還原糖的含量,根據產生1 mg葡萄糖的還原糖量,為一個酶活力單位為計算方法,計算出具體的酶活(空白試驗除先滅酶外,其余條件不變)。
1.3.5 最適溫度的測定
將1 mL粗制酶液與2 mL的CMC-Na溶液混合后,分別在20 ℃、30 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃、75 ℃、80 ℃條件下反應30 min后測定其酶活。
1.3.6 最適pH值的測定
將1 mL粗制酶液與2 mL的CMC-Na溶液混合后,放置在溫度30 ℃條件,調節pH值分別為2、3、4、5、6、7條件下反應后,測定其酶活。
2 結果與分析
2.1 產纖維素酶菌種篩選結果
2.1.1 菌株初篩結果

表1 產纖維素酶菌株的初篩結果Table 1 Preliminary screening results of cellulose-producing strain
由表1可知,菌株p1004的水解圈最大,菌株p1001的水解圈次之,水解圈最小的是菌株p1002。
2.1.2 菌株復篩結果
將初篩得到的菌株進行分離純化,待菌落長成后選擇透明圈較大、菌落較小的菌株進行發酵培養。對菌落進行剛果紅染色,初篩得到的3株產纖維素菌株產生的透明圈的效果明顯,其中菌株p1001和p1004的透明圈更加明顯。
2.1.3 葡萄糖標準曲線的繪制以及纖維素酶活力的測定
通過繪制的葡萄糖標準曲線方程為y=0.616 1x-0.030 7(R2=0.996 4),根據標準曲線計算出3株菌的酶活力。在p1001、p1002、p1004三株菌株中,酶活力最高的菌株為p1004,酶活力大小為1.23 U/mL,約為p1001、p1002酶活力的兩倍。
2.2 產纖維素酶菌種的鑒定
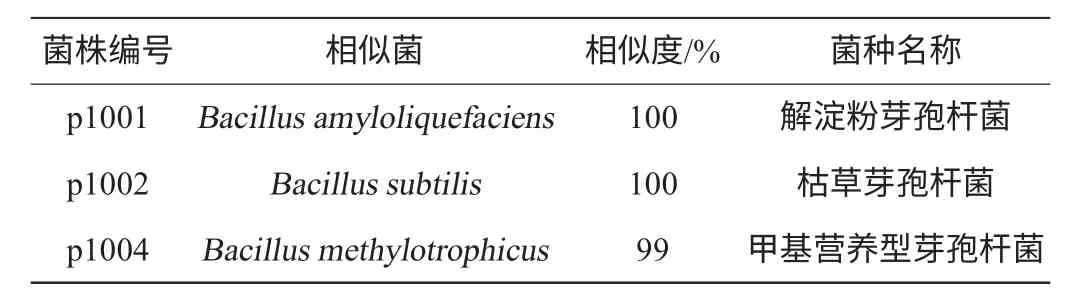
表2 菌株分子鑒定結果Table 2 Identification results of strains
由表2可知,這三株菌同屬于一個屬即芽孢桿菌屬(Bacillus)。經鑒定p1001為解淀粉芽孢桿菌(Bacillus amyloliquefaciens),p1002為枯草芽孢桿菌(Bacillus subtilis),p1004為甲基營養型芽孢桿菌(Bacillus methylotrophicus),與其相似菌株的相似度分別為100%、100%、99%。
2.3 溫度對菌株酶活力的影響
將不同纖維素粗制酶液與底物在不同的溫度條件下反應后,得到酶活力隨溫度變化的曲線如圖1所示。
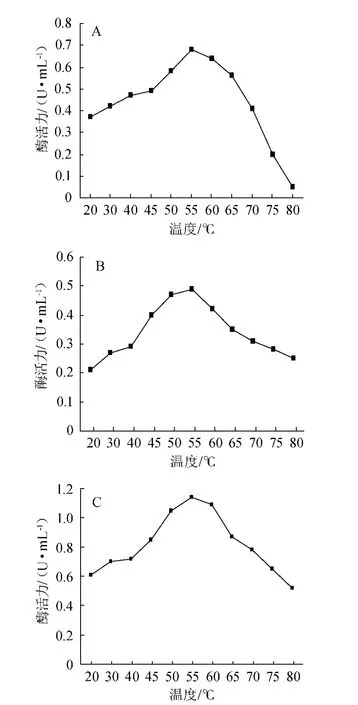
圖1 溫度對菌株p1001(A)、p1002(B)、p1004(C)酶活力的影響Fig.1 Effect of temperature on enzyme activity of strain p1001 (A),p1002 (B) and p1004 (C)
從圖1A可以看出,菌株p1001在20~45 ℃酶活力緩慢上升,45~55 ℃酶活力快速上升,55~80 ℃酶活力快速下降,最適生長溫度為55 ℃。從圖1B可以看出,菌株p1002在20~40 ℃酶活力緩慢上升,40~55 ℃酶活力快速上升,55~70 ℃酶活力快速下降,70~80 ℃酶活力下降趨勢稍微變緩,最適生長溫度為55 ℃。從圖1C可以看出,菌株p1004在20~40 ℃酶活力緩慢上升,40~55 ℃酶活力快速上升,55~60 ℃酶活力緩慢下降,60~80 ℃酶活力下降速率增加,最適生長溫度為55 ℃。故三種菌株的最適生長溫度均為55 ℃。
三株菌的酶活力隨溫度的變化情況都出現了先增后減的情況,隨著溫度從低溫升至55 ℃時,在最適溫度下,細胞生長最快,細胞膜的通透性最強,因此在此條件下,細菌內酶活力最強,當溫度持續升高的過程中,高溫破壞了細菌的細胞結構,致使細菌不能正常的進行新陳代謝,以至于抑制了細菌正常的產酶功能,酶活力降低,故最適溫度為55 ℃。
2.4 pH值對菌株酶活力的影響
將纖維素粗酶液與底物在不同pH條件下反應后,得到酶活力隨pH值變化的曲線如圖2所示。

圖2 pH對菌株p1001(A)、p1002(B)、p1004(C)酶活力的影響Fig.2 Effect of pH on enzyme activity of strain p1001 (A),p1002 (B) and p1004 (C)
從圖2可知,菌株p1001在pH值為2~4時,菌株p1002和p1004在pH值為2~5時,酶活力隨pH值的增加而增加,pH值在5時達到最大值,在pH值>5時,酶活力隨pH值的增加急劇下降。因此三種菌株的最適生長pH值均為5。
酶在最適pH范圍內表現出活性,大于或小于最適的pH值,都會降低酶活性。主要是因為pH值的不同會改變底物分子和酶分子的帶電狀態,從而影響酶和底物的結合;過高或過低的pH值都會影響酶的穩定性,進而使酶遭受不可逆的破壞,因此最適pH值為5。
3 結論
長期以來,酶的產量和酶活力低一直是制約纖維素酶實際應用的一個重要原因,因此,不斷的篩選高產纖維素酶菌株,對纖維素資源的利用有著重要的意義。本實驗中分離得到的三株產纖維素酶菌株的最適產酶溫度都為55 ℃,pH值為5。菌株p1004所產纖維素酶最大酶活為1.2 U/mL,約為菌株p1001和p1002最大酶活的兩倍。因此,利用菌株p1004來提高纖維素酶產量具有一定的實用價值,為后期解決纖維素酶產量低、活力低等問題提供了理論基礎。
[1]ZHANG Y H P,LYND L R.Toward an aggregated understanding of enzymatic hydrolysis of cellulase:noncomplexed cellulase systems[J].Biotechnol Bioeng,2004,88(7):797-824.
[2]程仕偉,李坦坦,梁會會.響應面優化金橙黃微桿菌YT9 的發酵條件生產纖維素酶[J].中國釀造,2013,32(4):48-51.
[3]AHAMED A,VERMTTE P.Enhanced enzyme production from mixed cultures ofTrichoderma reeseiRUT-C30 andAspergillus nigerLMA grown as fed batch in a stirred tank bioreactor[J].Biochem Eng J,2008,42(1):41-46.
[4]MA L,ZHANG J,ZOU G,et al.Improvement of cellulase activity inTrichoderma reeseiby heterologous expression of a beta-glucosidase gene fromPenicillium decumbens[J].Enzyme Microb Tech,2011,49(4):366-371.
[5]張年鳳,趙允麟.纖維素酶菌株的選育及其產酶條件[J].糧食與飼料工業,2003(5):23-25.
[6]何剛強,堵國成,劉立明,等.從白蟻中分離篩選纖維素分解菌及其產酶性質[J].食品與生物技術學報,2009,28(3):352-355.
[7]LLEWELLYN D A,MARSTON T T,TEUTEMACHER K L,et al.Evaluation of low molecular weight fractions and crude enzyme preparation from aTrichodermacellulase complex as a treatment for fibrous feeds[J].Anim Feed Sci Tech,2010,160(1-2):39-48.
[8]劉 大,鞠 濤,楊 方,等.纖維素酶的反芻動物飼料中的應用研究進展[J].東北農業大學學報,2011,42(6):7-11.
[9]VILA B,QUEIROZ D,BADIOLA I,et al.Effects of carob bean gum on performance,nutrient digestibility andSalmonella entericavar.enteritidis colonisation in chickens[J].Food Res Int,2012,45(2):1133-1138.
[10]李明華,張大偉,楚 杰,等.飼料纖維素酶的研究與應用進展[J].飼料與畜牧,2006(7):28-32.
[11]YANG H J,XIE C Y.Assessment of fibrolytic activities of 18 commercial enzyme products and their abilities to degrade the cell wall fraction of corn stalks inin vitroenzymatic and ruminal batch cultures[J].Anim Feed Sci Tech,2010,159(3-4):110-121.
[12]TRIVEDI N,GUPTA V,KUMAR M,et al.An alkali-halotolerant cellulose fromBacillus flexusisolated from green seaweedUlva lactuca[J].Carbohyd Polym,2011,83:891-897.
[13]MICTTINCN-OINOCN A,PALOHCIMO M,LANTTO R,et al.Enhanced production of ecllobiohydrolascs inTrichodema reeseiand evaluation of the new preparations in biofinishing of cotton[J].J Biotechnol,2005,116(3):305-317.
[14]ZHANG Y H,HIMMEL M E,MEILENZ J R.Outlook for cellulase improvement:Screening and selection strategies[J].Biotechnol Adv,2003,24(3):452-481.
[15]TRIVEDI N,GUPTA V,KUMAR M.An alkali-halotolerant cellulase fromBacillus flexusisolated from green seaweedUlva lactuca[J].Car-bohyd Polym,2011,83(2):891-897.
[16]陳阿娜,湯 斌.一種改進的纖維素分解菌鑒別培養基[J].生物學雜志,2006,23(6):48-49.
[17]胡國全.極端嗜熱厭氧纖維素菌的分離鑒定及其分子生物學的研究[D].成都:四川大學博士論文,2004.
[18]吳 瓊,苑 琳,路福平.高堿性纖維素酶產生菌的篩選及鑒定[J].生物技術通報,2010(9):205-209.
[19]CHEN Q,WEI S,DENG Z,et al.Optimization of DNA extraction from seeds of sorghum sudanense (Piper) Stapf[J].Not Bot Hort Agrobot Cluj,2009,37(1):256-260.
[20]MISHRA M K,RAN N S,RAM A S,et al.A simple method of DNA extraction from coffee seeds suitable for PCR analysis[J].Afr J Biotechnol,2008,7(4):409-413.
[21]中華人民共和國國家發展和改革委員會.QB 2583—2005 纖維素酶制劑[S].北京:中國標準出版社,2003.

