黑花生衣原花色素和花色苷的提取工藝研究
歐陽燕林,譚興和 *,王 鋒,郭紅英,鄧潔紅,李 林,張春艷,張 喻
(1.湖南農業大學 食品科學與技術學院,湖南 長沙 410128;2.食品科學與生物技術湖南省重點實驗室,湖南 長沙 410128;3.湖南農業大學 農學院,湖南 長沙 410128)
黑花生衣中含有原花色素、花色苷、白藜蘆醇、槲皮素等黃酮類化合物,具有很好的保健作用。杜蕾等[1]研究表明,黑花生衣中的原花色素含量達29.19%,王鋒[2]研究表明,黑花生衣花色苷含量達4.93 mg/g干質量。黑花生衣約占黑花生仁質量的3%~4%[2],在黑花生加工過程中被剝除,造成資源浪費。開發和利用黑花生衣色素對資源的綜合利用具有重大意義。
原花色素(proanthocyanidins)又稱原花青素,是黃烷-3-醇衍生物的總稱,由兒茶素和表兒茶素組成,有多種聚合體形式[3]。花色苷(anthocyanin)是花色素的糖苷衍生物,常見的花色素有矢車菊色素、飛燕草色素、天竺葵色素、芍藥色素、牽牛花色素、錦葵色素等[4]。原花色素和花色苷都是高活性的天然抗氧化劑,原花色素的抗氧化能力是VC的20倍,是VE的50倍[5]。研究表明,原花色素和花色苷都有清除自由基、抗癌、抗心血管疾病、降血脂等作用[6-11]。目前,已運用到食品、保健品、醫藥、化妝品等領域。
響應面分析法(response surface method,RSM)可以分析試驗指標與多個試驗因素間的回歸關系,是用于優化工藝條件的有效分析方法。根據相關研究,原花色素和花色苷的提取工藝條件相似,故本試驗在單因素試驗的基礎上,用響應面分析法同時優化黑花生衣原花色素和花色苷的提取工藝參數,使提取液中原花色素和花色苷的含量同時達到最大,節約分別提取的成本。本試驗研究同時提取黑花生衣原花色素和花色苷的工藝條件,旨在減少提取時間和提取劑用量,從而提高提取效率,降低成本,減少環境污染,為工業生產提供參考。
1 材料與方法
1.1 材料與試劑
黑花生衣:湖南省江永縣義華花生制品有限公司;乙醇、甲醇、鹽酸、硫酸等試劑(均為分析純):國藥集團化學試劑有限公司;原花青素標準品(純度≥95%):成都曼斯特生物科技有限公司。
1.2 儀器與設備
SKY-恒溫培養振蕩器:上海蘇坤實業有限公司;RE-2000B旋轉蒸發器、SHZ-D(Ⅲ)循環水真空泵:鞏義市予華儀器有限責任公司;HH-8數顯恒溫水浴鍋:上海浦東物理光學儀器廠;WFJ7200型可見分光光度計:尤尼柯(上海)儀器有限公司。
1.3 方法
1.3.1 原花色素、花色苷的提取
黑花生衣磨碎,過30目篩,準確稱取0.2 g黑花生衣碎末于50 mL的錐形瓶中,加入一定體積、濃度和pH值的乙醇溶液,用保鮮膜封口,置于一定溫度的恒溫搖床中,遮光,保持搖動頻率為120 r/min,振蕩一定的時間。提取完成后進行抽濾,取1/2濾液(按加入的乙醇提取劑體積計算),經40 ℃旋轉蒸發后,用水定容至10 mL,測定花色苷含量,稀釋3倍后測定原花色素含量。
1.3.2 原花色素含量的測定
原花色素含量的測定:采用香草醛-硫酸法測定,參考SUN B等[12]方法。
原花青素標準曲線的繪制:配制質量濃度為0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL的原花青素標準溶液,分別取0.5 mL標液,加入2.5 mL 1%香草醛-甲醇溶液,再加入2.5 mL 25%硫酸-甲醇溶液,在波長500 nm處測定其吸光度值,繪制標準曲線。
樣品原花色素含量的測定:取0.5 mL樣液,加入2.5 mL 1%香草醛-甲醇溶液,再加入2.5 mL 25%硫酸-甲醇溶液,在波長500 nm處測定其吸光度值A1;對照組:取0.5 mL樣液,加入2.5 mL甲醇,再加入2.5 mL 25%硫酸-甲醇,在波長500 nm處測定其吸光度值A0。
原花色素吸光度值A=A1-A0,計算原花色素含量。原花色素得率計算公式如下:
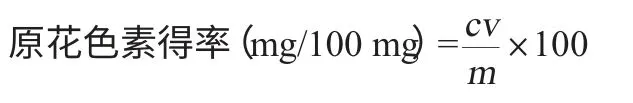
式中:c為原花色素質量濃度,mg/mL;v為樣液體積,mL;m為樣品黑花生衣質量,mg。
1.3.3 原花青素的回收率試驗
由于黑花生衣提取液中含有花色苷,呈紅色,原花色素在香草醛和硫酸的作用下也呈紅色,故本試驗采取對照試驗消除花色苷引起的誤差。稱取10 mg黑花生衣粗提物粉末,用水定容至10 mL,稀釋一倍后,按上述方法測定原花色素含量;稱取6.4mg原花青素標準品,用水定容到10 mL,配制成質量濃度為0.64mg/mL溶液。在黑花生衣提取液中加入一定量的原花青素標液,測定原花色素含量。
1.3.4 花色苷含量的測定
用pH示差法測定,參考GINSTI M M等[13]方法測定花色苷的含量。花色苷得率的計算公式如下:
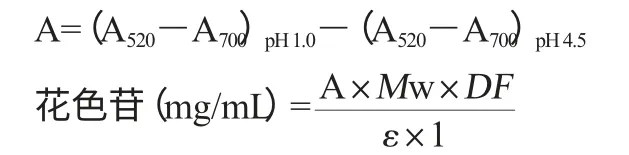
式中:A為吸光度差值;Mw為矢車菊-3-葡萄糖苷的分子質量,449.2;DF為稀釋因子;ε為矢車菊-3-葡萄糖苷摩爾消光系數,26 900;1為光程,cm。
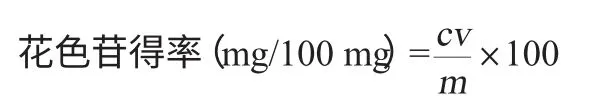
式中:c為花色苷質量濃度,mg/mL;v為樣液體積,mL;m為黑花生衣質量,mg。
1.3.5 單因素試驗
準確稱取0.2 g黑花生衣碎末于50 mL的錐形瓶中,以黑花生衣中原花色素和花色苷的得率為評價指標,分別考察pH值(2、3、4、5、自然)、液料比(30∶1、40∶1、50∶1、60∶1、70∶1(mL∶g))、乙醇體積分數(30%、40%、50%、60%、70%、80%、90%)、提取溫度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃)、提取時間(30 min、60 min、90 min、120 min、150 min、180 min)對原花色素和花色苷提取效果的影響。
1.3.6 響應面試驗
根據單因素試驗結果,固定pH 3,提取時間120 min。選擇液料比(A)、乙醇體積分數(B)、提取溫度(C)3個因素為自變量,以原花色素得率(Y1)和花色苷得率(Y2)為響應值,響應面試驗因素與水平見表1。

表1 響應面試驗因素與水平Table 1 Factors and levels of response surface design
2 結果與分析
2.1 原花青素標準曲線
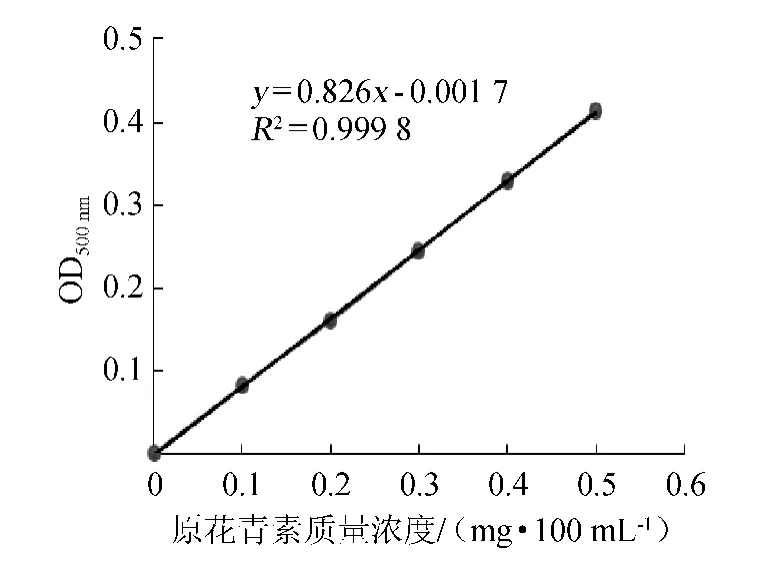
圖1 原花青素標準曲線Fig.1 Standard curve of proanthocyanidin
以原花青素含量(x)為橫坐標,吸光度值(y)為縱坐標,繪制原花青素標準曲線,結果見圖1。
由圖1可知,標準曲線回歸方程:y=0.826 0x-0.001 7,相關系數為R2=0.999 8,表明原花青素含量與吸光度值在0.1~0.5 mg/mL質量濃度范圍內具有良好的線性關系。
2.2 原花青素的回收率
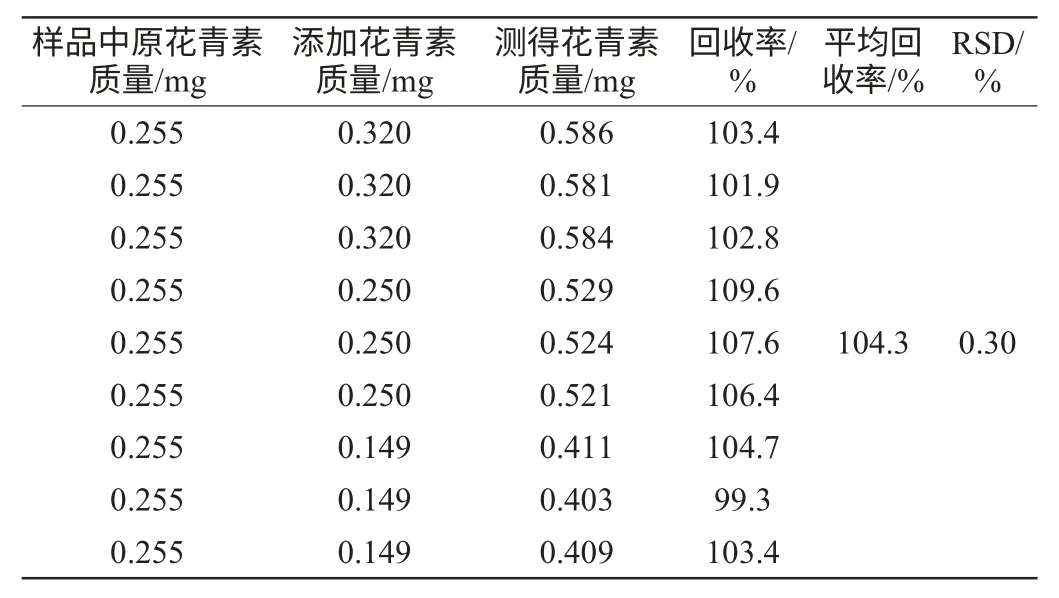
表2 回收率試驗結果Table 2 Results of the recovery tests
由表2可知,該測定方法的回收率在99.3%~109.6%,平均回收率為104.3%,相對標準偏差(relative standard deviation,RSD)為0.30%,由此可知該檢測方法準確度良好,可以用于測定原花色素含量,彭芳剛等[14]也用到了此法來消除其他色素引起的誤差。
2.3 單因素試驗結果
2.3.1 pH對原花色素和花色苷提取效果的影響
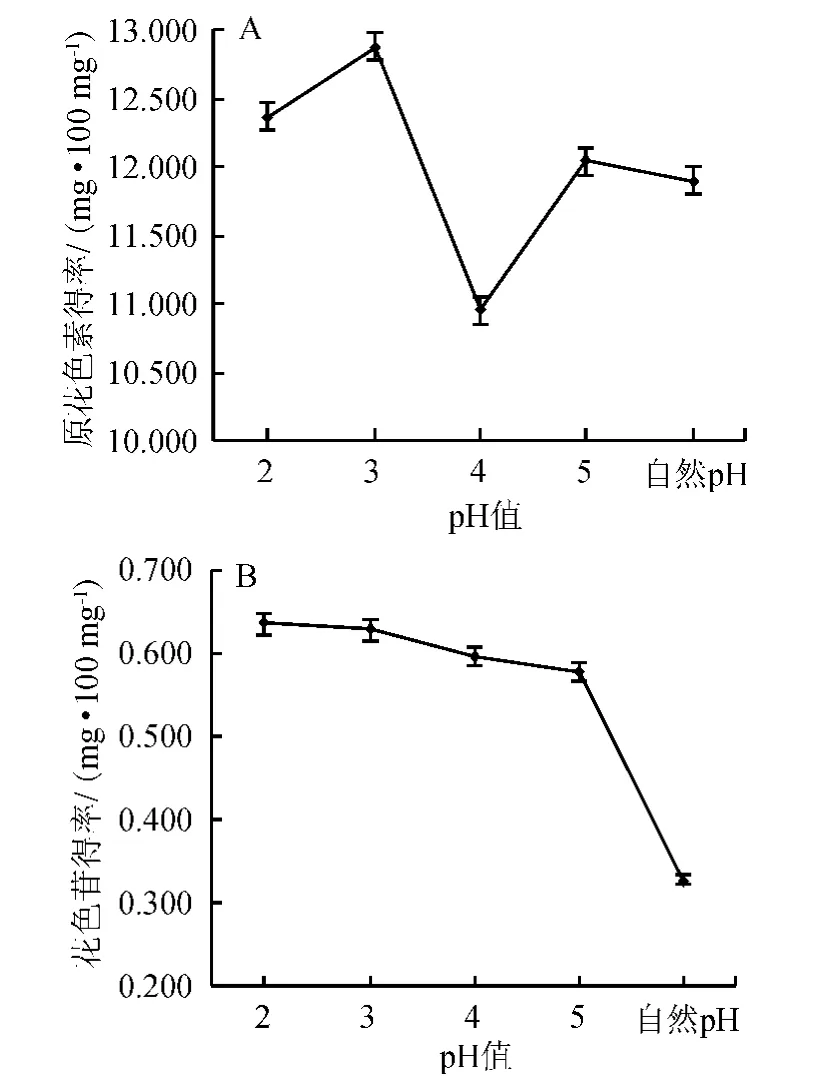
圖2 pH對原花色素(A)和花色苷(B)提取效果的影響Fig.2 Effect of different pH on the extraction of proanthocyanidins(A) and anthocyanins (B)
由圖2可知,原花色素的得率在pH值為3及5處分別出現峰值,分別為12.883 mg/100 mg、12.047 mg/100 mg,由于原花色素中含有酚羥基,呈弱酸性,因此在pH值較低和接近中性時,提取效果較好,故適宜的酸性條件有利于原花色素溶出;花色苷得率隨pH上升而下降,在pH值為2時達到最高,為0.636 mg/100 mg,原因是花色苷在酸性條件下穩定。pH值為3時花色苷得率下降不明顯,綜合考慮原花色素和花色苷的得率,故選擇pH值為3較為合適。
2.3.2 液料比對原花色素和花色苷提取效果的影響
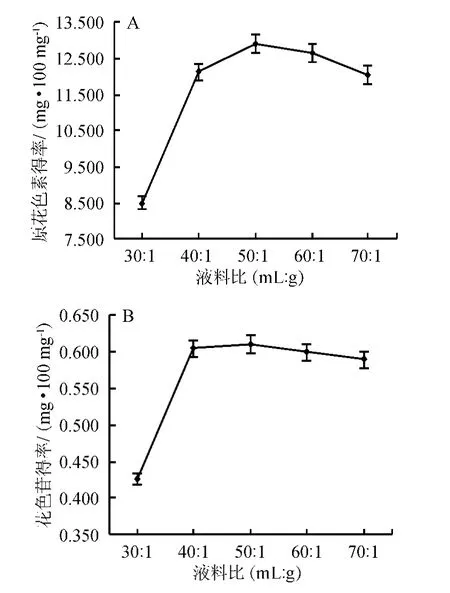
圖3 液料比對原花色素(A)和花色苷(B)提取效果的影響Fig.3 Effect of different liquid-material ratio on the extraction of proanthocyanidins (A) and anthocyanins (B)
由圖3可知,原花色素得率和花色苷得率都隨液料比增加先快速上升,再逐漸趨于平穩,都在液料比50∶1(mL∶g)時達到最高點,分別為12.883 mg/100 mg、0.610 mg/100 mg。液料比的大小與液固兩相的濃度差(即傳質推動力)有關,在提取過程中,液料比小,則液相濃度增加快,兩相濃度差減少快,故傳質推動力減弱的速度加快,不利于目標物的得率增加[15]。從經濟角度考慮,故選擇液料比50∶1(mL∶g)為宜。
2.3.3 乙醇體積分數對原花色素和花色苷提取效果的影響
由圖4可知,原花色素得率和花色苷得率都隨乙醇體積分數的增加先上升后下降,都在乙醇體積分數為50%時達到最大,分別為12.774 mg/100 mg、0.651 mg/100 mg。根據相似相溶的原理,原因可能是原花色素和花色苷的極性與乙醇水溶液極性接近時,溶出效果最好[16];還有可能是因為乙醇體積分數低,蛋白質、糖類等水溶性物質易溶出,乙醇體積分數過高,脂溶性物質易溶出,影響原花色素和花色苷溶出[17]。故選擇乙醇體積分數50%為宜。
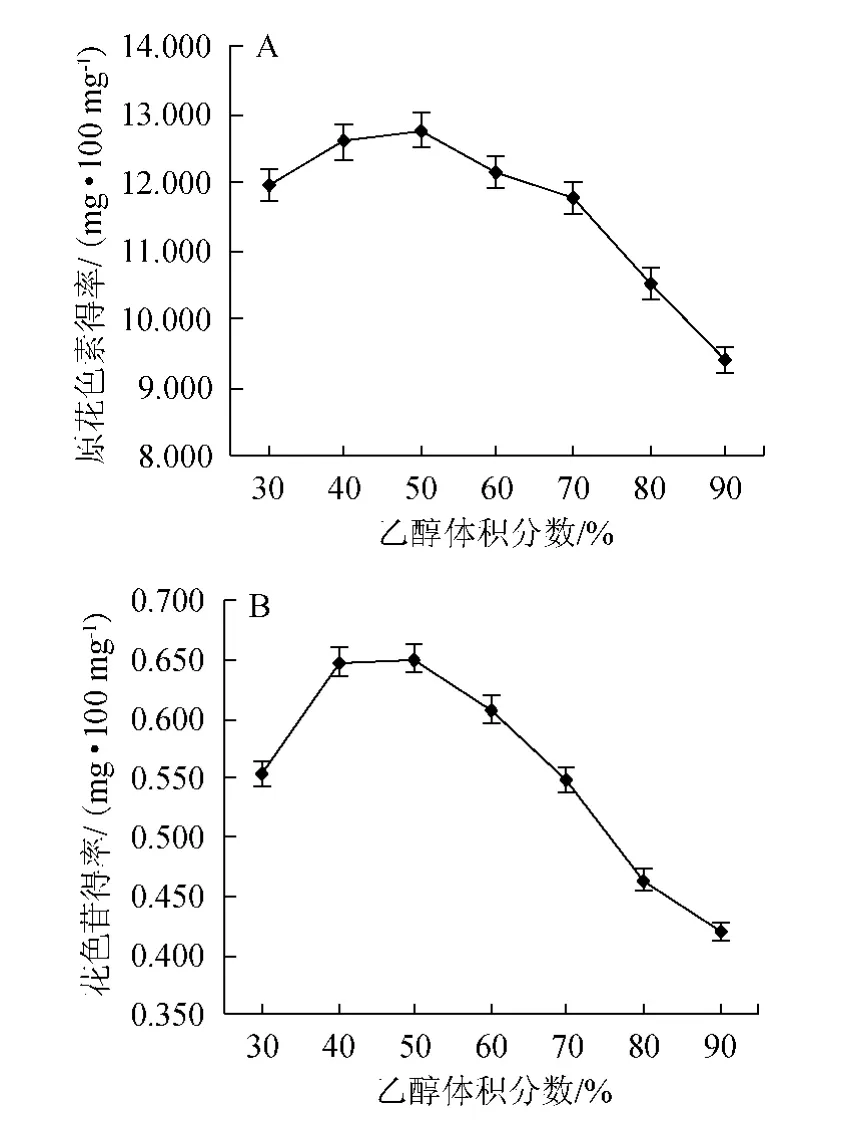
圖4 乙醇體積分數對原花色素(A)和花色苷(B)提取效果的影響Fig.4 Effect of different ethanol concentration on the extraction of proanthocyanidins (A) and anthocyanins (B)
2.3.4 提取溫度對原花色素和花色苷提取效果的影響
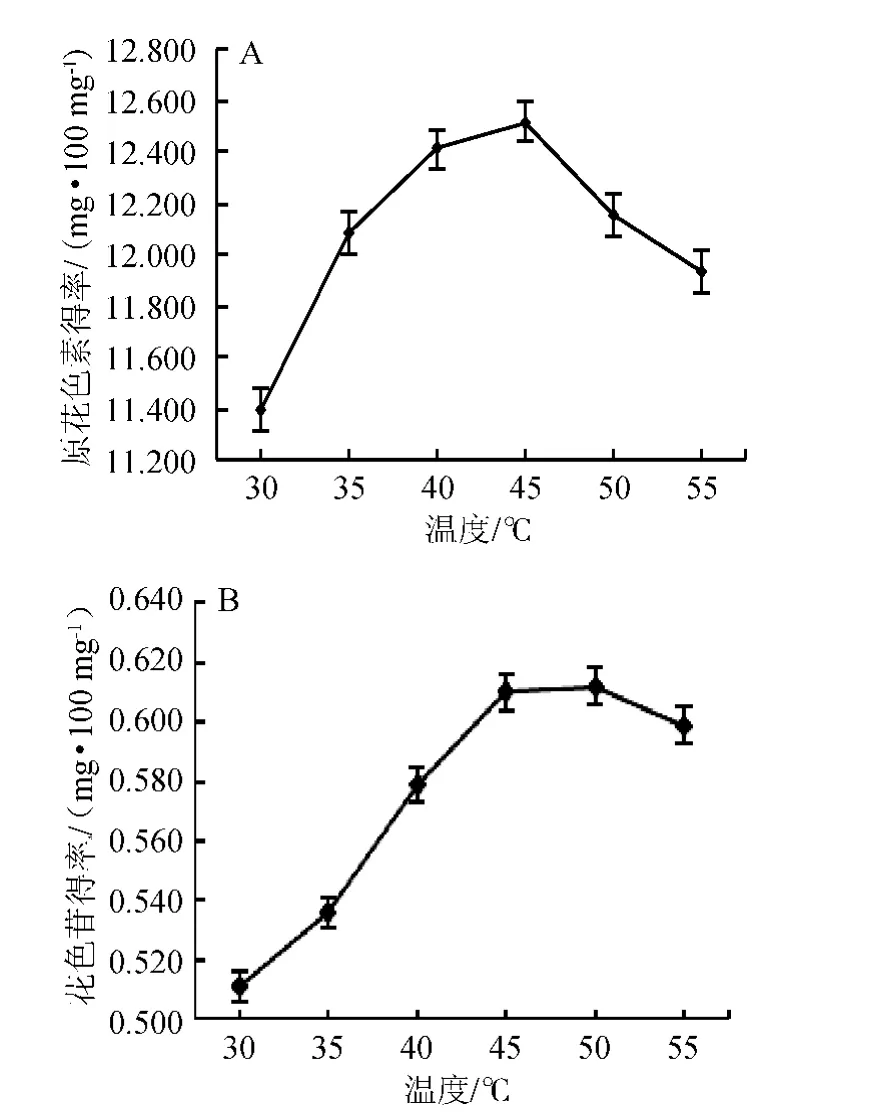
圖5 提取溫度對原花色素(A)和花色苷(B)提取效果的影響Fig.5 Effect of different extraction temperature on the extraction of proanthocyanidins (A) and anthocyanins (B)
由圖5可知,原花色素得率隨著溫度的上升先上升后下降,在45 ℃達到最大,為12.519 mg/100 mg;花色苷得率隨著溫度的上升先上升,然后趨于平穩,達到最大值后下降,在50 ℃達到最大,為0.612 mg/100 mg。花色苷得率在45 ℃和50 ℃時無明顯差異,溫度升高可以加快分子的擴散速度,但溫度過高可能導致原花色素分解和花色苷降解。綜合考慮原花色素和花色苷的得率,故選擇45 ℃為適宜提取溫度。
2.3.5 提取時間對原花色素和花色苷提取效果的影響
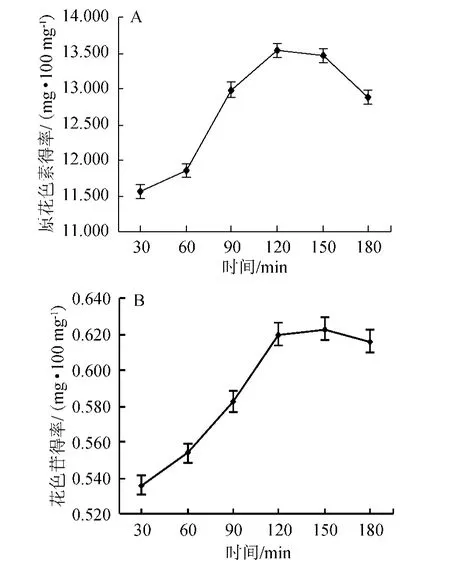
圖6 提取時間對原花色素(A)和花色苷(B)提取效果的影響Fig.6 Effect of different extraction time on the extraction of proanthocyanidins (A) and anthocyanins (B)
由圖6可知,原花色素和花色苷得率都隨著提取時間的增加而上升,最后下降,原花色素得率在120 min時達到最大,為13.536 mg/100 mg;花色苷得率在150 min時達到最大,為0.623 mg/100 mg。提取時間對于提取效果很關鍵,提取時間延長,原花色素和花色苷溶出越多,最后提取液接近飽和,原花色素和花色苷溶出速度變慢;而且時間太長可能會導致原花色素和花色苷氧化。通過分析數據可知,花色苷在120 min和150 min的得率變化不顯著(P=0.612>0.05),綜合考慮兩個指標的得率,故選擇提取時間120 min為宜。
2.4 響應面試驗結果分析
2.4.1 響應面試驗結果與分析
響應面試驗設計及結果分析見表3,利用Design Expert 8.0.5軟件對表3試驗數據進行回歸分析,得到數學模型,并對所得模型進行方差分析,結果分別見表4、表5。
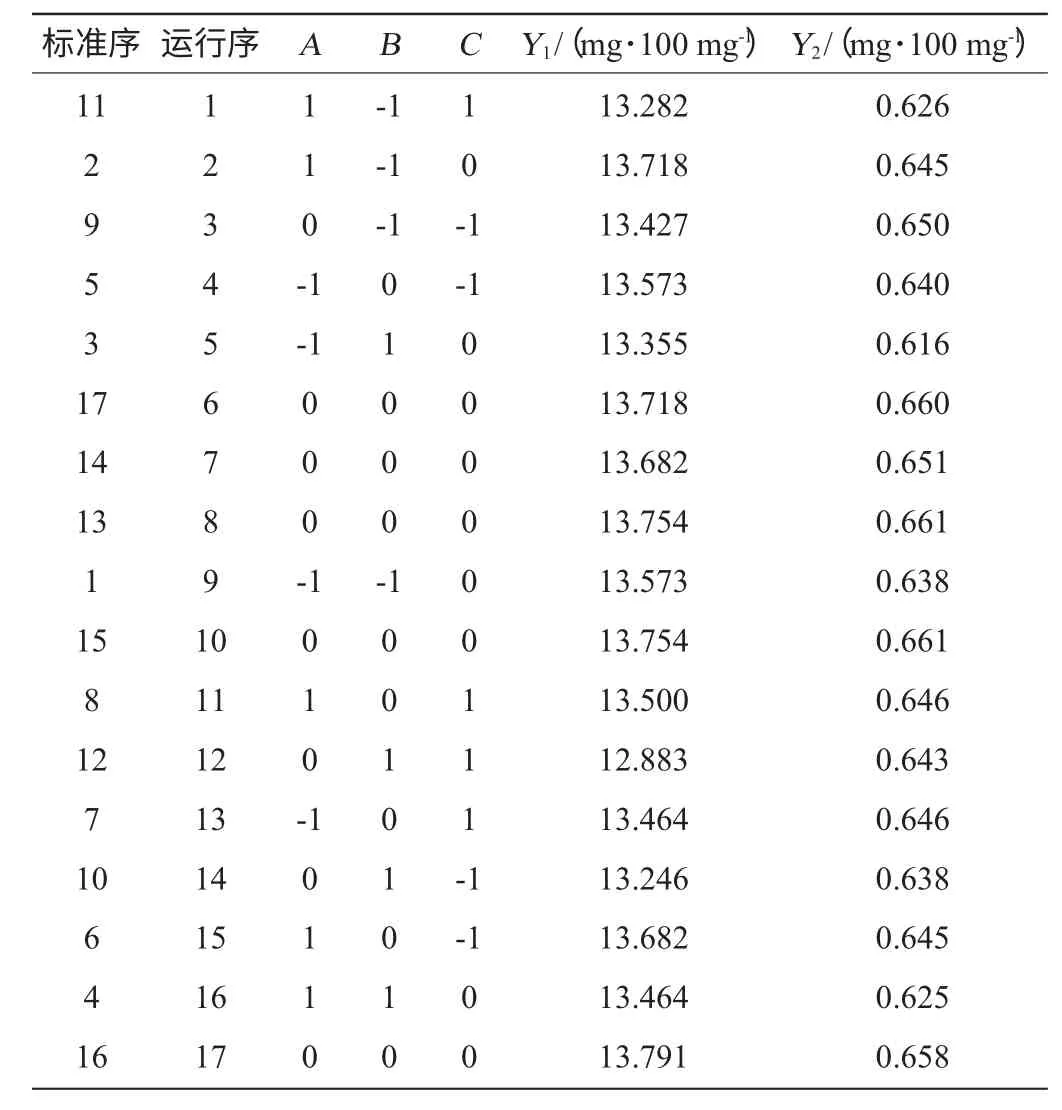
表3 響應面試驗結果Table 3 Results of response surface analysis
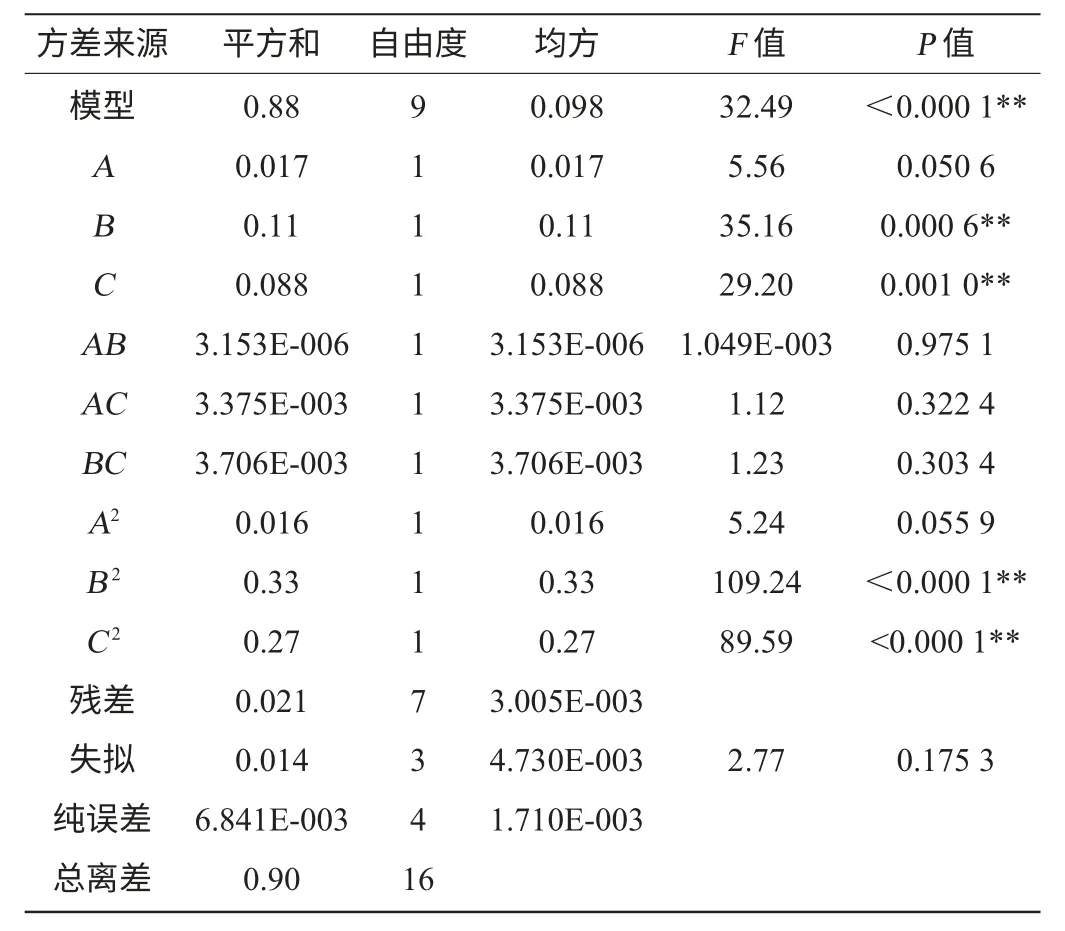
表4 以原花色素含量為響應值的回歸模型方差分析Table 4 Variance analysis of regression model using proanthocyanidins contents as response value
以原花色素得率(Y1)和花色苷得率(Y2)為響應值,3個因素的二次多項回歸方程分別為:

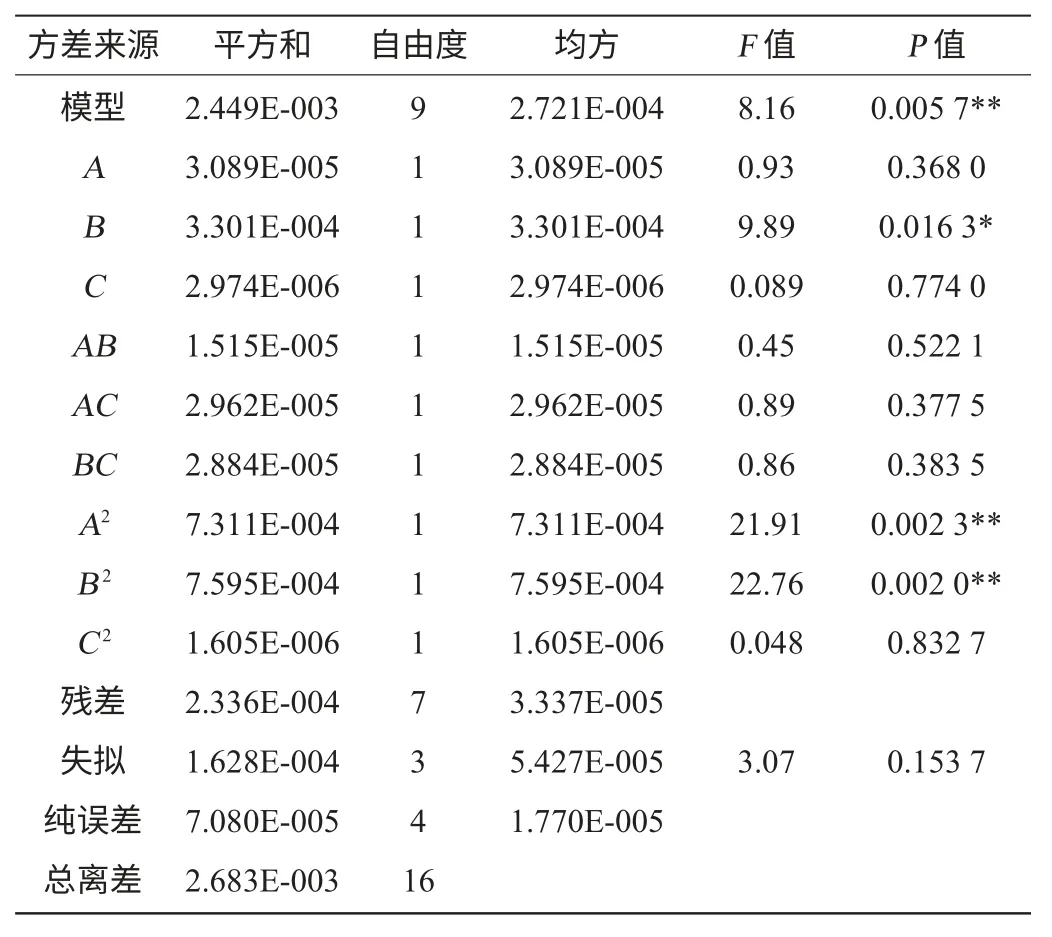
表5 以花色苷含量為響應值的回歸模型方差分析Table 5 Variance analysis of regression model using anthocyanins contents as response value
比較上述兩個方程A、B、C對應系數的絕對值可以判斷出3個因素對提取效果的影響大小順序。3個因素對原花色素提取效果影響的大小為B>C>A,對花色苷提取效果影響的大小為B>A>C。
由表4可知,模型P<0.000 1,說明模型極顯著,失擬項P=0.175 3>0.05,說明失擬度不顯著,殘差由隨機誤差引起,說明模型擬合度良好,可以用來對原花色素提取效果進行分析和預測。決定系數R2=0.976 6,說明該模型擬合97.66%的試驗數據。變異系數(coefficient of variation,CV)值越低,說明試驗可靠性越高。變異系數CV=0.41%,說明本試驗的可靠性高。從表4可以看出,B、C、B2、C2對響應值Y1的影響極顯著(P<0.01),其余項均不顯著。這表明試驗因素對響應值不是簡單的線性關系,同時交互項不顯著,說明任意兩因素間不存在交互作用。
由表5可知,模型P=0.005 7<0.01,說明模型極顯著,失擬項P=0.153 7>0.05,說明失擬度不顯著,說明模型擬合度良好,可以用來對花色苷提取效果進行分析和預測。決定系數R2=0.912 9,說明該模型擬合91.29%的試驗數據;變異系數CV=0.90%,說明本試驗的可靠性高。從表5看出,A2、B2對響應值Y2的影響極顯著,B對響應值Y2的影響顯著,其余項均不顯著。這表明試驗因素對響應值不是簡單的線性關系,同時交互項不顯著,說明任意兩因素間不存在交互作用。
2.4.2 響應曲面分析及優化
通過Design Expert 8.0.5 軟件對各因素之間的交互作用進行響應面分析,繪制響應面曲線及等高線,結果見圖7。
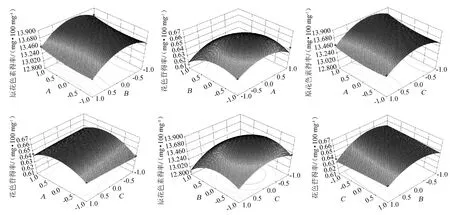
圖7 液料比、乙醇體積分數和提取溫度交互作用對原花色素和花色苷提取效果影響的響應面及等高線Fig.7 Responsive surface plots and contour line of effects of interaction between liquid-material ratio,ethanol concentration and extraction temperature on the extraction efficiency of proanthocyanidins and anthocyanins
由圖7可知,液料比、乙醇體積分數和溫度,任意兩個因素之間的交互作用都不顯著,對原花色素和花色苷得率的影響不大,原因可能是各個因素水平間距不大,原花色素和花色苷得率在所取的水平范圍內變化不顯著。
2.4.3 提取工藝優化結果和驗證
用Design Expert 8.0.5軟件分析試驗數據得到的最佳提取工藝條件為:液料比52.00∶1(mL∶g)、乙醇體積分數47.75%、提取溫度43.91 ℃,此條件下原花色素和花色苷的預測得率分別為13.779 mg/100 mg和0.659 mg/100 mg。考慮到實際操作可行性,選擇液料比52∶1(mL∶g)、乙醇體積分數48%、提取溫度44 ℃,在此條件下檢驗預測結果的可靠性,重復3次提取黑花生衣原花色素和花色苷,得到的原花色素和花色苷得率分別為(13.769±0.015)mg/100 mg、(0.660±0.002)mg/100 mg,與預測值很接近,說明該模型反映出的提取條件可靠,此優化方法可行。
3 結論
本研究在單因素試驗的基礎上,固定pH值為3、提取時間120 min,選取液料比、乙醇體積分數和提取溫度設計響應面試驗,考察各自變量及其交互作用對原花色素得率和花色苷得率的影響。最終優化得到的條件為:液料比52∶1(mL∶g)、乙醇體積分數48%、提取溫度44 ℃。經試驗驗證,該條件下的原花色素和花色苷得率分別為13.769mg/100mg、0.660 mg/100 mg,與模型預測值接近。在優化的工藝條件下,原花色素和花色苷得率較高,減少了資源消耗,提高了提取效率,可為進一步研究黑花生衣原花色素和花色苷提供參考依據。
[1]杜 蕾,李新華.黑、紅花生衣中原花色素的分析[J].食品科學,2014,35(4):190-193.
[2]王 鋒.黑花生衣色素的研究[D].長沙:湖南農業大學博士論文,2007.
[3]XIE D Y,DIXON R A.Proanthocyanidin biosynthesis-still more questions than answers?[J].Phytochemistry,2005,66:2127-2144.
[4]鄧潔紅,譚興和,潘小紅,等.葡萄花色苷研究進展[J].包裝與食品機械,2006,24(6):22-28.
[5]張長貴,董加寶,謝伍容.原花色素抗氧化生物活性研究進展[J].糧食與油脂,2009(6):10-12.
[6]王慶玲,羅小玲,董 娟,等.花生紅衣低聚原花色素抗氧化性的研究[J].中國食品學報,2011,2:91-94.
[7]MA Y Y,KERR W L,SWANSON R B.Peanut skins-fortified peanut butters:Effect of processing on the phenolics content,fibre content and antioxidant activity[J].Food Chem,2014,145:883-891.
[8]ASHA DEVI S,SAGAR CHANDRASEKAR B K,MANJULA K R,et al.Grape seed proanthocyanidin lowers brain oxidative stress in adult and middle-aged rats[J].Exp Gerontol,2011,46(11):958-964.
[9]趙 丹.酒體系中原花青素的聚合轉化及其性質的研究[D].廣州:華南理工大學碩士論文,2013.
[10]杜 蕾,李新華,陳芳芳.黑花生衣色素抗氧化作用的研究[J].食品工業科技,2012,33(13):100-103.
[11]張麗霞.黑莓花色苷降解與輔色及抗氧化活性研究[D].南京:南京農業大學博士論文,2012.
[12]SUN B S,RICARDO-DA-SILVA J M,SPRANGER I.Critical factors of vanillin assay for catechins and proanthocyanidins[J].J Agr Food Chem,1998,46:4267-427.
[13]GINSTI M M,WROLSTAD R E.Anthocyanins,characterization and measurement with UV visible spectroscopy[M].New York:Current protocols in food analytical chemistry,2006.
[14]彭芳剛,李綺麗,吳衛國.響應面法優化紅蓮外皮原花青素的提取工藝研究[J].現代食品科技,2013,29(6):1349-1354.
[15]李大婧,宋江峰,劉春泉,等.超聲波輔助提取黑豆皮色素工藝優化[J].農業工程學報,2009,25(2):273-279.
[16]令 博,王 捷,吳洪斌,等.葡萄皮渣多酚超聲波輔助提取工藝響應面法優化及抗氧化活性研究[J].食品科學,2011,32(18):24-29.
[17]田春蓮,蔣鳳開.茜草總黃酮提取工藝研究[J].食品科學,2011,32(24):60-63.

