無花果內源酵母的篩選及鑒定
鄧星星,江 英*,盧志強,王 璐,陳國剛,王陳強
(石河子大學食品學院,新疆 石河子 832000)
無花果(Ficus caricaLinn)是一種開花植物,隸屬于桑科榕屬,富含黃酮、多糖、超氧化物歧化酶(superoxide dismutase,SOD)等具有防治心血管疾病和老年性癡呆癥的生理活性物質及具有抗癌功效的呋喃香豆素內酯等物質[1-3]。研究表明,無花果不僅具有抗氧化、抗病毒、抗菌的作用,還具有降血糖、降低血膽固醇、抗癌等作用[4-5]。
無花果采后極易軟化、褐變、腐敗,常溫條件下只能保存1~2 d,很難長途運銷[6]。無花果以鮮食和無花果干果為主,較少用于深加工,這就使得無花果產業模式單一,其發展在一定程度上受到制約。而無花果酒作為無花果的深加工產品能很好的解決這一問題。無花果酒在充分利用無花果資源的同時有著自己獨特的保健功能,更適合現代生活[7]。無花果酒的釀造現在市場上多為果酒的釀酒酵母,專用的無花果釀酒酵母很少。果酒的釀酒酵母雖然經過長期的篩選與改良,發酵性能較好,但是可能不太適用無花果酒的發酵,會使酒中甲醇和雜醇油的含量偏高,缺乏無花果特有的風味[8-9]。
新疆是我國無花果主產區之一,其中阿圖什地區的無花果享有盛名,被譽為“無花果之鄉”,目前已經獲得無花果原產地域保護[10]。為了尋找優良的無花果釀酒酵母,篩選無花果自身的內源酵母,本實驗選擇新疆阿圖什的大無花果干為原料,研究了菌株的篩選,菌株的生長特性,菌株的發酵特性以及菌株在酒精和二氧化硫脅迫下,生長特性的變化,最后對菌株進行內轉錄間隔區(internal transcribed spacer,ITS)序列分析。為無花果內源酵母釀造果酒提供一定的理論基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 原料及試劑
新疆阿圖什大無花果果干:購于干果市場;白砂糖(食用級):購于市場;酵母粉、蛋白胨、瓊脂粉:北京奧博星生物技術有限責任公司;葡萄糖、氫氧化鈉、無水乙醇、甘油:天津市致遠化工有限公司;鹽酸:北京化工廠;亞硫酸:北京世紀拓鑫精細化工有限公司;偏重亞硫酸鉀:國藥集團化學試劑有限公司:甲醇(色譜純)、異戊醇(色譜純)、異丁醇(色譜純):天津市光復精細化工研究所;果膠酶:法國LALLEMAND集團;PCR 試劑及DNA Maker:寶生物工程有限公司產品;Goldview DNA 染料:北京賽百盛基因技術有限公司;PCR 引物:上海美吉生物醫藥科技有限公司。
1.1.2 培養基
無花果發酵培養基(20°Bx):無花果干按料液比1∶9(g∶mL)進行打漿,加入0.03%的果膠酶,45 ℃酶解2 h,然后加入白砂糖,調節可溶性固形物含量為20%,121 ℃滅菌15 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培養基:酵母粉10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,121 ℃滅菌20 min。根據發酵和培養要求,調整糖度和pH值。
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)培養基:酵母粉10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,瓊脂粉20 g/L,121 ℃滅菌20 min。
1.2 儀器與設備
SW-CJ-2D 雙人單面潔凈工作臺:蘇州蘇潔凈化設備有限公司;ZXSD-1160 全自動新型生化培養箱:上海智城分析儀器制造有限公司;722可見分光光度計:上海精密科技有限公司;BSA224S電子天平:北京賽多利斯天平有限公司;WYT-32型手持折光儀:福建泉州光學儀器廠;LDZX-40Ⅱ型立式自動電熱壓力蒸汽滅菌器:上海申安醫療器械廠;XSP-4C雙目生物顯微鏡:上海繪統光學儀器廠;BL-206-Ⅱ型高速冷凍離心機:上海安亭科技儀器廠;PowerPac Basic電泳儀、JS680C凝膠成像儀、PTC-0220 PCR儀:美國Bio-Rad公司;MultiNA核酸定量儀:日本島津儀器有限公司。
1.3 試驗方法
1.3.1 無花果內源酵母的初步篩選和富集培養
選取無花果干100 g,放入預先準備好的燒杯中,向燒杯中倒入體積分數為75%的酒精,使整個果實淹沒在酒精中2 min,用滅過菌的濾紙片擦干,然后用無菌水沖洗3遍,無菌濾紙吸干;再用3%次氯酸鈉浸泡2 min,無菌濾紙吸干后,無菌水沖洗4遍。將未使用的無菌水接種作為空白對照,以驗證水的滅菌效果同時避免引入其他雜菌。無花果表面消毒后取最后一次沖洗的無菌水作為對照,以驗證表面消毒效果[11-13]。然后,加入300 mL無菌水打漿,將漿液裝入500 mL的無菌三角瓶中,并添加偏重亞硫酸鉀20 mg于漿液中,用8層干燥的紗布包扎瓶口,于生化培養箱中靜置培養,溫度為30 ℃,至漿液內產生氣泡并能聞到酒香味后停止培養。
在無菌條件下,對發酵液進行不同濃度的梯度稀釋,記錄并編號,選取適宜的稀釋梯度,將其涂布于YPD平板培養基上,并將不同濃度設計3個平行,于30 ℃靜置培養48 h,通過菌落形態及鏡檢觀察,初步確定酵母菌。經過劃線分離純化,挑起單菌落與YEPD試管培養基中進行富集培養。將富集后的酵母菌接入料液比為1∶9(g∶mL)的無花果漿液,通過白砂糖調節可溶性固形物含量為20%,靜置發酵培養7 d。依據國家標準GB/T 15038—2006《葡萄酒、果酒通用分析方法》和GB/T 5009.48—2003《蒸餾酒與配制酒衛生標準的分析方法》,分別測定酒精度、甲醇和雜醇油含量。通過菌落形態及發酵特性對比完成初步篩選。
1.3.2 菌株發酵生長特性對比
pH對酵母菌生長的影響:將初步篩選的酵母菌分別接入pH值為4.0、4.5、5.0、5.5、6.0、6.5的YEPD培養基(8°Bx)中,接種量為1×105CFU/mL,溫度為30 ℃,靜置培養12 h,測定OD600nm[14],考察pH對酵母菌生長的影響。
溫度對酵母菌生長的影響:將初步篩選的酵母菌接入適宜pH的YEPD(8 °Bx)中,接種量為1×105CFU/mL,分別在26 ℃、28 ℃、30 ℃、32 ℃、34 ℃、36 ℃靜置培養12 h,測定OD600nm,考察溫度對酵母菌生長的影響。
接種量對酵母菌的生長的影響:將初步篩選的酵母菌接入適宜pH,適宜溫度的YEPD培養基(8°Bx)中,接種量分別為0.5×105CFU/mL,1.0×105CFU/mL和2.0×105CFU/mL,靜置培養12 h,測定OD600nm,考察接種量對酵母菌生長的影響。
1.3.3 生長曲線的繪制
將初步篩選的酵母菌接入適宜pH的YEPD培養基(8°Bx)中,接種量為1×105CFU/mL,溫度分別為對應的適宜溫度和26 ℃,靜置培養24 h,每隔2 h取樣測定OD600nm,繪制酵母菌的生長曲線。
1.3.4 酵母菌生長耐受性試驗
(1)酵母菌對乙醇及二氧化硫的耐受性測試
采用杜氏管發酵法測定酵母菌對乙醇及二氧化硫的耐受性。通過無菌過濾方式分別加入無水乙醇及偏重亞硫酸鉀,使得YEPD培養基(8°Bx)的乙醇體積分數分別為0、5%、8%、11%、14%、17%,二氧化硫的含量分別為0、60 mg/L、120 mg/L、180 mg/L、240 mg/L、300 mg/L,接入酵母菌,接種量為1×105CFU/mL,pH值為5.0,溫度為30 ℃,靜置培養72 h,觀察杜氏小管中的產生氣泡的情況。
(2)發酵過程中總糖和酒精度的變化
將篩選的菌株接種到YEPD發酵培養基上,調整糖度使得可溶性固形物含量為20%,接種量為1×105CFU/mL,pH值為5.0,溫度為30 ℃,靜置培養,每天測定糖度,并取樣測定酒精度和總糖含量,至糖度到達8%,轉移至15 ℃以下,低溫陳釀15 d。
(3)分子生物學鑒定(ITS序列分析)
將膠模具培養至對數生長期,離心收集酵母菌。使用脫氧核糖核酸(deoxyribonucleic acid,DNA)提取試劑盒提取目的酵母菌的基因組DNA。經1%瓊脂糖凝膠中電泳檢測并確認提取成功后,進行ITS rDNA 基因片段的聚合酶鏈反應(polymerase chain reaction,PCR)擴增[9]。所用通用引物為ITS1(5′TCCGTAGGTGAAC-CTGCGC3′)和ITS4(5′TCCTCCGCTTATTGATAT-GC3′)。PCR 反應條件是:95 ℃預變性5 min,95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,體系運行4個循環,最后72 ℃延伸10 min。PCR 產物用1%瓊脂糖凝膠中電泳檢測,取膠體于UV1 成像系統拍照,測序。將PCR 產物ITS 測序結果輸入美國國家生物技術信息中心(national center for biotechnology information,NCBI)網站的核酸數據庫比對系統,利用Blast 程序進行核酸序列比對分析。用MEGA 5.0 軟件構建系統發育樹,進行親緣關系和系統發育分析。
2 結果與分析
2.1 無花果內源酵母的初步篩選
通過對發酵液的稀釋涂布、分離純化,得到3株生長度比較高的菌株,菌落表面光滑,顏色均一,為乳白色。分離獲得的菌株呈球形,卵圓形或梭形,均符合酵母菌的菌落特征,初步確定為酵母菌,經顯微鏡觀察如圖1所示。然后對這3株酵母菌富集培養,并對富集培養后的菌落形態特征和發酵特性進行研究,結果如表1所示。

圖1 3株分離菌株的菌體形態Fig.1 Cell morphology of three isolated yeast strains
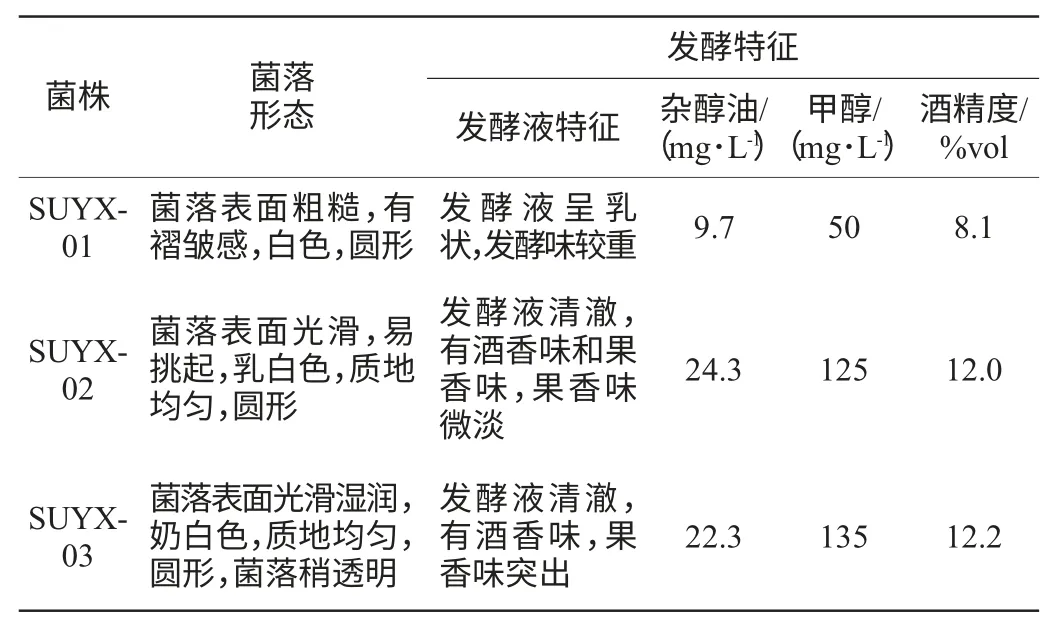
表1 無花果內源酵母的菌落形態和發酵特性Table 1 Colony characteristics and fermentation properties of endogenous yeast from fig fruit
SUYX-02和SUYX-03經純化后,在YPD平板培養基上生長48 h的菌落生長狀況見圖2。由表1、圖2可知,雖然酵母菌SUYX-01的發酵液中甲醇和雜醇油的含量都很低,但是發酵液渾濁,發酵味較重,酒精度明顯偏低,不是優良的發酵菌株。SUYX-02和SUYX-03的發酵液酒精度較高,而且有果香味,雜醇油含量雖然有點高,但在國家標準范圍內,甲醇含量符合國家標準。而且對于成品酒雜醇油的含量可以進行工藝優化來降低。比較而言,SUYX-02和SUYX-03菌株適合無花果酒發酵,因此對其生長特性和發酵特性進行深入研究。
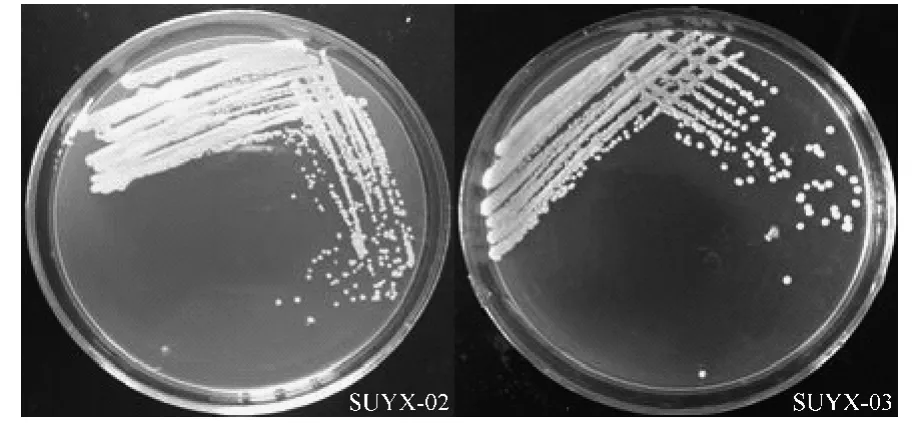
圖2 酵母菌SUYX-02和SUYX-03生長48 h特征Fig.2 The character of strains SUYX-02 and SUYX-03 on YPD medium at 48 h
2.2 酵母菌SUXY-02和SUYX-03生長特性對比
2.2.1 pH對酵母菌生長的影響

圖3 pH對酵母菌生長的影響Fig.3 Effects of p H on yeast growth
由圖3可知,SUYX-02在pH較低和較高時,生長量都較低,在pH為5.0左右時取得較大的生長量時OD600nm為0.59;SUYX-03生長量在pH 4.0~5.5時逐漸增大,在pH為5.5時達到最大值OD600nm為0.61。酵母菌不同,最適合酵母菌生長的pH也有所差異。在本實驗條件下,酵母菌SUYX-02適宜pH值為5.0,SUYX-03的適宜pH值為5.5。
2.2.2 溫度對酵母菌生長的影響
由圖4可知,酵母菌SUYX-02隨著溫度的增加,生長量逐漸增大,在32 ℃取得最大值時OD600nm為0.68,隨后生長量逐漸下降。酵母菌SUYX-03在30 ℃之前生長量隨溫度也是逐漸增加,并在30 ℃取得最大生長量時OD600nm為0.72,且最大生長量比SUYX-02的最大生長量大,30 ℃之后,隨溫度增加酵母菌SUYX-03的生長量迅速下降。在本實驗條件下SUYX-02的最適溫度為32 ℃,SUYX-03的最適溫度為30 ℃。

圖4 溫度對酵母菌生長的影響Fig.4 Effects of temperature on yeast growth
2.2.3 接種量對酵母菌生長的影響

圖5 接種量對酵母菌的生長影響Fig.5 Effects of inoculum on yeast growth
由圖5可知,酵母菌SUYX-02和SUYX-03在自身適宜的溫度和pH生長條件下,隨著接種量的增加生長量也隨之增加。在接種量為0.5×105CFU/mL、1.0×105CFU/mL時,生長量雖都有增加但酵母菌SUYX-03始終比SUYX-02的生長量大,接種量為2.0×105CFU/mL時酵母菌SUYX-02超過SUYX-03的生長量,說明酵母菌SUYX-02生長迅速。接種量過低酵母菌種發酵生長較慢,影響發酵進度;接種量過高酵母菌種發酵生長較快,難以控制發酵進度[9]。對于工業生產,發酵接種量的選擇要依據具體的生產實際情況而定。對于本實驗,為了使得兩株酵母菌的生長量差異較小,選擇1.0×105CFU/mL接種量來進行發酵試驗。
2.3 酵母菌生長曲線的測定
兩株酵母菌的生長曲線見圖6。酵母菌的生長曲線很好的顯示了酵母菌在生長周期內的生長規律,了解酵母菌的生長周期,掌握其最佳生長階段,對于酵母類產品的更好地生產就顯得至關重要[15]。通過對兩株酵母菌的最佳發酵條件下進行生長曲線的測定,能對這兩株菌的生長規律有著更深的了解。

圖6 酵母菌的生長曲線Fig.6 Growth curve of yeast
由圖6可知,對于酵母菌SUYX-03,其對數生長期為4~14 h,此時期酵母菌生長迅速酵母繁殖速度最旺盛,并且出芽率最高,14~24 h為平穩期,在此期菌體產量與營養物質的消耗間呈現出有規律的比例關系,>24 h后進入衰亡期,在此期間由于酵母菌SUYX-02生長迅速,代謝旺盛,二氧化碳迅速生成,在發酵液中產生氣泡,對OD值的測量產生影響;對于酵母菌SUYX-02,其對數生長期為4~14 h,穩定期為14~28 h,>28 h之后進入衰亡期。酵母菌SUYX-03對數期和穩定期有一定的持續時間,使得該酵母菌在生產應用中有利于生產取菌及收集代謝產物。
2.4 酵母菌生長耐受性試驗結果
2.4.1 乙醇耐受性
兩株酵母菌乙醇耐受性結果見表2。由表2可知,當乙醇體積分數為11%時,杜氏小管內有大量的氣泡產生;當乙醇體積分數為14%時,杜氏小管內有極少的氣泡產生,說明酵母菌SUYX-02的最高乙醇耐受性為11%。當乙醇體積分數為14%時,杜氏小管內有大量的氣泡產生;當乙醇體積分數為17%時,杜氏小管內有極少的氣泡產生,說明酵母菌SUYX-03的最高乙醇耐受性為14%。酵母菌SUYX-02的乙醇耐受性偏低,而酵母菌SUYX-03的乙醇耐受性較好,適合一般酒精度的果酒發酵。

表2 酵母菌乙醇耐受性Table 2 Ethanol tolerance of yeast strains
2.4.2 二氧化硫耐受性
兩株酵母菌二氧化硫耐受性結果見表3。由表3可知,當二氧化硫添加量為240 mg/L,杜氏小管內有較多的氣泡產生;當二氧化硫添加量為300 mg/L,杜氏小管內有較少的氣泡產生,因此酵母菌SUYX-02的最高二氧化硫耐受性為240 mg/L。當二氧化硫添加量為300 mg/L,杜氏小管內有較多的氣泡產生;當二氧化硫添加量為360 mg/L,杜氏小管內有較少的氣泡產生,因此酵母菌SUYX-03的最高二氧化硫耐受性為300 mg/L。酵母菌SUYX-03的二氧化硫耐受性較好,符合果酒生產要求。

表3 酵母菌二氧化硫耐受性Table 3 SO2tolerance of yeast
2.5 發酵過程中總糖和酒精度的變化結果分析
通過篩選得到的酵母菌運用到實際中發酵得到果酒,發酵性能的測定是判定酵母菌是否優良的重要依據,是判定酵母菌發酵性能的重要指標。將酵母菌SUYX-03接入無花果發酵培養基(20°Bx),溫度為30 ℃,模擬實際發酵過程,對該菌株的發酵性能進行研究,結果見圖7。

圖7 酵母菌SUYX-03發酵過程中總糖及酒精度的變化Fig.7 Total sugar and alcohol content change in the fermentation broth of strain SUYX-03
由圖7可知,在發酵周期內,隨時間的增加酒精度隨之增加,在第6天時達到最大的酒精度10.9%vol,同時發酵液中的總糖隨之減少最終達至4 g/L左右。在15 ℃此條件下陳釀15 d,糖度降低為2.5 g/L,酒精度為10.5%vol,發酵比較徹底,符合果酒發酵標準,酵母菌SUYX-03可以作為釀酒酵母菌株。
2.6 分子生物學鑒定結果分析
將酵母菌株SUYX-02、SUYX-03進行ITS序列擴增,擴增結果見圖8。由圖8可知,在退火溫度55 ℃條件下,兩酵母擴增片段長度750~100 bp,特異性目的條帶清晰且無雜帶。將獲得酵母菌SUYX-03的ITS 序列,進行BLAST同源比對,結果酵母菌SUYX-03與酵母菌同源性最高,同源性為97%。基于酵母菌ITS序列的相似性而構建系統發育樹見圖9。由圖9可知根據同源性比較該菌釀酒酵母的親緣關系最近。結合形態學結果與發酵特性,菌株SUYX-02、SUYX-03鑒定為釀酒酵母(Saccharomyces cerevisiae)。

圖8 酵母菌ITS序列擴增產物瓊脂糖凝膠電泳圖Fig.8 Agarose gel electrophoretogram of yeast ITS sequences amplifying product

圖9 SUYX-03菌株的ITS rDNA 的系統發育進化樹Fig.9 ITS rDNA phylogenetic tree of strain SUYX-03
3 結論
從口感甘甜、營養豐富的新疆大無花果中經過篩選得到一株優良的酵母菌株SUYX-03,該酵母菌的適宜生長溫度為30 ℃,適宜pH值為5.5,最大酒精耐受性為14%vol,最高二氧化硫耐受性為300 mg/L。從生長曲線上看出其對數生長期為4~14 h,對數期和穩定期時間合適,使得該酵母菌在生產應用中更利于生產取菌及收集代謝產物。在有害物質的生成方面,甲醇和雜醇油生成較少,符合果酒國家生產標準。
通過ITS序列分析,鑒定出菌株SUYX-03屬于酵母屬(Saccharomyce)中的釀酒酵母(Saccharomyces cerevisiae)。由發酵試驗得出該酵母菌是適合無花果果酒制作的優良的釀酒酵母。
[1]朱定和,鐘瑞敏,劉建南.無花果酒釀造工藝的研究[J].食品科技,2003(7):88-90.
[2]王 琳,岳田利.發酵型無花果酒釀造工藝研究[J].中國釀造,2005,24(10):59-62.
[3]余希成,盧 俊,曹為民.水溶性無花果多糖的微波提取技術[J].食品研究與開發,2009,30(9):19-23.
[4]王志國,何 德,金 洪,等.無花果抗癌作用的研究進展[J].現代生物醫學進展,2010,10(11):2183-2186.
[5]JEONG M R,CHA J D,LEE Y E.Antibacterial activity of Korean fig(Ficus caricaL.)against food poisoning bacteria[J].Korean J Soc Food Cookery Sci,2005,21(5):84-93.
[6]姬長新,馬 駿,關文強,等.無花果貯藏保鮮技術[J].保鮮與加工,2007,7(6):53.
[7]張寶善,陳錦屏,楊 莉,等.甲醇和雜醇油在紅棗發酵酒中的變化及其控制研究[J].西北農林科技大學學報:自然科學版,2004,32(4):24-28.
[8]董亞晨,戴憶寧,蔡 瑾,等.無花果內源酵母的篩選、鑒定及發酵性能測試[J].中國食品學報,2014,14(8):240-247.
[9]董用鑫,李 玲,楊文宇,等.氣相色譜法測定石榴葡萄酒中的甲醇和雜醇油[J].中國釀造,2013,32(3):142-145.
[10]馬 駿,孫寶亞,關文強,等.阿圖什無花果貯藏保鮮試驗初報[J].保鮮與加工,2009,12(2):48-50.
[11]王志勇,劉秀娟.植物內生菌分離方法的研究現狀[J].貴州農業科學,2014,42(1):152-155.
[12]常 燕,曹 軍,王兆慧,等.夾竹桃內生菌殺蟲活性研究[J].安徽農業科學,2011(10):202-203.
[13]李振東,陳秀蓉,李 鵬.紫花針茅內生細菌的分離與鑒定[J].草原與草坪,2011(1):8-12.
[14]左 勇,劉利平,鞠 帥,等.無花果果酒酵母的篩選及發酵性能研究[J].現代食品科技,2013,29(6):1293-1296.
[15]王秋菊,許 麗,崔一喆,等.酵母菌生長曲線的測定及不同生長時間麥芽汁糖度的變化[J].獸藥與飼料添加劑,2006,2(1):8-9.

