手術部分肝切除與射頻消融治療多發肝細胞癌預后比較
邱寶安,趙文超,夏念信,譚 勇,安 陽,祝建勇,楊英祥,劉 鵬,吳印濤,王敬晗
海軍總醫院 肝膽外科,北京 100048
手術部分肝切除與射頻消融治療多發肝細胞癌預后比較
邱寶安,趙文超,夏念信,譚 勇,安 陽,祝建勇,楊英祥,劉 鵬,吳印濤,王敬晗
海軍總醫院 肝膽外科,北京 100048
目的比較部分肝切除術及射頻消融術(radiofrequency ablation,RFA)對符合米蘭標準的多發肝癌療效。方法回顧性分析2007年6月- 2013年12在我科接受治療的140例肝功能良好、多發肝癌(符合米蘭標準)的患者資料,其中接受部分肝切除術78例,接受RFA治療62例,分別對術前主要檢查結果、圍術期并發癥發生率、術后第3天肝功能指標及生存結果進行比較。結果手術組術后貧血、腹水及低蛋白血癥的發生率總體上高于RFA組,術后第3天谷丙轉氨酶及谷草轉氨酶水平顯著高于RFA組;1、2、3年生存率手術組分別為80.8%、60.3%、48.7%,RFA組分別為83.9%、48.0%、30.6%。手術組生存率優于RFA組(P=0.037)。1、2、3年無瘤生存率手術組分別為74.4%、47.4%、37.2%,RFA組分別為71.0%、38.7%、21.0%。手術組優于RFA組(P=0.007)。結論符合米蘭標準、肝功能Child-Pugh A級的多發肝癌患者仍可能從外科切除中獲益。
肝細胞癌,多發;米蘭標準;射頻消融,肝切除術
肝細胞癌(hepatocellular carcinoma,HCC)在肝原發惡性腫瘤中比例高達90%[1]。由于起病隱匿,40%的患者確診時已為多發肝癌[2]。傳統觀點認為,多發肝癌已失去了外科手術的機會。根據巴塞羅那指南,A期的多發肝癌患者(病灶數目≥3個,最大病灶直徑≤3 cm,即符合米蘭標準)推薦的治療方法為肝移植或者射頻消融術(radiofrequency ablation,RFA)[3]。
然而,肝移植目前難以作為常規手段應用于臨床[4-5]。射頻消融術雖毀損效果較確切,但對位于突出肝表面的病灶,有可能導致腫瘤破裂出血[6];對于直徑>3 cm的病灶更易出現殘余[7]。
目前,部分肝切除術(surgical resection,SR)仍然是公認最有效的根治性手段。有證據表明,對于肝功能良好的多發肝癌患者,部分肝切除術相比單純介入或支持治療可以顯著改善預后[8-10]。然而,對于手術切除與射頻消融的效果仍有爭議。本研究旨在比較手術及射頻消融對符合米蘭標準的多發肝癌患者的治療效果,以期為優化多發肝癌患者的臨床治療提供依據。
資料和方法
1 資料 回顧性分析2007年6月- 2013年12月在海軍總醫院肝膽外科接受根治性部分肝切除術或者根治性RFA治療的肝功能Child-Pugh A級、符合米蘭標準的140名多發肝癌患者。其中接受根治性部分肝切除術的患者為78名,接受根治性RFA治療患者為62名。術前肝細胞癌診斷標準[8-10]:1)兩種影像學檢查(增強CT和MRI)均提示典型的“快進快出”征象;2)一種影像學檢查提示典型的“快進快出”表現,同時甲胎蛋白>200μg/L。本研究將任何肝內出現的互不相連的病灶定義為多發肝癌[8-9]。切除所有術前及術中可探及的病灶,并且術后病理證實切緣陰性的情況定義為根治性手術[9-10]。毀損所有術前可探及的病灶,術后復查增強CT或MRI未見病灶殘余強化的活性組織定義為根治性的RFA。所有納入患者的治療均符合上述根治性標準。手術組患者均通過手術后石蠟病理切片確診。本研究得到海軍總醫院倫理委員會的批準,所有患者均簽署知情同意書。
2 術前評估 包括血常規、生化、凝血、肝炎病毒、腫瘤標記物、胸部正側位片及心電圖檢查等;必要時行經一步相關檢查排除手術禁忌。術前均有完善的影像學檢查資料(螺旋增強CT或者增強MRI)。
3 手術和RFA方法 部分肝切除術采用雙側肋緣下“人”字形切口以便術中探查。常規行術中超聲掃查,明確病灶的數量、位置。病灶均被局部切除,切緣>1 cm,術中阻斷第一肝門。本組中,57例術中切除2處肝病灶,21例術中切除3處病灶。RFA由我科專門醫師操作。患者取平臥位,局部麻醉+靜脈基礎麻醉。超聲掃查定位并引導,必要時采用多針、多點消融。操作后復查增強CT,病灶呈均勻低密度,動脈期病灶無明確局部強化者表明毀損完全無殘留。本組中,49例術中毀損2處肝病灶,13例術中毀損3處病灶。本研究以圍術期并發癥發生率、術后肝損害情況及遠期生存率作為評價療效的指標。
4 隨訪 所有患者術后每個月復查1次,項目包括血常規、肝功能、AFP及增強CT或MRI。3個月后如無復發,復查間隔時間改為3個月。生存時間從患者手術或者治療算起,至患者死亡或最近一次隨訪時截止;無瘤生存時間從患者手術或者治療算起,至患者確診復發或最近一次隨訪時截止。隨訪終點為2014年5月。如復發,視病情行再次射頻消融或肝動脈插管化療栓塞治療(transcatheter arterial chemoembolization,TACE)。
結 果
1 兩組術前資料比較 兩組間各項檢查結果無統計學差異。見表1。
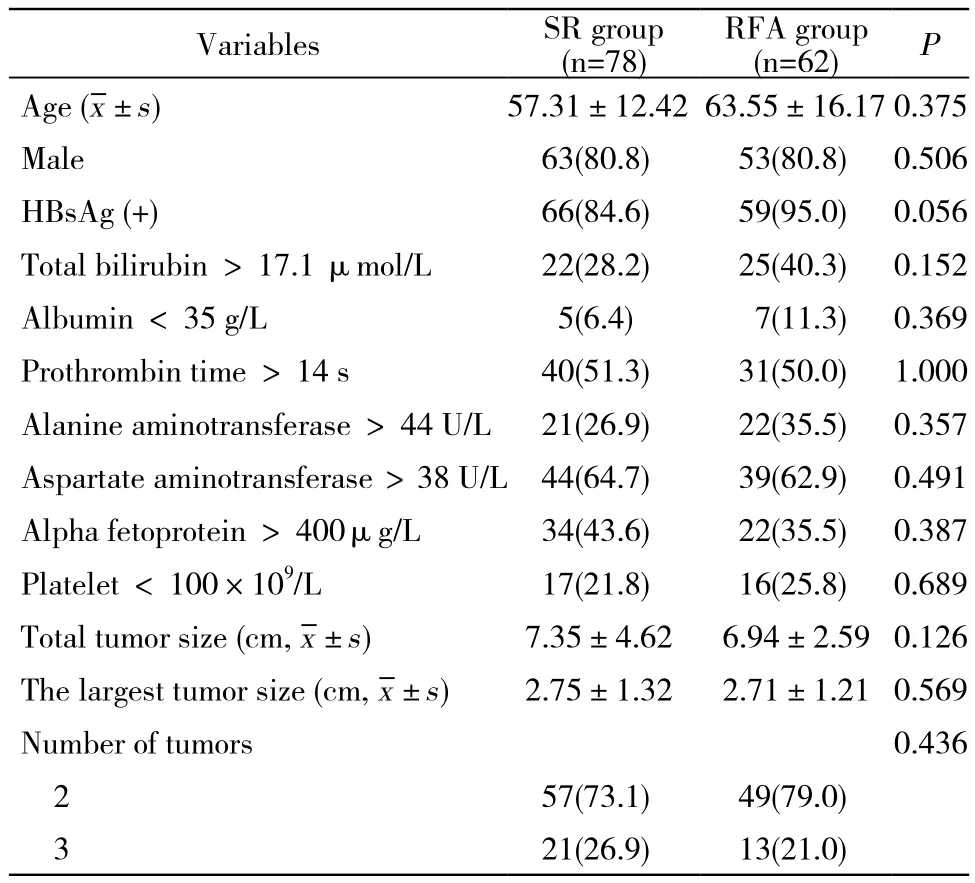
表1 手術組與RFA組多發肝癌患者術前主要指標比較Tab. 1 Comparison of clinical data about patients in SR group and RFA group (n, %)
2 兩組術后并發癥比較 RFA組中等以上程度發熱(體溫>38℃)發生率高于手術組(P=0.049);而腹水(P=0.034)、貧血(P<0.001)及低蛋白血癥(P=0.043)的發生率手術組高于RFA組。提示圍術期安全性RFA組總體上優于手術組。但兩組圍術期均無患者死亡。并發癥發生率見表2。
3 兩組術后第3天肝功指標比較 術后第3天谷丙轉氨酶(P=0.016)及谷草轉氨酶(P=0.043)水平手術組高于RFA組。這一結果表明,RFA對肝的損傷程度總體上小于手術。見表3。
4 兩組生存率比較 手術組16例失訪,失訪率20.5%,中位隨訪時間31(3~76)個月。RFA組12例失訪,失訪率19.3%,中位隨訪時間為28(7 ~75)個月。手術組中位生存時間31(3~76)個月,1、2、3年總生存率分別為80.8%、60.3%、48.7%;中位無瘤生存期為22(6~60)個月,1、2、3年無瘤生存率分別為74.4%、47.4%、37.2%。RFA組中位生存時間為28(7~75)個月,1、2、3年生存率分別為83.9%、48.0%、30.6%;中位無瘤生存期為19(3~63)個月,1、2、3年無瘤生存率分別為71.0%、38.7%、21.0%。手術組生存結果優于RFA組(圖1),而復發率低于RFA組(圖2)。見表4。
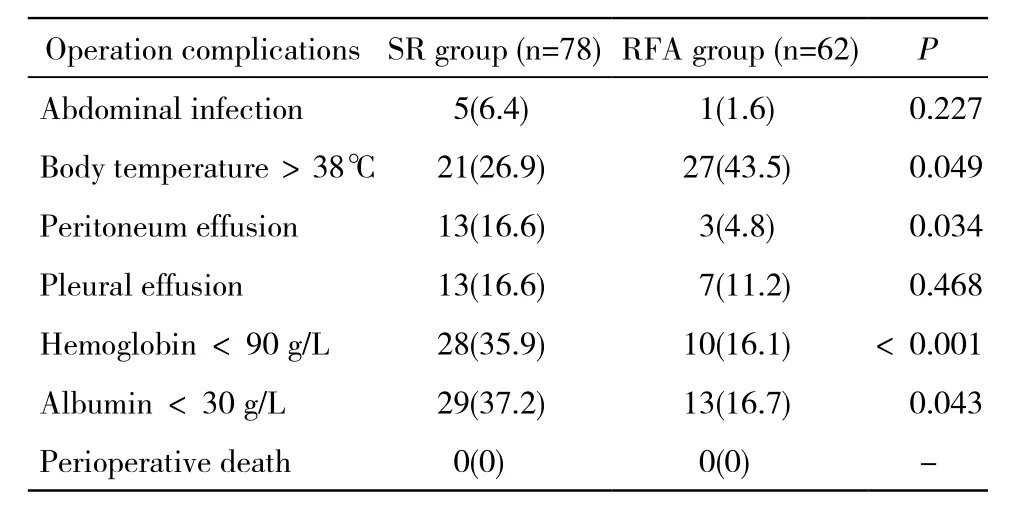
表2 手術組與RFA組術后并發癥發生率Tab. 2 Comparison of morbidities after treatment between SR group and RFA group (n, %)

表3 手術組與RFA組患者術后第3天實驗室檢查結果Tab. 3 Comparison of liver function test on the third day after treatment between SR group and RFA group (n, %)

表4 手術組與RFA組患者術后隨訪結果Tab. 4 Follow-up results of two groups (n, %)
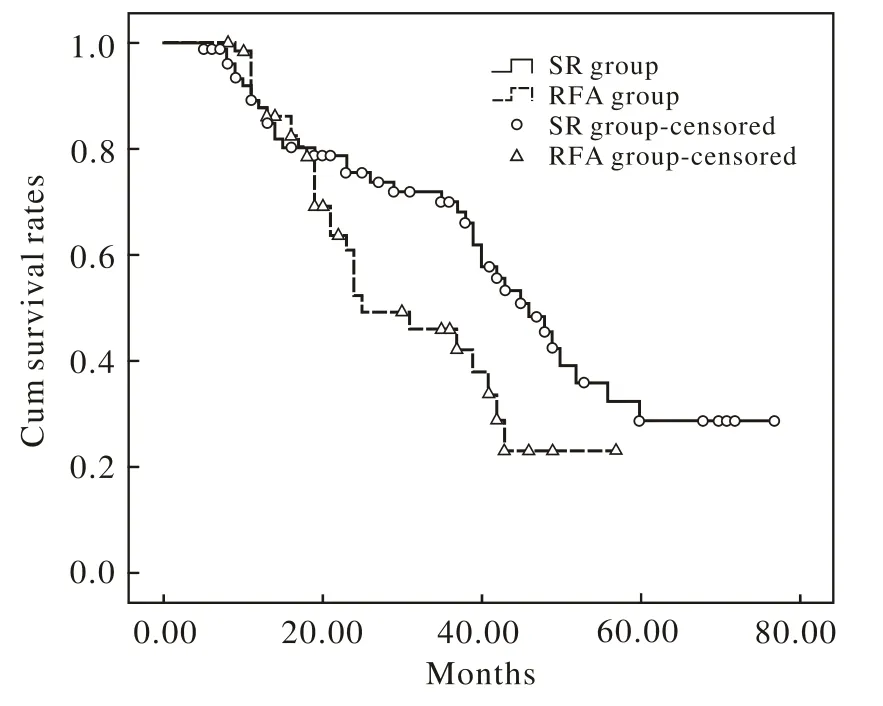
圖 1 手術組與RFA組總生存率比較 (P=0.037)Fig. 1 Survival curves of patients in SR group and RFA group (P=0.037)

圖 2 手術組與RFA組無瘤生存率比較 (P=0.007)Fig. 2 Recurrence-free survival curves of patients in SR group and RFA group (P=0.007)
討 論
由于RFA對肝損傷小、毀損效果較確切,已代替了早期的無水乙醇注射,成為微創毀損的主要手段。本研究結果也表明,RFA圍術期并發癥的發生率及術后肝功能總體上優于手術組。但是相比手術切除,RFA的效果仍然存在一定的差距。首先,RFA受限于病灶的位置,如遇到大部分突出肝表面的外生型腫瘤,有可能導致病灶破裂出血、種植或臨近器官的損傷[6];其次,RFA也受到病灶大小的限制:對于>3 cm的腫瘤容易殘余腫瘤組織。既往有研究發現,當病灶<3 cm時,同一位置殘留率為14%;3~5 cm時殘留率為25%;如果病灶位于血管附近時的殘留率更高達37%[11]。因此,RFA尚不能完全等同于根治性的治療。
對于原發性肝癌,外科切除仍然是最主要的根治性手段。雖然與單發病灶相比,多發病灶往往提示手術切除后復發率高、對肝損傷大、預后差[12]。實際上,近來已有文獻報道,對于這一部分患者手術仍可以顯著改善生存。Zhao等[9]分析了162例術前確診的多發肝癌患者,對于符合米蘭標準的患者3年總生存率可達66%,無瘤生存率可達50%;一項由多中心參與的回顧性分析表明,對于能夠切除的多發肝癌,手術后5年生存率為39%,顯著優于TACE的效果[10,13]。而近期我國的一項隨機對照研究表明,對于超出米蘭標準的多發肝癌,手術切除后3年生存率仍可達到18.1%,顯著優于單純TACE[8]。因此,即便是多發肝癌患者,相比單純的介入或靶向治療,仍可以從手術中獲益。也有研究發現,經歷等待期成功接受肝移植患者中,高分化腫瘤比例顯著高于同期接受手術的患者。有研究發現,從患者決定行肝移植這一時刻開始計算生存期,則手術切除與肝移植效果相似[14-16]。因此,對于多發肝癌的患者,外科切除仍然具有一定優勢。
本研究表明,手術組總生存率優于RFA組,提示在肝功能良好的前提下,手術對這部分患者的效果仍然優于RFA。這一結果與國外研究結果相吻合[17]。可能由于手術中病灶的位置、毗鄰等情況對手術切除效果的影響相對較小,手術更容易完整切除病灶[18]。同時,諸多研究證實,微血管癌栓形成及繼發的肝內播散是術后復發的主要原因[19],手術較RFA可以更有效地移除可能存在播散的肝實質。肝內本組1年生存率,RFA組稍高于手術組,RFA圍術期并發癥的發生率及術后肝損傷程度總體上優于手術組。這表明RFA的安全性相比外科手術有優勢。但是RFA尚不足以影響患者的長期生存結果,也不能完全代替手術。
綜上所述,肝功能良好的前提下,手術切除對于符合米蘭標準多發肝癌的患者是安全有效的。對于這一部分患者,手術切除仍可能是最佳的治療方法。
1 Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2012, 379(9822):1245-1255.
2 Sun Y, Liang BL, Zhang XH, et al. Magnetic resonance imaging manifestation of 500 patients with primary hepatic cell carcinoma[J]. Ai Zheng, 2002, 21(5):509-513.
3 Bruix J, Sherman M. Management of hepatocellular carcinoma: an update[J]. Hepatology, 2011, 53(3): 1020-1022.
4 Freeman RB, Edwards EB, Harper AM. Waiting list removal rates among patients with chronic and malignant liver diseases[J]. Am J Transplant, 2006, 6(6):1416-1421.
5 Chua TC, Saxena A, Chu F, et al. Hepatic resection for transplantable hepatocellular carcinoma for patients within Milan and UCSF criteria[J]. Am J Clin Oncol, 2012, 35(2): 141-145.
6 Llovet JM, Vilana R, Bru C, et al. Increased risk of tumor seeding after percutaneous radiofrequency ablation for single hepatocellular carcinoma[J]. Hepatology, 2001, 33(5): 1124-1129.
7 Mulier S, Ni Y, Jamart J, et al. Local recurrence after hepatic radiofrequency coagulation: multivariate meta-analysis and review of contributing factors[J]. Ann Surg, 2005, 242(2): 158-171.
8 Yin L, Li H, Li AJ, et al. Partial hepatectomy vs. transcatheter arterial chemoembolization for resectable multiple hepatocellular carcinoma beyond Milan criteria: A RCT[J]. J Hepatol, 2014, 61(1): 82-88.
9 Zhao WC, Yang N, Zhu N, et al. Patients with multiple hepatocellular carcinomas within the UCSF criteria have outcomes after curative resection similar to patients within the BCLC early-stage criteria[J]. World J Surg, 2012, 36(8): 1811-1823.
10 Ng KK, Vauthey JN, Pawlik TM, et al. Is hepatic resection for large or multinodular hepatocellular carcinoma justified? Results from a multi-institutional database[J]. Ann Surg Oncol, 2005, 12(5):364-373.
11 Mulier S, Ni Y, Jamart J, et al. Local recurrence after hepatic radiofrequency coagulation: multivariate meta-analysis and review of contributing factors[J]. Ann Surg, 2005, 242(2):158-171.
12 Portolani N, Coniglio A, Ghidoni S, et al. Early and late recurrence after liver resection for hepatocellular carcinoma: prognostic and therapeutic implications[J]. Ann Surg, 2006, 243(2): 229-235.
13 Lin CT, Hsu KF, Chen TW, et al. Comparing hepatic resection and transarterial chemoembolization for Barcelona clinic liver cancer(BCLC) stage B hepatocellular carcinoma: change for treatment of choice?[J]. World J Surg, 2010, 34(9): 2155-2161.
14 Ho MC, Huang GT, Tsang YM, et al. Liver resection improves the survival of patients with multiple hepatocellular carcinomas[J]. Ann Surg Oncol, 2009, 16(4): 848-855.
15 Ishizawa T, Hasegawa K, Aoki T, et al. Neither multiple tumors nor portal hypertension are surgical contraindications for hepatocellular carcinoma[J]. Gastroenterology, 2008, 134(7): 1908-1916.
16 Poon RT, Fan ST, Lo CM, et al. Difference in tumor invasiveness in cirrhotic patients with hepatocellular carcinoma fulfilling the Milan criteria treated by resection and transplantation: impact on long-term survival[J]. Ann Surg, 2007, 245(1):51-58.
17 Yi HM, Zhang W, Ai X, et al. Radiofrequency ablation versus surgical resection for the treatment of hepatocellular carcinoma conforming to the Milan criteria: systemic review and meta-analysis[J]. Int J Clin Exp Med, 2014, 7(10): 3150-3163.
18 Zhao WC, Fan LF, Yang N, et al. Preoperative predictors of microvascular invasion in multinodular hepatocellular carcinoma[J]. Eur J Surg Oncol, 2013, 39(8): 858-864.
19 Lim KC, Chow PK, Allen JC, et al. Microvascular invasion is a better predictor of tumor recurrence and overall survival following surgical resection for hepatocellular carcinoma compared to the Milan criteria[J]. Ann Surg, 2011, 254(1): 108-113.
Effect of hepatic resection vs. radiofrequency ablation on multiple hepatocellular carcinoma
QIU Baoan, ZHAO Wenchao, XIA Nianxin, TAN Yong, AN Yang, ZHU Jianyong, YANG Yingxiang, LIU Peng, WU Yintao, WANG Jinghan
Department of Hepatobiliary Surgery, Navy General Hospital, Beijing 100048, China
ObjectiveTo compare the effect of surgical resection (SR) and radiofrequency ablation (RFA) for multiple HCC within the Milan criteria.MethodsClinical data about 140 patients with well-preserved liver function and multinodular HCC within the Milan criteria who received surgical resection (n=78) or RFA (n=62) as initial treatment were retrospectively analyzed. The postoperative complications, liver function and survival data were analyzed and compared.ResultsThe incidences of seroperitoneum, anemia and hypoproteinemia were significantly higher in SR group than RFA group; The levels of postoperative ALT and AST were higher in SR group on the third day after surgery than RFA group; the 1-, 2-, 3-year overall survival rates were 80.8%, 60.3%, 48.7% respectively in SR group and 83.9%, 48.0%, 30.6% respectively in RFA group (P=0.037); the 1-, 2-, 3-year recurrence-free survival rates were 74.4%, 47.4%, 37.2% respectively in SR group and 71.0%, 38.7%, 21.0% respectively in RFA group (P=0.007).ConclusionFor patients with multiple HCC and Child-pugh A liver function, surgical resection may still be an optimal choice when tumors within Milan criteria.
hepatocellular carcinoma, multiple; Milan criteria; radiofrequency ablation, hepatectomy
R 735.7
A
2095-5227(2015)03-0226-04
10.3969/j.issn.2095-5227.2015.03.008
時間:2015-01-22 10:19
http://www.cnki.net/kcms/detail/11.3275.R.20150122.1019.001.html
2014-12-02
北京市科委“首都市民健康培育”項目(Z141100002114015) Supported by Beijing Public Health Cultivation Project(Z141100002114015)
邱寶安,男,主任醫師,主任。研究方向:肝膽胰疾病的外科治療及肝移植。Email: luckqiu@medmail.com
The first author: QIU Baoan. Email: luckqiu@medmail.com

