載脂蛋白E 對EAE 星形膠質細胞的影響
楊程程,韋俊杰,唐玉蘭,鄭明華,韋云飛
多發性硬化(Multiple Sclerosis,MS)是以中樞神經系統(CNS)慢性炎性脫髓鞘為主要特征的自身免疫性疾病。實驗性自身免疫性腦脊髓炎(experimental autoimmune encephalomyelitis,EAE)是研究MS 常用的動物模型。我們之前的研究發現,載脂蛋白E(apolipoprotein E,apoE)可以減輕EAE 髓鞘和軸突的損傷[1],抑制Th1 和Th17 細胞的免疫應答[2],下調CD4+T 細胞的表達[3],對EAE 小鼠有神經保護作用。水通道蛋白4(aquaporins 4,AQP4)和膠質纖維酸性蛋白(glial fibrillary acdic protein,GFAP)均表達于CNS 星形膠質細胞,與星形膠質細胞水腫、增生有關,但apoE 對EAE 小鼠星形膠質細胞AQP4、GFAP 的表達是否有影響?作用機制如何?目前尚未見相關報道。本研究采用apoE基因敲除的C57BL/6 小鼠及野生型C57BL/6 小鼠建立EAE 模型,對神經功能缺損情況進行評分,觀察大腦、脊髓病理改變及AQP4、GFAP 的表達,從而探索apoE 對EAE 病灶星形膠質細胞的作用及其機制,以期為MS 的治療提供新思路。
1 材料和方法
1.1 材料
1.1.1 實驗動物及分組 標準化飼養的6~8 w 雌性的apoE 基因敲除C57BL/6 小鼠及野生型C57BL/6 小鼠,體重18~20 g,北京華阜康生物科技股份有限公司提供。20 只野生型C57BL/6 小鼠隨機分成普通EAE 組及正常對照組,每組各10 只;10只apoE 基因敲除小鼠作為apoE-/-EAE 組。
1.1.2 主要試劑 髓鞘少突膠質細胞糖蛋白(MOG35-55,純度>95%,上海生工生物工程有限公司);百日咳毒素(PTX)、完全弗氏佐劑(CFA)(Sigma 公司);卡介苗(Difco 公司);兔抗小鼠AQP4 多克隆抗體(武漢博士德有限公司);兔抗小鼠GFAP多克隆抗體、SP 法免疫組化試劑盒、DAB 顯色試劑盒(北京中杉金橋有限公司)。
1.2 方法
1.2.1 制備完全抗原及建立EAE 模型 用0.01 mol/L的磷酸鹽緩沖液將MOG35-55 稀釋成2 mg/ml,與等量含6 mg/ml 卡介苗的CFA 充分混合,全玻璃注射器抽打至呈油包水乳狀,制成完全抗原。普通EAE 組及apoE-/-EAE 組分別于小鼠背部皮下多點注射完全抗原0.2 ml/只,正常對照組以等量生理鹽水代替。免疫當天為0 d,分別于0、2 d給apoE-/-EAE 組及普通EAE 組小鼠腹腔注射PTX0.5 g/次。
1.2.2 神經功能缺損評分 免疫后每天上午由同一人對小鼠進行神經功能缺損評分,測量體重并記錄。采用7 分評分法。0 分:不發病;1 分:尾巴半癱;2 分:尾巴全癱;3 分:步態異常;4 分:后肢輕癱;5 分:后肢重癱;6 分:前肢受累;7 分:瀕死或死亡。
1.2.3 解剖及病理染色 免疫誘導后35 d,麻醉小鼠,經左心室插管灌注生理鹽水,繼以4%多聚甲醛緩沖液灌注。斷頭,分離大腦和脊髓,4%多聚甲醛4℃中固定24 h,逐級予乙醇脫水、二甲苯透明、石蠟包埋,連續切片4 μm,行HE 染色,觀察病理學變化。
1.2.4 免疫組化 取上述蠟塊行4 μm 連續切片,按SP 法免疫組化試劑盒說明書操作,顯微鏡下觀察大腦和脊髓AQP4、GFAP 的表達,陰性對照用PBS 取代一抗。細胞膜或細胞質呈黃色或棕黃色為陽性表達.每只小鼠的大腦和脊髓各取3 張切片,每張切片取互不重復的5 個高倍視野(×200 倍),應用Image-proplus 6.0 軟件測量每個高倍視野的積分光密度值(IOD)和陽性表達面積(area),計算平均積分光密度(IOD/area)。
1.2.5 統計學方法 采用SPSS 16.0 統計軟件分析數據,正態計量資料以±s 表示,非正態計量資料以組中值(M)和95%可信區間(95%CI)表示;兩個獨立樣本均數的比較用成組t 檢驗,多組間均數的比較用單因素方差分析,組間差異用SNK 檢驗(方差齊時)或Games-Howell 檢驗(方差不齊時),以P<0.05為差異有統計學意義。
2 結果
2.1 發病情況 apoE-/-EAE 組和普通EAE 組于免疫后11 d 相繼發病,癥狀隨時間延長而逐漸加重。兩組潛伏期比較無統計學意義(P>0.05)。臨床功能缺損評分峰值apoE-/-EAE 組顯著高于普通EAE 組(P<0.05)(見表1)。正常對照組無小鼠發病,活動度正常。
2.2 HE 染色 apoE-/-EAE 組和普通EAE 組小鼠大腦、脊髓的小血管周圍均發現炎性細胞浸潤,典型者呈“袖套樣”改變,其中apoE-/-EAE 組的上述病理學改變明顯重于普通EAE 組(見圖1)。正常對照組大腦和脊髓未見異常。
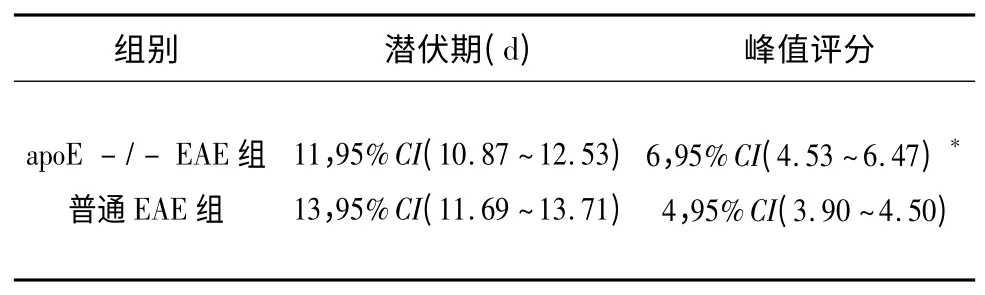
表1 臨床癥狀觀察(M,95%CI)
表2 AQP4 在小鼠大腦、脊髓中的表達(±s)
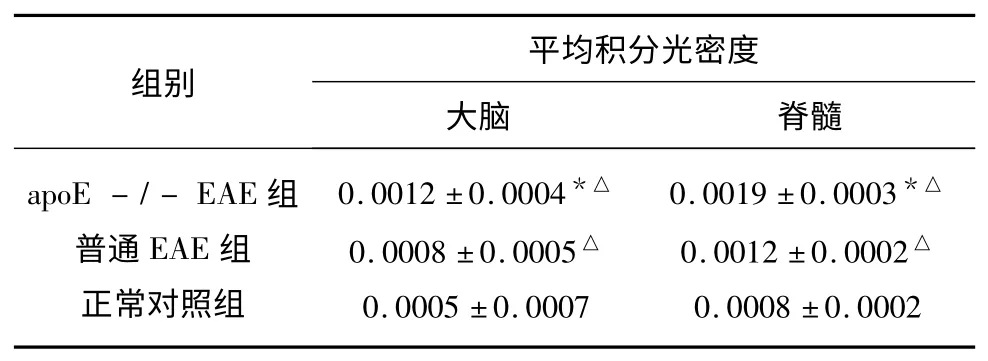
表2 AQP4 在小鼠大腦、脊髓中的表達(±s)
與普通EAE 組比較* P<0.05;與正常對照組比較△P<0.05
表3 GFAP 在小鼠大腦、脊髓中的表達(±s)
與普通EAE 組比較* P<0.05;與正常對照組比較△P<0.05
2.3 各組AQP4 的表達比較 通過免疫組化測定各組織AQP4 的平均積分光密度,發現:apoE-/-EAE 組和普通EAE 組大腦、脊髓中AQP4 的表達量均高于正常對照組,差異均有統計學意義(P<0.05);apoE-/-EAE 組大腦和脊髓AQP4 表達量均高于普通EAE 組,差異均有統計學意義(P<0.05)(見表2、圖2)。
2.4 各組GFAP 的表達比較 通過免疫組化測定各組織GFAP 的平均積分光密度,發現:apoE-/-EAE 組和普通EAE 組大腦、脊髓中GFAP 的表達量均高于正常對照組,差異均有統計學意義(P<0.05);apoE-/-EAE 組大腦和脊髓GFAP 表達量均高于普通EAE 組,差異均有統計學意義(P<0.05)(見表3、圖3)。
3 討論
星形膠質細胞是神經元的衛星細胞,對神經元起支持作用,參與血腦屏障(blood-brain barrier,BBB)的形成。apoE 在CNS 主要由星形膠質細胞合成,主要功能是調節CNS 脂類代謝,此外還可以通過下調中樞神經系統炎癥反應、減輕氧化應激等機制,發揮神經保護作用[4]。Chiasserini 等報道,apoE在MS 患者中有不同程度的下降[5];而且我們前期研究發現,apoE 擬肽可以減輕EAE 的臨床癥狀和炎性浸潤[2]。本研究結果顯示,apoE-/-EAE 組較普通EAE 組神經功能缺損加重,病理檢查可見血管周圍炎性細胞浸潤增多,與國內外報道相符。進一步證明了apoE 缺乏可加重EAE 對小鼠造成的神經功能損害。
AQP4 是水通道蛋白家族的一員,在CNS 表達于星形膠質細胞的足突,主要功能是介導水分子轉運。本研究結果顯示,AQP4 在普通EAE 組的表達較正常對照組顯著增高,與Miyamoto 的報道一致[6],表明EAE 中存在星形膠質細胞水腫。我們還發現,與普通EAE 組相比,apoE-/-EAE 組中AQP4 表達水平顯著升高,提示apoE 缺乏可以加重EAE 星形膠質細胞水腫。AQP4 有介導水跨膜轉運和促進前炎性細胞因子分泌的特性[7],而apoE 缺乏造成了AQP4 的表達升高。因此我們推測,高表達的AQP4 一方面通過正反饋調節,促使更多水分子進入星形膠質細胞,使其體積增大、內壓升高,進而形成細胞毒性水腫,甚至導致星形膠質細胞破裂;另一方面也增強了促炎性細胞因子的分泌。加之apoE 缺乏會增加EAE 小鼠基質金屬蛋白酶-9 活性[8],有可能影響BBB 的功能,這些作用共同加重了EAE 星形膠質細胞的水腫。
GFAP 為星形膠質細胞的骨架蛋白,其表達的高低可反映星形膠質細胞增生及壞死的程度。有研究報道,在MS/EAE 病灶中心和邊緣,有反應性星形膠質細胞聚積[9]。反應性星形膠質細胞在MS/EAE 中發揮雙重作用:雖然它在血管周圍形成瘢痕樣屏障,限制炎癥細胞侵入CNS,但病灶周圍膠質過多,也阻礙了少突膠質細胞遷移至病灶產生新髓鞘;并且小膠質細胞隨之激活,可導致神經細胞二次損傷。可見,膠質細胞過多可惡化EAE 病情。本研究發現,GFAP 在普通EAE 組的表達較正常對照組顯著增高,與國內外報道一致[10],表明EAE 中有星形膠質細胞增生。我們還發現,與普通EAE 組相比,apoE-/-EAE 組GFAP 表達水平更高,提示apoE缺乏加重了EAE 反應性星形膠質細胞增生,增多的星形膠質細胞易形成膠質瘢痕,惡化EAE 病情。研究表明,低密度脂蛋白受體相關蛋白(LDLR-related protein,LRP)作為apoE 的配體之一,表達于星形膠質細胞的細胞膜,與膠質細胞的激活有關[11]。我們推測,apoE 與星形膠質細胞表面的LRP 結合,直接阻礙其星形膠質細胞增生;apoE 也可能影響了細胞因子的分泌,從而間接抑制反應性星形膠質細胞增殖。另外,AQP4 可以加快星形膠質細胞遷移[6]。我們認為apoE 也可能通過減少AQP4 的生成,使質膜的水通透性減弱,從而阻礙星形膠質細胞的遷移,抑制其在病灶周圍聚集形成膠質瘢痕,改善EAE 病情進展。
本研究結果表明,EAE 中存在星形膠質細胞水腫、增生,apoE 缺乏可以加重EAE 星形膠質細胞的水腫和增生,從而惡化EAE 的病情。因此,本研究的發現可能成為MS 治療的切入點。但由于MS 星形膠質細胞水腫和增生的形成機制復雜,尚需進一步研究。

圖2 D:apoE-/-EAE 組大腦;E:普通EAE 組大腦;F:正常對照組大腦;G:apoE-/-EAE 組脊髓;H:普通EAE 組脊髓;I:正常對照組脊髓(AQP4 免疫組化染色,×400)

圖3 J:apoE-/-EAE 組大腦;K:普通EAE 組大腦;L:正常對照組大腦;M:apoE-/-EAE 組脊髓;N:普通EAE 組脊髓;O:正常對照組脊髓(GFAP 免疫組化染色,×400)
[1]韋俊杰,鄭明華,梁培霄,等.載脂蛋白E 擬肽對EAE 小鼠的髓鞘和軸突損傷的影響[J].中風與神經疾病雜志,2012,10(29):872-875.
[2]Wei J,Zheng M,Liang P,et al.Apolipoprotein E and its mimetic peptide suppress Th1 and Th17 responses in experimental autoimmune encephalomyelitis[J].Neurobiol Dis,2013,56:59-65.
[3]鄭明華,唐玉蘭,韋俊杰,等.載脂蛋白E 擬肽對實驗性自身免疫性腦脊髓炎小鼠腦脊髓CD4+、CD8+T 淋巴細胞表達的影響[J].臨床神經病學雜志,2013,26(3):198-201.
[4]Zhang HL,Wu J,Zhu J.The immune-modulatory role of apolipoprotein E with emphasis on multiple sclerosis and experimental autoimmune encephalomyelitis[J].Clin Dev Immunol,2010,2010:186813.
[5]Chiasserini D,Di Filippo M,Candeliere A,et al.CSF proteome analysis in multiple sclerosis patients by two-dimensional electrophoresis[J].Eur J Neuro,2008,15(9):998-1001.
[6]Miyamoto K,Nagaosa N,Motoyama M,et al.Upregulation of water channel aquaporin-4 in experimental autoimmune encephalomyeritis[J].J Neurol Sci,2009,276(1-2):103-107.
[7]Li L,Zhang H,Varrin-Doyer M,et al.Proinflammatory role of aquaporin-4 in autoimmune neuroinflammation[J].FASEB J,2011,25(5):1556-1566.
[8]Zheng M,Wei J,Tang Y,et al.ApoE-Deficient promotes blood-brain barrier disruption in experimental autoimmune encephalomyelitis via alteration of MMP-9[J].J Mol Neurosci,2014,54(2):282-290.
[9]Voskuhl RR,Peterson RS,Song B,et al.Reactive astrocytes form scar-like perivascular barriers to leukocytes during adaptive immune inflammation of the CNS[J].J Neurosci,2009,29(37):11511-11522.
[10]Lavrnja I,Savic D,Bjelobaba I,et al.The effect of ribavirin on reactive astrogliosis in experimental autoimmune encephalomyelitis[J].J Pharmacol Sci,2012,119(3):221-232.
[11]LaDu MJ,Shah JA,Reardon CA,et al.Apolipoprotein E and apolipoprotein E receptors modulate A beta-induced glial neuroinflammatory responses[J].Neurochem Int,2001,39(5-6):427-434.

