梨屬野生種質資源SRAP—PCR反應體系優化研究
梁婷婷 馬燕 臧德奎
摘要:采用正交直觀分析法和新復極差法對影響梨屬野生種質資源SRAP-PCR反應的5種因素(Mg2+濃度、dNTPs濃度、引物濃度、Taq DNA聚合酶、模板DNA)4個水平進行優化篩選。結果表明,優化后的梨屬SRAP-PCR反應體系為25 μL,包括10×PCR buffer 2.5 μL,2.0 mmol/L Mg2+,200 μmol/L dNTPs,0.4 μmol/L引物,1.5 U Taq酶,60 ng模板DNA。
關鍵詞:梨屬;SRAP-PCR;正交直觀分析法;新復極差法
中圖分類號:S661.201文獻標識號:A文章編號:1001-4942(2014)12-0007-04
目前相關序列擴增多態性(Sequence-related amplified polymorphism, SRAP)技術已在多種果樹、蔬菜以及大田作物中得以使用,并以其多態性豐富、簡單、易測序[1]等優點應用于遺傳多樣性分析[2]、遺傳圖譜構建[3]、親緣關系分析、種質資源鑒定以及比較基因組學等諸多研究領域。
正交PCR試驗是基于統計學原理,研究各影響因素不同水平間交互作用的一種方法[4],具有均衡分散和整齊可比的特點,可以簡便、快速地找到反應體系的最佳組合[5]。正交直觀分析法正是基于PCR正交設計試驗的一種結果判斷方法,即根據擴增條帶的明亮度、特異性及數量的多少進行不同的分數判斷,分數越高則表明擴增效果越好。新復極差法(SSR)是方差分析的進一步分析,用于多種因素對某一結果影響的各個因素之間的顯著性分析。
目前基于正交設計法的SRAP-PCR技術已在辣椒、石榴等物種的相關研究中得以應用[6,7]。本試驗采用正交設計法對梨屬野生種質資源SRAP-PCR反應體系進行優化,并通過正交直觀分析法和新復極差法,更直觀快速地找到梨屬SRAP-PCR反應體系的最佳組合,以期為梨屬野生種質資源的開發利用與保護提供基礎技術支持。
1材料與方法
1.1試驗材料
供試材料為秋子梨(Pyrus ussuriensis)、褐梨(Pyrus phaeocarpa)、河北梨(Pyrus hopeiensis)、杜梨(Pyrus betulaefolia)、嶗山梨(Pyrus trilocularis)。4月中旬于山東嶗山、蒙山等地采集用于提取DNA的幼葉樣品,幼葉采集后硅膠干燥保存。
1.2試驗方法
1.2.1試劑和儀器DNA擴增采用Bio-Rad PCR儀,擴增產物經瓊脂糖凝膠電泳后在北京六一WD-9403CS型紫外儀上采集圖像。試驗所用引物由TaKaRa合成;用于PCR反應的Taq DNA聚合酶、Mg2+、dNTPs和Buffer均購自TaKaRa公司。
1.2.2樣品基因組DNA的提取梨屬樣品基因組DNA的提取采用改良的CTAB法[8]。基因組DNA質量的檢測采用瓊脂糖凝膠電泳法和核酸蛋白分析儀。
1.2.3PCR反應體系的正交試驗試驗采用L16(45)正交表設計,對影響擴增結果的5因素進行4水平共16個組合的篩選,各體系模板均為秋子梨樣品,所選引物為隨機Me5/Em11(序列見表3)組合,PCR反應體系總體積設為25 μL,每組合按其濃度計算加樣量,并包含10×PCR buffer 2.5 μL,不足部分用超純水補足。試驗各因素水平見表1,正交試驗設計見表2。
PCR反應擴增程序:94℃預變性5 min;94℃變性1 min,35℃退火1 min,72℃延伸1 min,循環5次;94℃變性1 min,50℃退火1 min,72℃延伸1 min,循環30次;72℃延伸7 min,4℃保存。擴增產物用2%瓊脂糖凝膠電泳分離,20 μL上樣,電壓120 V電泳90 min,電泳緩沖液為1×TAE,經溴化乙錠(EB)染色后,在紫外儀上采集圖像。
PCR擴增結果分析參照何正文等[9]的直觀分析法,即對各組合擴增出來的條帶分別進行分數判定,分數等級設為3、2、1、0分。判定評分后再參照王軍[7]、劉萌芽[11]等的方法,運用新復極差法對試驗數據進行分析。
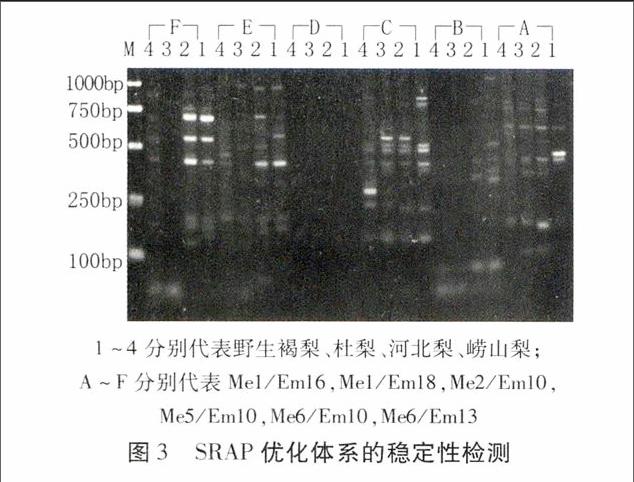
1.2.4體系穩定性檢測隨機選用6對引物組合對褐梨、杜梨、河北梨、嶗山梨 4個野生種進行PCR擴增,經電泳觀察結果。所用引物序列見表3。
2結果與分析
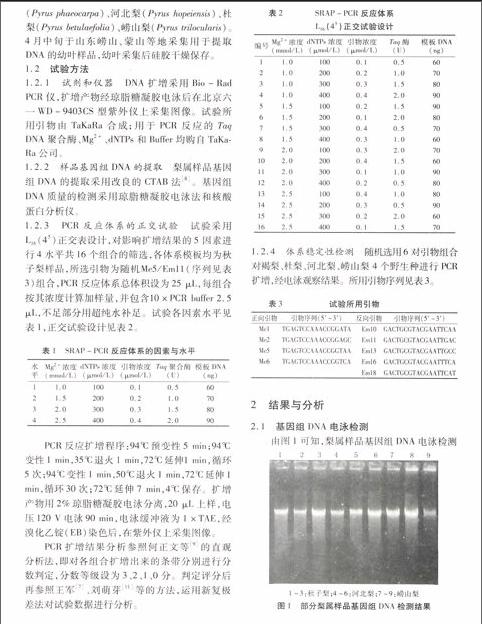
2.1基因組DNA電泳檢測
由圖1可知,梨屬樣品基因組DNA電泳檢測
結果良好,條帶清晰明亮。核酸蛋白分析儀檢測結果顯示,A260/A280值皆在1.80至2.00之間,說明該梨屬樣品基因組DNA提取純度和濃度都較高,符合PCR試驗的要求。
2.2SRAP-PCR反應體系優化結果
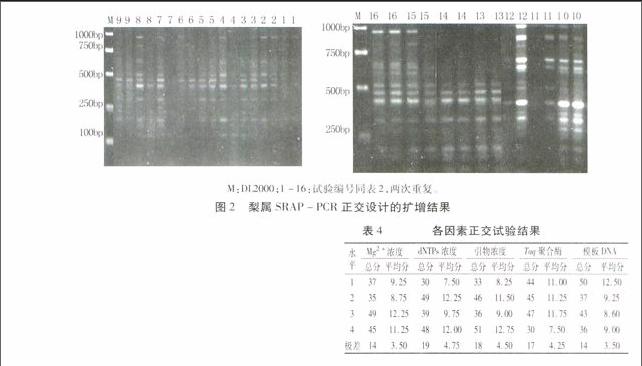
試驗中正交體系的PCR產物電泳結果見圖2。通過新復極差法[10]對圖2中的16個組合(各2次重復)的擴增結果進行分析,最終得到各因素不同濃度水平的總分值、平均分值和極差值,極差分析結果見表4。
2.2.1Mg2+濃度優化分析Mg2+是DNA聚合酶的激活劑。適宜濃度一般在0.5~2.5 mmol/L之間。本試驗中,Mg2+濃度為1.5 mmol/L時,平均分值最低為8.75分;為2.0 mmol/L時,平均分值最高為12.25分。說明梨屬SRAP-PCR反應中Mg2+的適宜濃度為2.0 mmol/L。
2.2.2dNTPs濃度優化分析由表4可以看出,dNTPs濃度為100 μmol/L時,反應產量低,平均分值也低至7.50分;濃度為200 μmol/L時,平均分值達最高值12.25分。說明梨屬SRAP-PCR反應的適宜dNTPs濃度為200 μmol/L。
2.2.3引物濃度優化分析引物濃度為0.1 μmol/L時,產量及平均分值都最低,為8.25分;隨引物濃度增加至0.4 μmol/L時,平均分值達最高12.75分。說明梨屬SRAP-PCR反應的引物適宜濃度為0.4 μmol/L。
2.2.4Taq DNA聚合酶濃度優化分析Taq DNA聚合酶為2.0 U時,平均分值最低,7.50分;為1.5 U時,平均分值最高,11.75;說明1.5 U Taq DNA聚合酶濃度為梨屬SRAP-PCR反應的適宜濃度。
2.2.5模板用量優化分析模板DNA用量為80 ng時,平均分值最低為8.60分,可能影響PCR反應的特異性;當模板DNA用量下降到60 ng時,平均得分增至最高值12.50分。說明梨屬SRAP-PCR反應的模板適宜用量為60 ng。
綜上分析后得到的最佳反應組合為Mg2+濃度為2.0 mmol/L,dNTPs濃度為200 μmol/L,引物濃度為0.4 μmol/L,Taq聚合酶為1.5 U,模板DNA用量為60 ng。此組合即為體系中第10個處理,由圖2可知,該組合擴增結果清晰,條帶明亮、無重疊,適于進行SRAP-PCR試驗。
參照劉萌芽等[11]的方法,分析了本試驗中各因素對SRAP-PCR反應的影響程度。由表4可知,dNTPs濃度的極差值最大,平均分高達4.75,表明dNTPs對梨屬SRAP-PCR反應的影響最為顯著;次之為引物濃度;影響程度居中的因素為Taq DNA聚合酶;Mg2+濃度和模板DNA的影響程度最小。
2.3最優體系的穩定性檢測
采用優化篩選后的SRAP-PCR反應體系結合隨機抽取的6對引物組合(Me1/Em16, Me1/Em18, Me2/Em10, Me5/Em10, Me6/Em10, Me6/Em13)對褐梨、杜梨、河北梨、嶗山梨 4個野生種進行擴增,結果顯示,除第四對引物外,4個梨品種基因組均能擴增出數量不等的條帶(圖3),表明該最優體系可滿足相關試驗的要求,有望為進一步的研究提供基礎。
3結論與討論
目前在梨屬SRAP的相關研究中,張妤艷等[12]對其影響因素進行過篩選,但缺乏對模板DNA濃度的分析;僅董星光等[1]利用正交優化試驗研究過梨SRAP-PCR反應的最適體系。由于PCR擴增的各種不確定性,體系中任何一項細微差異都可能直接影響試驗結果,所以隨著野生種質資源關注度的提高,有必要對梨屬野生種質資源SRAP-PCR體系再優化,以確保資源開發研究的順利進行。
本研究采用正交直觀分析法和新復極差法對梨屬野生種質資源SRAP-PCR反應體系進行了優化。最終得出反應的最優組合為:25 μL的總反應體系中含10×PCR Buffer 2.5 μL,Mg2+ 2.0 mmol/L,dNTPs 200 μmol/L,引物 0.4 μmol/L,Taq 酶1.5 U,模板DNA 60 ng。利用該體系結合隨機抽取的6對引物組合對4份野生梨屬材料進行穩定性驗證,擴增結果穩定。因此本研究獲得的梨屬野生種質資源SRAP-PCR優化體系,可以為今后梨屬野生資源的進一步研究提供一定的應用基礎。
參考文獻:
[1]
董星光, 樊麗,王志剛, 等. 梨SRAP體系的正交優化研究[J]. 江蘇農業科學, 2009(2):51-53.
[2]路娟, 張紹鈴, 劉慶忠, 等. 櫻桃 SRAP-PCR體系優化及其遺傳多樣性分析[J]. 果樹學報, 2009,26(2):163-169.
[3]王強, 張新友, 湯豐收, 等. 基于SRAP分子標記的栽培種花生遺傳連鎖圖譜構建[J]. 中國油料作物學報, 2010,32(3):374-378.
[4]西南農業大學. 蔬菜研究法[M].第2版. 鄭州:河南科學技術出版社,1986:414.
[5]王家保, 劉志媛, 徐碧玉, 等. 用正交設計優化荔枝RAPD反應體系[J]. 武漢植物學研究, 2005,23(4):363-368.
[6]何建文, 楊文鵬, 韓世玉, 等. 辣椒SRAP-PCR反應體系主要影響因素的單因素和正交設計優化[J]. 種子,2009,28(9):24-28,32.
[7]王軍, 楊榮萍, 洪明偉, 等. 石榴SRAP-PCR反應體系的正交設計優化及驗證[J]. 云南農業大學學報, 2013,28(3):376-379.
[8]胡春根, 郝玉, 鄧秀新, 等. RAPD分析用的梨DNA提取方法[J]. 河北農業大學學報,1998,20(4):31-33.
[9]何正文, 劉運生, 陳立華, 等. 正交設計直觀分析法優化PCR條件[J].湖南醫科大學學報,1998,23(4):76-77.
[10]蓋鈞鎰. 試驗統計方法[M]. 北京: 中國農業出版社, 2000:286-287.
[11]劉萌芽, 黃如葵, 黃玉輝, 等. 正交直觀分析法和新復極差法優化苦瓜SRAP反應體系研究[J]. 北方園藝,2014(5):85-88.
[12]張妤艷, 吳俊, 張紹鈴. 梨SRAP-PCR反應體系的建立與優化[J]. 農業生物科技學報, 2007, 15(5):909-910.

