As2O3介導彌漫大B細胞淋巴瘤細胞凋亡的JNK磷酸化機制研究
李穎 張繼磊 程盼盼 張顥
·基礎研究·
As2O3介導彌漫大B細胞淋巴瘤細胞凋亡的JNK磷酸化機制研究
李穎 張繼磊 程盼盼 張顥
目的探討JNK磷酸化在As2O3誘導的彌漫大B細胞淋巴瘤細胞凋亡過程中的參與機制。方法人彌漫大B細胞淋巴瘤細胞株LY1隨機分為5組:對照組、三氧化二砷低劑量、中劑量、高劑量組及JNK阻斷劑SP600125組。對照組和三氧化二砷組細胞給予DMSO或三氧化二砷(1 Μm,5 μM和25 μM)孵育20 h。SP600125組在三氧化二砷(25 μM)孵育的同時加入SP600125(10 μM)孵育。CCK-8測定各組LY1細胞活力情況,qPCR和Western Blot分析各組細胞中細胞凋亡蛋白Bax、Bcl2、Caspase9及JNK和p-JNK蛋白的表達變化情況。結果人彌漫大B細胞淋巴瘤細胞株LY1隨著三氧化二砷作用濃度升高而活力逐漸降低,且各組之間具有顯著的統計學差異性(P<0.01)。qPCR和Western Blot結果顯示三氧化二砷各組細胞凋亡蛋白Bax和Caspase9表達升高,而Bcl2表達降低。同時,三氧化二砷組中p-JNK1/2表達明顯增高。而SP600125組上述異常均得到部分恢復。結論JNK磷酸化過程參與了三氧化二砷誘導的彌漫大B細胞淋巴瘤的細胞凋亡過程。
三氧化二砷;彌漫大B細胞淋巴瘤;LY1;細胞凋亡
(The Practical Journal of Cancer,2015,30:1107~1111)
非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)是臨床上常見的血液惡性腫瘤[1],而彌漫大B細胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是一組在臨床特征、細胞遺傳學及免疫表型方面存在較大異質性的惡性腫瘤[2]。三氧化二砷主要通過誘導腫瘤細胞的凋亡來實現其抗腫瘤作用[3]。Bax/Bcl2是一組與細胞凋亡相關的蛋白。同時,細胞凋亡還與Caspase家族相關。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)介導了多種腫瘤細胞的信號交流過程,與細胞的生長、分化、增殖和凋亡等相關[4]。本文分析細胞凋亡相關蛋白Bax、Bcl2、Capsase3/9及JNK通路在As2O3誘導人DLBCL細胞株LY1細胞凋亡中的參
與機制,為臨床治療及相關新藥開發提供參考。
1 材料與方法
1.1 試劑及儀器
熒光定量PCR儀(ABI 7700),ABI,美國;冷凍高速離心機:Eppendorf,德國;電泳儀轉印槽及PVDF膜,Bio-Rad,美國;CK40顯微鏡,奧林巴斯,日本。
DAB顯色試劑盒購自北京中山生物有限公司;高純總RNA提取試劑盒、TRIzol、氯仿購自BioTek公司,逆轉錄酶M-MLV第一鏈合成系統購自Invitrogen,βactin及目的基因、SYBR Premix Ex TaqTMⅡ購自TaKaRa公司。
1.2 細胞株培養
人彌漫大B細胞淋巴瘤(DLBCL)細胞株LY1由本單位保存。將LY1細胞株于IMDM培養基(含10%胎牛血清)中,在37℃、5%CO2、飽和濕度的細胞培養箱中進行培養。取對數生長期的LY1細胞進行實驗。
1.3 細胞分組及藥物處理
取對數生長期的LY1細胞0.2 ml(1×105/ml)接種至96孔細胞培養板中,As2O3組分別加入As2O3溶液控制其最終濃度為1 Μm、5 μM和25 μM。SP600125組控制As2O3和SP600125的濃度分別為25 μM和10 μM。對照組加入等量的DMSO孵育20 h。
1.4 CCK-8測定細胞活力
向1.3處理后的細胞培養孔中加入10 μL的CCK8(避光),震蕩混勻并放入培養箱中繼續培養4 h,取出細胞培養板于450 nm處測定吸光度。細胞活力(%)=(A處理-A空白)/(A0處理-A空白)× 100。A處理:含細胞、As2O3和CCK8培養孔吸光度; A空白:含培養基和CCK8培養孔的吸光度;A0處理:含細胞和CCK8培養孔的吸光度。
1.5 qPCRmRNA提取及逆轉錄
Real-Time PCR反應條件:95℃熱啟動10 min;94℃變性15 s,60℃退火15 s,72℃延伸30 s,72℃收集熒光,共37個循環。引物序列見表1。
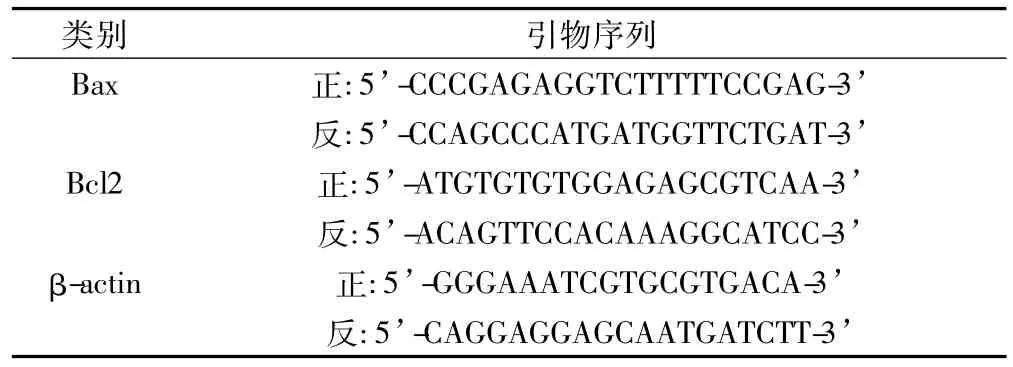
表1 熒光實時定量PCR引物序列
1.6 Western Blot
LY1細胞在冰水浴中用裂解液充分裂解,采用考馬斯亮藍法蛋白定量后以等量蛋白進行SDS-PAGE和半干法轉膜。轉至PVDF膜上后5%脫脂牛奶室溫條件下封閉2 h。然后與一抗4℃溫孵12 h,PBS漂洗3次后與二抗室溫反應1 h。PVDF膜用PBS漂洗后用ECL混合液顯色、曝光、顯影、定影,用凝膠成像分析系統測定光密度,以β-actin作為參照,進行蛋白表達的定量分析。
1.7 統計學處理
應用SPSS 13.0統計軟件對數據進行統計學分析,計量資料用均數±標準差(±s)表示,組間比較采用單因素方差分析。P<0.05為差異具有統計學意義。
2 結果
2.1 As2O3抑制DLBCL細胞株LY1的增殖
結果發現:LY1細胞株的細胞活力隨As2O3濃度的增高而降低,且與對照組相比,具有顯著統計學差異性(P<0.01)。而JNK抑制劑SP600125組細胞活力明顯恢復,與As2O3高劑量組細胞活力比較具有顯著的統計學差異性(P<0.01),見圖1。
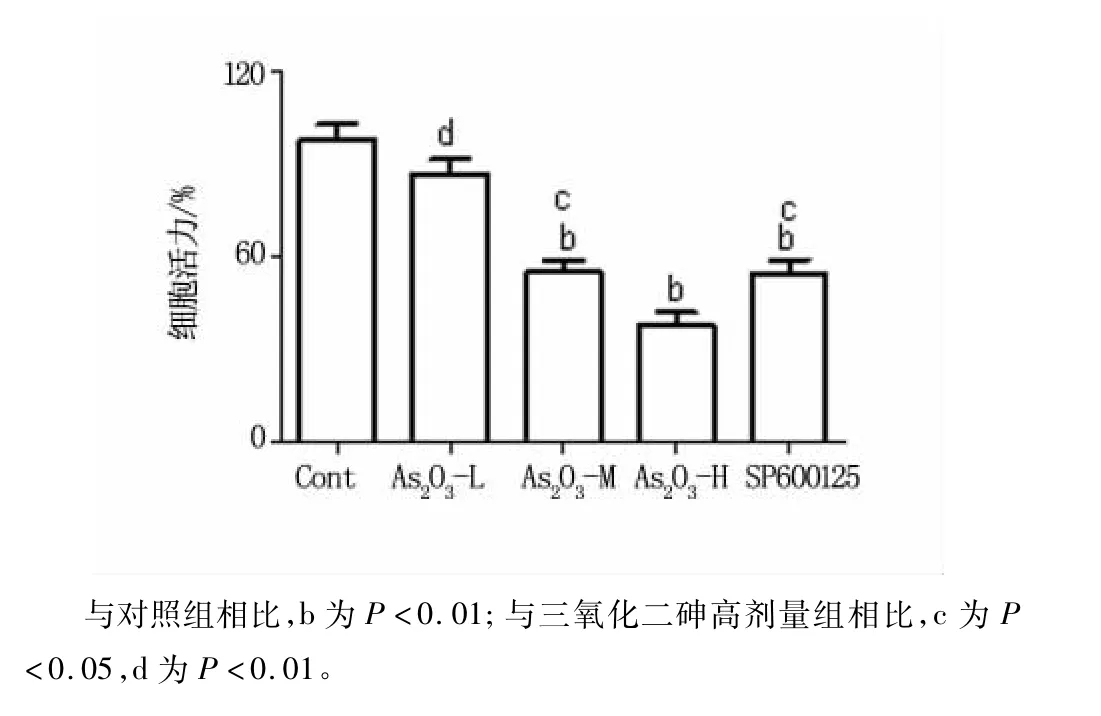
圖1 As2O3及其抑制劑誘導的LY1細胞活力變化
2.2 qPCR檢測細胞凋亡蛋白的表達
qPCR檢測發現,與對照組相比,As2O3組Bax的表達水平均明顯上調,且具有顯著統計學差異性(P<0.01),而抑制凋亡蛋白Bcl2的表達水平明顯降低,也與對照組比較有顯著統計學差異性(P<0.01)。SP600125組的上述2種mRNA的異常表達部分恢復,見圖2。
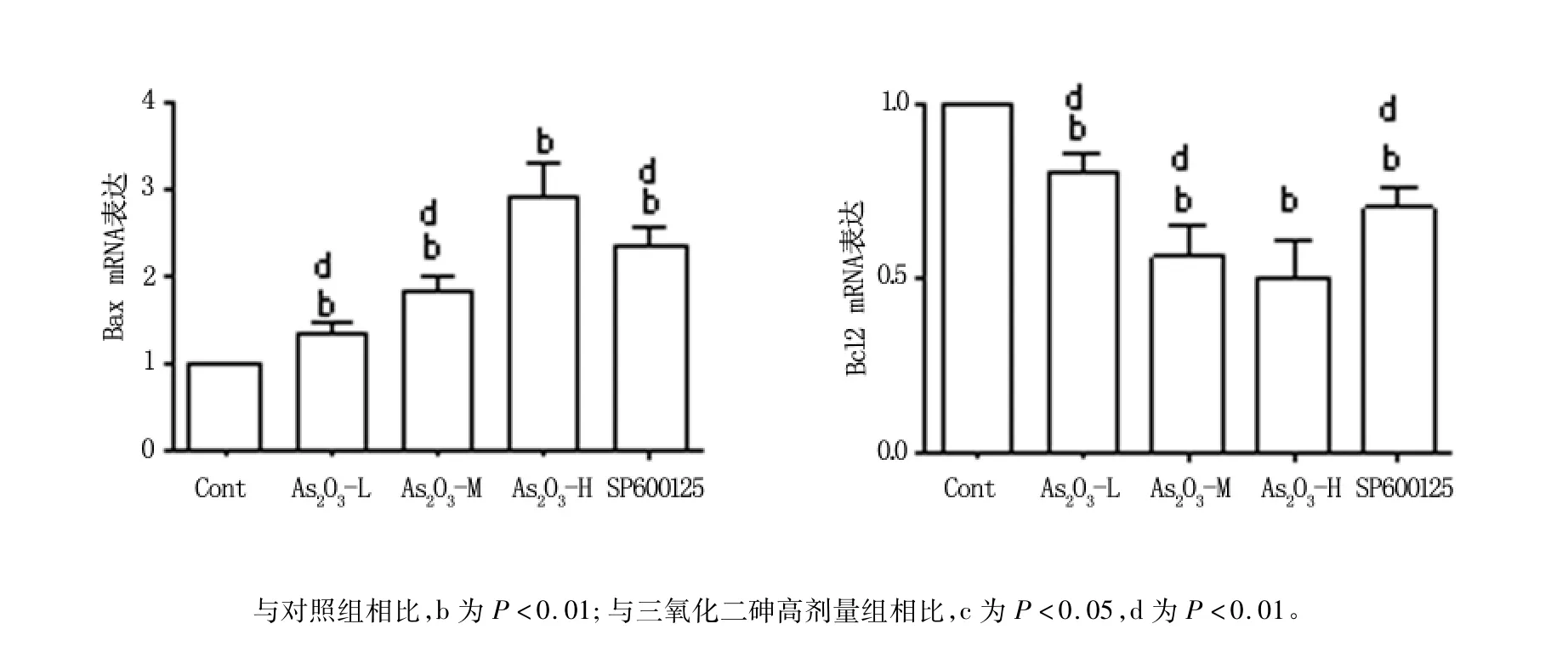
圖2 As2O3及其抑制劑誘導LY1細胞細胞凋亡因子Bax、Bcl2 mRNA表達的變化
2.3 Bax及Bcl2蛋白異常表達
免疫印跡顯示,As2O3組促細胞凋亡蛋白Bax和抑制細胞凋亡蛋白Bcl2的表達變化與mRNA的變化基本一致:與對照組相比,均具有顯著差異(P<0.01),而JNK抑制劑SP600125可以顯著恢復上述靶點的異常表達(P<0.01),見圖3。
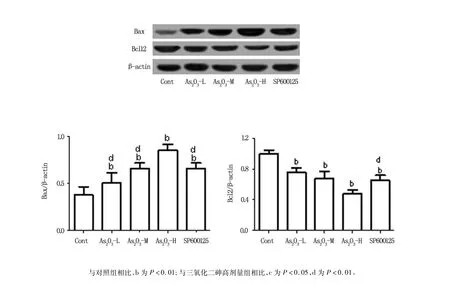
圖3 As2O3及其抑制劑誘導LY1細胞凋亡蛋白Bax和Bcl2表達的變化
2.4 As2O3誘導p-JNK蛋白上調異常表達
免疫印跡結果顯示,As2O3組p-JNK表達水平均較對照組明顯升高(P<0.01),而總JNK的表達量在各組間無顯著差異性(P>0.05),且JNK抑制劑SP600125組比高劑量As2O3組對p-JNK表達的調控作用更明顯,且具有顯著的統計學差異性(P<0.01),見圖4。
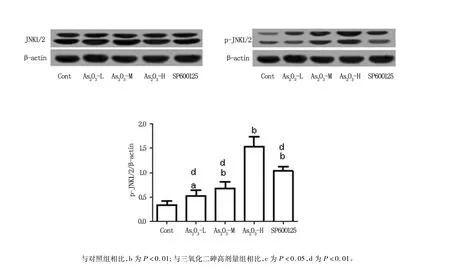
圖4 As2O3及PD600125誘導的LY1細胞JNK及p-JNK表達的變化
2.5 Caspase9蛋白上調表達
免疫印跡結果顯示,As2O3組促細胞凋亡蛋白Caspase9的表達水平均較對照組明顯增高(P<0.01),且JNK抑制劑SP600125組比高劑量As2O3組的Caspase9的調控效果更明顯,且具有顯著的統計學差異性(P<0.01),見圖5。
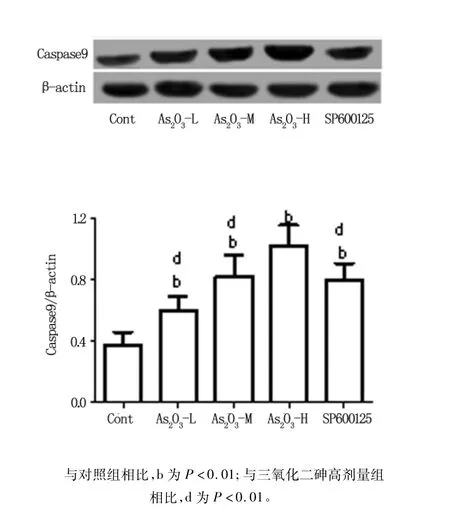
圖5 As2O3及其抑制劑誘導的LY1細胞凋亡蛋白Caspase 9表達的變化
3 討論
非霍奇金淋巴瘤是惡性腫瘤中除霍奇金淋巴瘤以外的腫瘤,主要發生于淋巴結及結外淋巴組織,主要與免疫功能異常密切相關,而彌漫大B細胞淋巴瘤是非霍奇金淋巴瘤的主要種類。本研究通過As2O3與人彌漫大B細胞淋巴瘤LY1細胞株共孵育發現,As2O3可以明顯減弱LY1細胞的細胞活力,且可以明顯增高細胞凋亡蛋白Bax及Caspase9的表達,同時降低抑制凋亡蛋白Bcl2的表達,即As2O3引起了LY1細胞的凋亡過程。同時,As2O3各組中JUN通路關鍵蛋白p-JNK1/2表達明顯增高,表明JNK通路的激活也參與了As2O3誘導的LY1細胞凋亡過程。
細胞凋亡是細胞的1種主動的程序化的細胞死亡過程,主要有外源性和內源性兩種信號通路。細胞凋亡的內源性通路主要與線粒體功能的異常相關:線粒
體除了參與細胞凋亡過程外,還是主要的能量供應細胞器[5]。研究證實,Bcl2家族是定位于線粒體上的與細胞凋亡相關的蛋白。與正常對照組細胞相比,As2O3引起LY1細胞抑制凋亡因子Bcl2蛋白表達的下調,并同時誘導了促細胞凋亡因子Bax蛋白表達的增大,提示As2O3誘導的LY1細胞凋亡主要通過內源性通路,促凋亡蛋白Bax和抑制凋亡蛋白Bcl2參與了該過程。Bax/Bcl2是調控細胞凋亡的最重要的一組調控蛋白。Bcl2蛋白通過調節線粒體膜通道孔的開關、抑制細胞色素C和凋亡誘導因子表達來抑制細胞的凋亡過程。而Bax通常以無活性的狀態存在于細胞質中。當細胞受到凋亡信號時,Bax發生構象的變化,轉移至線粒體膜上,形成同源性二聚體狀態,干擾線粒體膜的完整性,誘導細胞因子的釋放而促進細胞發生凋亡過程。
Capase細胞凋亡家族也與Bax/Bcl2相關:Bax蛋白增多或Bcl2蛋白降低均可誘導Caspase家族蛋白的激活,從而發揮促進細胞凋亡的作用[6]。本研究中As2O3誘導的LY1細胞凋亡過程中Capase3的mRNA及蛋白和Caspase9的蛋白表達均增高,提示Capase家族也參與了細胞凋亡的病理過程。這與本文中發現的Bax表達上調和Bcl2表達下調結論一致。
JNK通路是MAPK通路的重要組分,介導了細胞的增殖、分化、生長和凋亡的過程。本研究中As2O3可以引起彌漫大B細胞淋巴瘤中p-JUN蛋白表達的明顯增高,而總JNK蛋白表達量在各組之間無顯著的統計學差異性,即As2O3引起LY1細胞中JUN通路被激活。在其他類的腫瘤組織中也發現As2O3或其他砷類化合物引起的JNK通路的激活。因此,我們推斷,As2O3引起的細胞凋亡過程是由Bax/Bcl2及Caspase家族引起的,而JNK通路在此過程中起到了關鍵的作用。Caspase蛋白在細胞中主要以酶原的形式存在,而凋亡信號誘導了JUK通路的激活,并進一步促進Caspase酶原的降解,形成了活化形式的Caspase9,并誘導了LY細胞的凋亡過程。
因此,三氧化二砷可以明顯降低彌漫大B淋巴瘤的細胞活力,同時JNK磷酸化過程參與了三氧化二砷誘導的彌漫大B細胞淋巴瘤的細胞凋亡過程。
[1]賈存東,趙兵,古力克孜·吾守爾,等.大劑量BEAC方案聯合自體外周血干細胞移植治療非霍奇金淋巴瘤臨床分析〔J〕.中華腫瘤防治雜志,2013,20(21):1665-1667,1671.
[2]陸錦標,季菊玲,李小秋,等.彌漫大B細胞性淋巴瘤中mTOR信號通路的激活〔J〕.腫瘤防治研究,2012,17 (11):1385-1387.
[3]高克非,馮艷玲,黃永文,等.三氧化二砷聯合塞來昔布對卵巢癌細胞的增殖抑制和凋亡誘導作用〔J〕.腫瘤,2014,9(7):602-608.
[4]傅應亞,韓曉黎,黎友倫.抑制JNK信號通路下調A549中LRP表達可增強順鉑化療敏感性〔J〕.中國腫瘤臨床,2013,21(24):1518-1522.
[5]高曉寧,林季,唐鎖勤,等.三氧化二砷誘導神經母細胞瘤細胞凋亡的線粒體機制〔J〕.中華腫瘤防治雜志,2006,18(23):1769-1772.
[6]姚峰,陳倩,陶琳,等.Caspase-3基因在肺癌中的表達及其與bcl-2和Bax蛋白表達的關系〔J〕.腫瘤防治雜志,2004,3(1):4-6.
The Involvement of JNK Phosphorylation in Diffuse Large-B Cell Lymphoma Apoptosis Mediated by As2O3
LI Ying,ZHANG Jilei,CHENG Panpan,et al.Affiliated Hospital of Jining Medical College,Jining,272000
ObjectiveTo explore the participation of JNK phosphorylation in the apoptosis of diffuse large-B cell lymphoma induced by As2O3.MethodsHuman DLBCL cell line LY1 was divided into the control group,As2O3group and JNK inhibitor SP600125 group.And As2O3group were divided into the low dose,middle dose and high dose group.The control group and As2O3group were incubated with DMSO or As2O3(1 Μm,5 μM and 25 μM)for 20 h.SP600125 cells were incubated with As2O3(25 μM)and SP600125(10 μM).The cellular viability was calculated by CCK-8 and apoptotic proteins Bax、Bcl2、Caspase9,JNK and p-JNK were detected by qPCR and Western Blot.ResultsThe viability of LY1 decreased with the increase of As2O3concentration,there had significant difference(P<0.01).qPCR and Western Blot showed that apoptotic proteins Bax and Caspase9 increased in As2O3group while Bcl2 decreased.p-JNK in As2O3group increased dramatically.SP600125 can alleviate the aforementioned parameters greatly.ConclusionThe apoptosis of LY1 cell line induced by As2O3is regulated by apoptotic proteins that mediated by JNK phosphorylation.
As2O3;Diffuse large-B cell lymphoma;LY1;Apoptosis
10.3969/j.issn.1001-5930.2015.08.001
R733.4
A
1001-5930(2015)08-1107-05
2014-11-05
2015-07-01)
(編輯:吳小紅)
山東省科技廳項目(2012YD18066);濟寧市科技局項目(2012AA2Z3354)
272000山東濟寧醫學院附屬醫院血液科

