/TiO2/膨潤土催化合成胡蘿卜酸乙酯的研究
金 昌 磊
(唐山學院,河北 唐山 063000)
金 昌 磊
(唐山學院,河北 唐山 063000)
采取丙二酸與乙醇為原料,以廉價膨潤土為載體通過共沉淀-浸漬法生成的固體超強酸SO42-/TiO2/膨潤土作為催化劑,催化合成胡蘿卜酸乙酯。分別探究不同醇酸摩爾比、反應時間、帶水劑選擇、帶水劑用量、催化劑用量以及重復性對反應酯化率的影響。結果顯示,當丙二酸用量為0.10 mol,醇酸摩爾比為3:1,催化劑用量為1 g,反應時間為3 h,帶水劑環己烷用量為5 mL時,酯化率可達90.39%,催化劑重復使用6次,催化劑仍具有較高活性。表明該催化劑的催化活性很好,可以被推廣。
/ TiO2/膨潤土;固體超強酸;酯化反應;胡蘿卜酸乙酯
胡蘿卜酸乙酯作為一種重要的有機合成中間體,被廣泛應用于農藥、化妝品、醫藥等工業生產[1,2]。傳統的工業制法是采用氰化鈉法生產,此種方法工序多,總收率低,且使用劇毒氰化物,危害環境,后處理十分麻煩,故有待改進。近年來固體超強酸催化活性較高、與反應體系易于分離、綠色環保等優點引起了人們的興趣[3,4],然而單純以金屬氧化物為載體的固體超強酸生產成本高,影響了工業化的步伐。
1 實驗部分
1.1 主要實驗藥品及儀器
膨潤土(天津市光復精細化工研究所生產):工業級;硫酸鈦、丙二酸(均為天津市光復精細化工研究所生產):分析純;乙醇(天津市致遠化學試劑有限公司生產):分析純;環己烷(天津市永大化學試劑有限公司生產):分析純。
阿貝折光儀:上海光學儀器五廠生產;FTIR-200型傅里葉變換紅外光譜儀:美國Nicolet公司生產。
1.2 實驗原理

1.3 催化劑制備
研磨膨潤土過80目篩備用,量取15 mL 15%~20%的硫酸鈦溶液并用去離子水稀釋到100 mL。加入20 g膨潤土載體攪拌均勻后,加入25%~28%的氨水邊攪拌把pH調至9~10。裝入密閉的容器封口陳化12 h,抽濾。濾餅置于烘箱120 ℃烘干過夜,研磨后過80目篩后并置于燒杯中加入一定量的1 mol/L H2SO4溶液進行飽和浸漬,烘干,烘焙,制得催化劑。
1.4 酯化反應
將一定量的丙二酸、乙醇、帶水劑加入到100 mL三口燒瓶(裝有溫度計、配有回流冷凝管的分水器)里,加入適量的固體超強酸催化劑(SO42-/TiO2/膨潤土)。用電熱套加熱直到有第一滴回流液開始計時,加入帶水劑是為了使生成的水被帶出從而提高酯化率,每過一定時間取樣測量酸值計算酯化率。反應結束后,使三口燒瓶冷卻并經過簡單傾倒分離出固體催化劑,分別用去離子水、10% Na2CO3溶液、去離子水進行洗滌,分液漏斗分離出有機相后加入無水硫酸鎂干燥,過濾,然后分餾并收集餾分(198~199 ℃)。
分餾所得餾分用阿貝折光儀測其折光率;傅里葉變換紅外光譜儀測其結構,使用液膜法,檢測器是DTGS,分辨率為4 cm-1,掃描次數為16。
2 結果與討論
2.1 反應時間對酯化率的影響
乙醇和丙二酸比例為n(醇)/n(酸) =3,丙二酸用量0.1 mol,SO42-/TiO2/膨潤土的用量是1.00 g,帶水劑用量是5 mL,并進行反應回流,研究不同時間的酯化率,可確定相對合理的反應時間,如圖1所示。
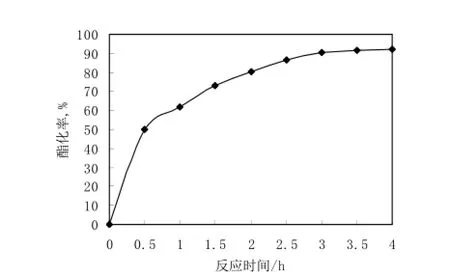
圖1 反應時間對反應酯化率的影響Fig.1 Influence of the time on esterification
由圖1可知,隨著反應時間的延長,合成胡蘿卜酸乙酯的反應酯化率也不斷上升,在前3 h酯化率的增加尤為迅速,也就證明了此時催化劑的活性相對較高,反應速度快。當時間超過3 h后,隨著時間的繼續增加酯化率變化不大。溫度隨著反應時間的變化是不斷地升高的如表1,這時的反應液顏色也是逐漸加深的,也就說明了副產物增多,產物的轉化率下降,因此較適宜的反應時間為3 h。

表1 反應溫度隨反應時間的變化Table 1 The temperature Vs the time
2.2 帶水劑的選擇
在丙二酸用量為0.1 mol,n(醇)/n(酸) =3,膨潤土的用量是1.00 g,帶水劑5 mL的條件下反應3 h,考察了帶水劑種類對反應的影響(見表2)。
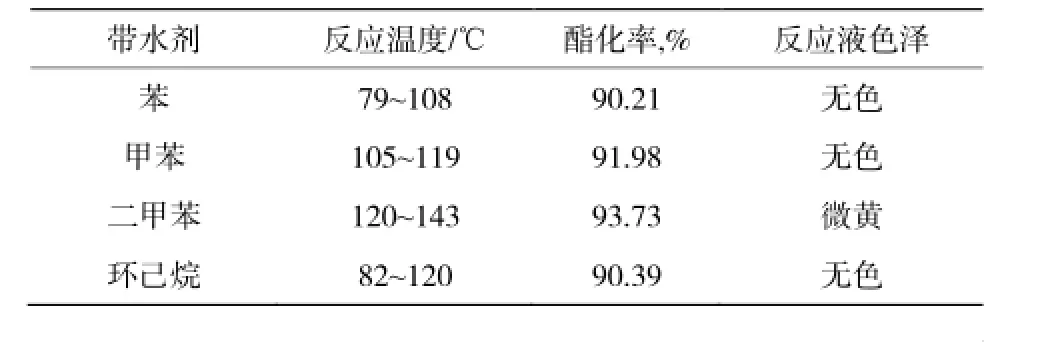
表2 帶水劑種類對反應的影響Table 2 Influence of the kind of water-taking on esterification
由表2得出,經過3h酯化率由低到高:苯<環己烷<甲苯<二甲苯。反應溫度由低到高:苯<環己烷<甲苯<二甲苯。二甲苯作為帶水劑時酯化率最高為93.73%,但反應溫度較高,副反應增多,導致反應液為微黃色。苯、甲苯、環己烷作為帶水劑時,反應酯化率和反應溫度相差不大,但苯和甲苯毒性較大,而環己烷毒性很低,對環境污染小,更有利于工業生產。所以環己烷更適合作為胡蘿卜酸乙酯的帶水劑。
2.3 帶水劑環己烷的用量對酯化率的影響
乙醇與丙二酸的n(醇)/n(酸) =3,超強酸固體催化劑/膨潤土用量為1 g,且反應時間是3 h。環己烷的用量對酯化率的影響如圖2。

圖2 環己烷用量對酯化率的影響Fig.2 Influence of the dosage of cyclohexane on esterification
由圖2可知,并非環己烷的用量越多越好,當環己烷過多時酯化率將會隨著環己烷的增加酯化率變低,當環己烷用量小于5 mL時,這時的帶水劑的用量是遠遠不夠的,導致一部分乙醇起到了帶水劑的作用了,這就使得反應物乙醇的量不足導致反應醇酸比下降。
當環己烷多于5 mL時,由于環己烷用量的過多使得反應體系溫度降低(見表3),導致反應酯化率降低。由圖2可見,當環己烷的用量為5 mL時反應酯化率最高,因此較適宜的環己烷用量為5 mL。
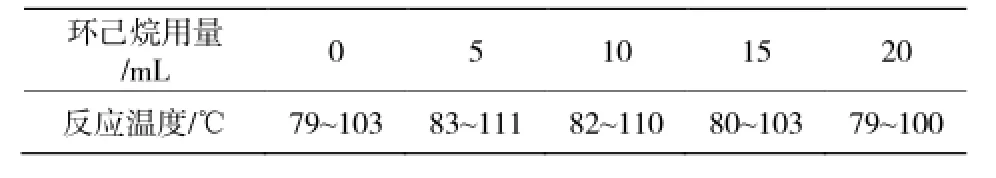
表3 反應溫度隨環己烷用量的變化Table 3 The temperature Vs the dosage of cyclohexane
2.4 醇酸摩爾比對酯化率的影響

圖3 醇酸摩爾對反應酯化率的影響Fig.3 Influence of the molar ratio of propanol to chloroacetic acid on esterification
從反應動力學上醇酸摩爾比的提高加有利于正反應方向進行,提高酯化率。由圖3可知,當醇酸比為3的時候酯的轉化率最高,高于3時酯化率反而下降了,這可能因為乙醇的量過高,會導致乙醇起到了帶水劑的作用使得反應溫度降低(見表4)。醇酸比過大不但浪費了原料也加大了后處理的負荷。因此較適宜的醇酸摩爾比為3。

表4 反應溫度與醇酸摩爾比的關系Table 4 The temperature Vs the molar ratio of propanol to chloroacetic acid
2.5 催化劑用量對酯化率的影響
當丙二酸用量為0.1 mol,n(醇)/n(酸) =3,環己烷用量為5 mL,在回流3 h的情況下,研究不同用量的催化劑對酯化反應的影響(見圖4)。

圖4 催化劑用量對酯化率的影響Fig.4 Influence of the quantity of catalyst on esterification
從圖4得出,該固體超強酸催化劑對胡蘿卜酸乙酯有很好的催化效果,當催化劑用量≤1 g時,隨著催化劑的用量的增加有利于提高反應酯化率;當催化劑用量≥1 g時,反應酯化率隨著催化劑用量的增加變化不大。因此較合理的催化劑用量是1 g。
2.6 催化劑的重復使用
丙二酸的用量為0.1 mol,n(醇)/n(酸) =3,固體超強酸催化劑用量為1 g,環己烷用量為5 mL,反應時間為3 h。在反應結束后回收催化劑,使用環己烷洗滌后用于下次酯化反應,以此類推到第六次實驗,從而測出在相同條件下,重復使用催化劑其催化性能(見表5)。

表5 催化劑重復使用次數對酯化率的影響Table 5 Influence of the reusability of catalyst on esterification
從表5可以得出,當催化劑重復使用時,催化劑的活性幾乎沒有什么變化,在以上的幾次反應中反應體系的顏色為無色,酯化率下降特別小,因此證明了膨潤土擁有非常好的重復使用活性。
2.7 平行試驗
在丙二酸的使用量時0.1 mol,醇酸比n(醇)/n(酸) =3,催化劑的用量是1 g,環己烷的用量是5 mL,反應時間為3 h的情況下,進行多次平行試驗,測量其反應的穩定性(見圖5、表6)。

表6 平行實驗反應溫度Table 6 The temperature of the reaction
從圖5可得,這5次平行試驗3 h的酯化率89.97%~91.12%之間浮動相差不多,誤差很小,是在允許的誤差內的。由表6可知,這幾次反應溫度變化不多。說明了這種固體超強酸催化合成胡蘿卜酸乙酯的反應體系相對穩定。

圖5 反應時間對反應酯化率的影響Fig.5 Influence of the time on esterification
2.8 產物的檢驗
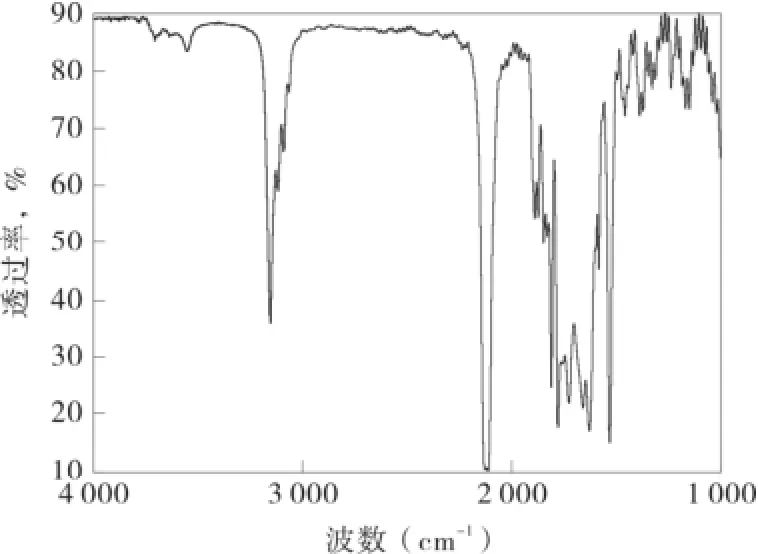
圖6 產物紅外光譜圖Fig.6 FT-IR pattern of the production
產物的紅外光譜如圖6所示,IR,σ:1 739 cm-1時典型的酯羰基伸縮振動吸收峰,2 966 cm-1處是CH3基團的特征吸收峰,1 152 cm-1處為酯類碳氧單鍵的特征振動吸收峰,無羥基吸收峰,故確定產物為目的產物[5]。
3 結 論
本實驗采用的固體超強酸催化劑的制備方法為共沉淀-浸漬法。當丙二酸的用量為0.1 mol,醇酸比n(醇)/n(酸) =3,固體超強酸催化劑的用量為1 g,環己烷的用量是5 mL,反應時間為3 h,酯化率能達到90.39%,且催化劑具備很好的重復使用性。/TiO2/膨潤土制備過程簡單、污染小、催化活性高,前景良好。
[1]Ganapati D. Y, Anup A. K. Selective engineering using Mg–Al calcined hydrotalcite and microwave irradiation in mono-transesterification of diethyl malonate with cyclohexanol[J]. Chemical Engineering Journal,2013, 230: 547-557.
[2]N Thimmaraju, S Z Mohamed Shamshuddin, S R Pratap, et al. Transesterification of diethyl malonate with benzyl alcohol catalyzed by modified zirconia: Kinetic study[J]. Journal of Molecular Catalysis A: Chemical, 2014, 391:55-65.
[3]楊佳,馮紀南,鄧斌.納米稀土復合固體超強酸催化合成胡蘿卜酸乙酯[J]. 寶雞文理學院學報:自然科學版,2013,33(4):26-30.
[4]閆鵬,陳志勝,郭海福.固體超強酸SO42-/SnO2-Al2O3催化合成富馬酸單環己酯[J]. 石油化工,2014,43(1):56-60.
[5]邵景景.丙二酸二乙酯的催化合成及熱力學計算分析[J]. 黑龍江科技學院學報,2008,18(4):272-274.
Study on Synthesis of Malonic Ester WithTiO2/Bentonite
JIN Chang-lei
(Tangshan College, Hebei Tangshan 063000,China)
The solid superacidSO42-/TiO2/bentonite was prepared by co-precipitation impregnation method with low-cost bentonite as carrier. Then malonic ester was synthesized from malonic acid and ethyalcohol with the solid superacid catalyst. The effect of experimental reaction conditions on the esterification rate was studied, such as the molar ratio of acid to isobutyl alcohol, the reaction time, the choice of the water-taking agent, the amount of water-taking agent, the amount of catalyst, reusability of the catalyst. The best reaction conditions were found as follows:the amount of malonic acid acid 0.10 mol, n(alcohol):n(acid)=3:1, the dosage of catalyst 1 g, reaction time 3 h, the dosage of cyclohexane 5 mL. Under above conditions, the yield of esterification could reach 90.39%. The catalyst showed high activity after being reused for six times. The results show that the catalyst SO42-/TiO2/bentonite has good activity, and can be used widely.
bentonite; Solid superacid; Esterification; Malonic ester
TQ 032.41
: A
: 1671-0460(2015)11-2520-04
唐山學院精細化工重點實驗室基金項目,項目號:140080104。
2015-05-07
金昌磊(1979-),男,山東省日照市人,講師,碩士,2008年畢業于遼寧石油化工大學應用化學專業,研究方向:化工基礎研究與教學。E-mail:blue-sky-222@163.com。

