基于人呼吸道上皮細胞炎癥模型的連翹提取物抗炎活性實驗研究
劉建洲,張立偉
山西大學分子科學研究所,太原 030006
連翹[Forsythia suspensa (Thunb.)Vahl.]始載于《神農本草經》,是傳統常用中藥,味苦,微寒,歸肺、心、小腸經。連翹具有清熱解毒、消腫散結、疏散風熱等功效[1],臨床中廣泛用于對呼吸系統炎癥、發熱等病癥的治療[2]。
呼吸道上皮是病原體入侵呼吸系統的首要組織防線,在先天免疫系統中具有重要的作用。急性肺損傷是一種以炎癥和肺毛細血管通透性增加為特征的臨床綜合征[3],此時,呼吸道上皮細胞能夠產生細胞因子、趨化因子及抗菌肽等免疫因子參與炎性反應[4]。革蘭氏陰性桿菌產生的脂多糖(LPS)是導致肺損傷的首要原因[5]。以LPS 為誘導劑介導的細胞炎癥模型已經有相當多的報道,但大多采用巨噬細胞為載體模型[6-9]。根據中醫用藥習慣,連翹針對人上焦肺系統等疾病的治療有較好的效果,因此,本文以呼吸道上皮細胞為研究對象將更有針對性。由于NO 是介導炎癥反應的關鍵因子,在內毒素致機體損傷中起到重要作用[10],動物模型和人體研究[11]都表明,過多的活性氧(ROS)產生可導致呼吸氣道炎癥、高反應性、微血管滲透性過高、組織損傷與重塑等,因此,本文以NO、ROS 為檢測指標,建立人呼吸道上皮細胞(BEAS-2B)炎癥細胞模型,篩選連翹提取物抗炎活性部位,尋找可能的抗炎成分,為連翹抗炎活性的進一步研究提供基礎。
1 材料與方法
1.1 材料
1.1.1 藥材
連翹(青翹),2012 年8 月采于山西省安澤縣杜村鄉東唐村南山,蒸制后晾干儲存,經鑒定為青翹果實。
1.1.2 細胞
BEAS-2B 購自通派(上海)生物科技有限公司。該細胞株是由正常人支氣管上皮細胞NHBE 細胞感染腺病毒12-SV40 雜交病毒,連續傳代篩選而永生化得到。它具有正常人呼吸道上皮細胞的形態和功能,保持上皮細胞的超微結構特征,染色體核型為近二倍體,在傳代過程中保持穩定,該細胞株是體外研究支氣管上皮細胞功能的理想模型[12]。
1.1.3 試劑
改良型RPMI-1640 培養基(HyClone),胎牛血清(FBS,Gibco 公司),胰蛋白酶(0.25%,北京全式金生物技術有限公司),青霉素鏈霉素混合液(100×,Biotopped 公司),脂多糖(LPS,Sigma 公司),四甲基偶氮唑藍(MTT,Biotopped 公司),NO 檢測試劑盒(碧云天生物技術研究所),活性氧(ROS)檢測試劑盒(碧云天生物技術研究所),地塞米松(Dex)與吲哚美辛(Indo)均購自中國食品藥品檢定研究院,二甲基亞砜(DMSO,天津市富宇精細化工有限公司),其余試劑均為國產分析純試劑。
1.1.4 儀器
OHAUS CP114 電子天平(奧豪斯儀器有限公司),TGL-16 冷凍離心機(湖南湘儀),冷凍干燥機(寧波新芝生物科技有限公司),Spectra Max 190 酶標儀(美國Molecular Devices 公司),Galaxy 170S CO2培養箱(New Brunswick 公司),FACSCalibur 流式細胞儀(美國BD 公司)。
1.2 連翹不同提取物(FSE)的制備
1.2.1 連翹乙醇提取物(FSEE)
將青翹粉碎過50 目篩,稱取10 g 粉末,按料液比1∶10 加40%乙醇100 mL,90 ℃水浴加熱回流3 h,趁熱過濾,濾渣再加100 mL 40%乙醇,再次90 ℃水浴加熱回流1 h,趁熱過濾,合并兩次濾液,于旋轉蒸發儀上濃縮至無醇味,凍干,避光密封于干燥器中備用。
1.2.2 60%、90%連翹酯苷A(FTA)
將按1.2.1 法制得的連翹提取液濕法裝柱,以聚酰胺為柱材料,經中壓制備色譜制得含60% FTA的連翹提取物;將該產物進一步分離,以MDS-5 為柱材料,經中壓制備色譜制得含93.60% FTA 的連翹提取物[13]。
1.3 細胞培養
用含10% FBS 的RPMI-1640 培養基(含青霉素100 U/mL,鏈霉素100 μg/mL)于37 ℃、5% CO2培養箱中培養,以0.25%的胰蛋白酶消化細胞傳代,取對數生長期細胞用于實驗。
1.4 BEAS-2B 細胞炎癥模型及實驗分組給藥
取對數生長期細胞,調整細胞密度為2 ×105cells/mL,接種于24 孔細胞培養板(500 μL/孔),37℃、5% CO2條件下培養24 h。采用預防給藥方式,對照組、地塞米松(1 μM)、吲哚美辛(1 μM)、FSEE(25、50、100 μg/mL)、60% FTA(25、50、100 μg/mL)、90% FTA(25、50、100 μg/mL)作用2 h 后,給予終濃度為1 μg/mL[14]的LPS(E.coli,O55∶B5)刺激,培養24 h 后,胰酶消化,1000 rpm 離心收集細胞,PBS 清洗3 次后進行活性氧檢測;收集細胞上清液,-20 ℃儲存備用。
1.5 連翹提取物對BEAS-2B 細胞活力的影響
取對數生長期細胞,調整細胞密度為1 ×105cells/mL,100 μL/孔接種于96 孔細胞培養板,給藥濃度梯度為:0、2、4、8、16、32、64、128、256 μg/mL,同時設空白對照組。MTT 法(5 mg/mL)檢測并計算細胞相對增值率(RGR)。
1.6 細胞形態觀察
呼吸道上皮細胞(BEAS-2B)在FSE 作用24 h后,倒置相差顯微鏡(200 倍)觀察細胞形態并拍照。
1.7 細胞培養液上清中NO 檢測
取1.5 項細胞培養上清,10000 rpm 冷凍離心10 min,按Griess 試劑盒說明書方法檢測上清中NO的含量,檢測波長為540 nm,每組設6 個復孔。
1.8 細胞內ROS 檢測
收集1.5 項細胞,按說明書裝載探針,取一對照孔另設Rosup 組作為產生活性氧的陽性對照,激發波長為488 nm,發射波長為525 nm,流式細胞儀進行檢測。
1.9 統計學處理
采用Origin 8.0 和Excel 2007 對數據進行處理,數據以表示。用SPSS17.0 統計軟件進行統計分析,多組間采用單向方差分析(one-way ANOVA)進行比較,P<0.05 為差異有統計學意義。
2 實驗結果
2.1 不同FSE 對BEAS-2B 細胞的毒性作用
經前期研究發現,在FSE 濃度小于100 μg/mL情況下,隨著時間的延長,其對BEAS-2B 細胞的毒性并不明顯。因此,本實驗選擇24 h 作為檢測FSE對BEAS-2B 細胞毒性作用的監測點。從表1、2、3可以看出,給藥濃度在低于128 μg/mL 時,FSEE、90% FTA、60% FTA 對BEAS-2B 細胞的毒性作用較小;給藥濃度在128~256 μg/mL 時,90% FTA 與60% FTA 表現出對BEAS-2B 細胞的毒性作用。倒置顯微鏡下拍照,60% FTA 組細胞形態如圖1 所示。在濃度達到256 μg/mL 時,細胞數量明顯減少,觸角消失,細胞縮小呈模糊的泡狀。
表1 90% FTA 對BEAS-2B 細胞活力的影響(n=6,)Table 1 Effect of 90%FTA on viability of BEAS-2B cells (n=6,)

表1 90% FTA 對BEAS-2B 細胞活力的影響(n=6,)Table 1 Effect of 90%FTA on viability of BEAS-2B cells (n=6,)
注:與Control 組比較,* P<0.05,#P<0.01。Note:Compared with Control group,* P<0.05,#P<0.01.
表2 60% FTA 對BEAS-2B 細胞的作用(n=6,)Table 2 Effect of 60% FTA on viability of BEAS-2B cells (n=6,)

表2 60% FTA 對BEAS-2B 細胞的作用(n=6,)Table 2 Effect of 60% FTA on viability of BEAS-2B cells (n=6,)

注:與Control 組比較,* P<0.05,#P<0.01。Note:Compared with Control group,* P<0.05,#P<0.01.
表3 FSEE 對BEAS-2B 細胞的作用(n=6,)Table 3 Effect of FSEE on viability of BEAS-2B cells (n=6,)

表3 FSEE 對BEAS-2B 細胞的作用(n=6,)Table 3 Effect of FSEE on viability of BEAS-2B cells (n=6,)
注:與Control 組比較,* P<0.05,#P<0.01。Note:Compared with Control group,* P<0.05,#P<0.01.

圖1 60%FTA 對BEAS-2B 細胞作用的形態觀察結果(10 ×20)Fig.1 Morphological observations of BEAS-2B cells treated with 60% FTA
2.2 吲哚美辛、地塞米松對BEAS-2B 細胞的毒性影響
給藥濃度在62.5~2000 nM 之間,吲哚美辛與地塞米松均未表現出對BEAS-2B 細胞的毒性,后續試驗采用的陽性對照組的給藥濃度為1000 nM。
2.3 BEAS-2B 細胞培養上清液NO 含量檢測
如圖2 所示,1 μg/mL LPS 刺激BEAS-2B 細胞24 h 后,模型組NO 釋放量顯著增加(P<0.01);陽性對照組(吲哚美辛、地塞米松)NO 釋放量均明顯減少(P<0.01);FSE 給藥組也表現出較強的降低NO 釋放的效果,90% FTA 組且存在劑量依賴關系,濃度越高,降低NO 釋放效果愈加明顯。
2.4 BEAS-2B 細胞胞內ROS 含量檢測
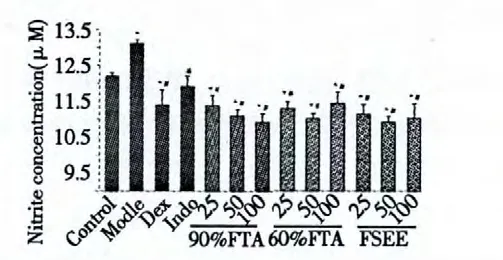
圖2 FSE 對LPS 誘導的BEAS-2B 細胞產生NO 的影響Fig.2 Effect of FSE on NO production from LPS-induced BEAS-2B cells
如圖3 所示,1 μg/mL LPS 刺激BEAS-2B 細胞24 h 后,模型組與Rosup 組ROS 釋放量顯著增加(vs.Control,P<0.01);陽性對照組(吲哚美辛)ROS釋放量明顯減少(vs.Model,P<0.01);FSE 給藥組均表現出較強的降低ROS 含量的作用,90%FTA、60%FTA、FSEE 組隨著濃度的增加,降低細胞內ROS 含量的效果越明顯,有劑量依賴關系。90%FTA 組的降低ROS 含量的效果明顯好于另外兩組,在中、高劑量時,效果與陽性藥相近。

圖3 FSE 對LPS 誘導的BEAS-2B 細胞產生ROS 的影響Fig.3 Effect of FSE on ROS production from LPS-induced BEAS-2B cells
3 討論
連翹有抗菌、抗炎、強心、利尿、鎮吐等藥理作用,是雙黃連口服液、雙黃連粉針劑、清熱解毒口服液等中藥制劑的主要原料。研究發現[15]50%的連翹醇提取物水溶液20 mL/kg 腹腔注射,對大鼠巴豆油性肉芽囊有非常明顯的抗滲出作用及降低炎灶微血管壁脆性作用;復方連翹注射液具有明顯的抗炎作用,能降低大鼠和小鼠毛細血管通透性,減少炎性滲出,對蛋清所致足爪水腫有抑制作用,并能增強小鼠炎性滲出細胞的吞噬能力,從而增強機體的防御機能。
連翹揮發油軟膠囊治療急性上呼吸道感染具有顯著療效[16],而利用體外培養的細胞進行藥物性能的研究是目前各實驗室常用的研究方法之一,因此本實驗采用人呼吸道上皮細胞為研究對象,對連翹用于治療上焦系統的疾病的原因進行探討。本實驗采用MTT 方法首先對不同的連翹提取物進行細胞毒性的研究,高濃度的提取物可致使BEAS-2B 細胞產生細胞病變,觸角逐漸消失,細胞變圓并縮小,細胞呈現模糊的泡狀;低濃度的FSE 反而對該細胞具有一定的“營養維持”作用,低濃度給藥組較正常對照組細胞形態整齊均一,MTT 方法測得60% FTA(128 μg/mL)、FSEE(128 μg/mL)吸光度值顯著大于正常對照組(P<0.01)。也可能是因為當提取物的濃度達到一定程度后,對BEAS-2B 細胞是一種生理刺激,應激反應促使細胞增值以應對這種變化。實驗還發現,連翹酯苷濃度越大,其對細胞的毒性越大。為避免因藥物的濃度太大對實驗結果的影響,因此本實驗的給藥劑量分別設置為25、50、100 μg/mL。
據實驗研究[17],連翹具有拮抗內毒素的作用并可顯著抑制細菌內毒素誘發的炎性因子的過度表達。參與免疫反應,神經遞質傳遞,血管擴張的NO在各組織中的生理濃度是決定其關鍵地位的最主要因素[18]。高濃度的NO 被認為是炎癥反應和內毒素血癥的細胞毒性因子,研究細胞內NO 的水平對研究炎癥反應具有重要的意義。宋宏等[19]通過對BEAS-2B 細胞在臭氧氣液界面暴露后的損傷研究發現,通過給予N-乙酰半胱氨酸藥物保護后,NO 釋放量顯著減少(P<0.05)。本實驗采用LPS 誘導BEAS-2B 細胞產生炎癥,通過對NO 的含量的檢測來尋找連翹提取物可能的抗炎有效部位。
通過我們之前的研究[20]發現,不同連翹提取物對角叉菜膠致大鼠足趾腫脹炎癥模型有較好的治療效果,以90%FTA 效果最佳。與模型組比較,90%FTA 提取物中、高劑量組能極顯著降低血清中TNFα 與IL-2 的水平和提高血清中SOD 的水平。BEAS-2B 細胞炎癥實驗結果顯示,連翹提取物(FSE)具有較好的降低NO 與細胞內ROS 含量的作用,且這種效果存在顯著性差異。90% FTA 的提取物減少NO分泌的效果存在劑量依賴關系,三種提取物都能在一定程度上降低BEAS-2B 細胞內ROS 含量的作用,以90% FTA 的效果最佳,且給藥濃度越高,作用效果越好,呈量效關系。據此兩方面的原因,我們推測連翹有效的抗炎活性成分可能為連翹酯苷A。當然也不排除FSE 中的某種成分針對其它的炎癥模型也具有很好的抗炎活性,關于連翹中抗炎成分還有待進一步的研究,這將對中藥合理用藥,充分發揮藥材的治療效果具有重大的意義。
1 Chinese Pharmacopoeia Commission (國家藥典委員會).Pharmacopoeia of the People’s Republic of China (中華人民共和國藥典).Beijing:China Medical Science Press,2010.Vol I,159-160.
2 Li HB,Chen F.Preparative isolation and purification of phillyrin from the medicinal plant Forsythia suspense by high speed counter current chromatography.J Chromatogr A,2005,1083:102-105.
3 Chopra M,Reuben JS,Sharma AC.Acute lung injury:apoptosis and signaling mechanisms.Exp Biol Med (May-wood),2009,234:361-371.
4 Schutte BC,Mccray PB.[beta]-defensins in lung host defense.Annu Rev Physiol,2002,64:709-748.
5 Tsai KS,Grayson MH.Pulmonary defense mechanisms against pneumonia and sepsis.Curr Opin Pulm Med,2008,14:260-265.
6 Gao Y,Fang L,Qi Y,et al.Shuang-Huang-Lian exerts antiinflammatory and anti-oxidative activities in lipopolysaccharide-stimulated murine alveolar macrophages.Phytomedicine,2014,21:461-469.
7 Wen CL,Chang CC,Kuo CL,et al.Anti-inflammatory effects of methanol extract of Antrodia cinnamomea mycelia both in vitro and in vivo.J Ethnopharmacol,2011,137:575-584.
8 Guan JY,Shen H,Cui DF,et al.Effects of forsythoside on lipopolysaccharide (LPS)-stimulated RAW264.7 macrophages.African J Pharm Pharmacol,2013,1847-1853.
9 Lee JH,Hwang KH,Kim GH.Inhibition of wild herb Rhaponticum uniflorum on synthesis of inflammatory mediators in macrophage cells.Food Sci Biotechnol,2013,22:567-572.
10 Yang F,Contois AS,Fang L.Nitric oxide derived nitrate anion contributes to endotoxic shock and multiple organ injury.Crit Care B,Actin Med,2002,30:650.
11 Sugiura H,Ichinose M.Oxidative and nitrative stress in bronchial asthma.Antioxid Redox Signal,2008,10:785-797.
12 Singer SS,Hagedorn JE,Smith DM,et al.The enzymatic basis for the rat liver 6-hydroxymelatonin sulfotransferase activity.Pineal Res,1995,18:49-55.
13 He WL(何文瓏),Jia JP(賈金萍),Zhang LW(張立偉).Optimization of polyamide medium voltage preparation technology for forsythiaside.Food Eng (食品工程),2014,2:20-22.
14 Schulz C,Farkas L,Pfeifer M,et al.Differences in LPS-induced activation of bronchial epithelial cells (BEAS-2B)and type II-like peumocytes (A-549).Scand J Immunol,2002,56:294-302.
15 Pharmacology group of combine traditional Chinese and western medicine institute (湖北省中西醫結合研究所藥理組).Compound forsythia injection pharmacological action research.XinYiIYaoTongXun (新醫藥通訊),1975,l:66.
16 Xiao HM(肖會敏),Guo QQ(郭倩倩),Wang SW(王四旺),et al.Clinical observation on forsythia volatile oil soft capsule treatment of upper respiratory tract infection.J Tradit Chin Med (中醫藥臨床雜志),2011,23:595-596.
17 Fu Q(傅強),Cui HL(崔華雷),Cui NJ(崔乃杰).Experimental study on inhibitory effect of forsythia extract on inflammatory response induced by endotoxin.Tianjin Med J(天津醫藥),2003,31:161-163.
18 Moncada S,Palmer RM,Higgs EA.Nitric oxide:physiology,pathophysiology,and pharmacology.Pharmacol Rev,1991,43:109-142.
19 Wang KL(王科霖),Guan DB(管東波),Song H(宋宏).Oxidative damage effect in respiratory epithelial cells inducedby exposure to ozone in air-liquid interface.J Environ Health(環境與健康雜志),2011,28:397-400.
20 He WL(何文瓏).Anti-inflammatory activity and metabolomics of Forsythiaside A:A preliminary study.Taiyuan:Shanxi University (山西大學),MSc.2014.

