谷胱甘肽的合成與其活性初步評價
代 濤,李松濤,趙紅玲,王小青,王良友
河北省中藥研究與開發重點實驗室 承德醫學院中藥研究所,承德 067000
谷胱甘肽是廣泛存在于生物細胞內,具有重要生理功能的天然活性肽。其在體內以兩種形態存在,還原型谷胱甘肽(γ-GSH,2)和氧化型谷胱甘肽(GSSG,3),還原型谷胱甘肽由L-谷氨酸、L-半胱氨酸及甘氨酸組成,氧化型谷胱甘肽是由兩分子2 的巰基(-SH)經氧化脫氫得到,其化學結構式見圖1。在機體中大量存在并起主要作用的是還原型谷胱甘肽,但兩者可在酶的作用下相互轉化,有報道3 對2清除自由基有協同作用[1]。現都成為效果較好的藥物。因其較好的抗氧化,清除自由基作用,現已廣泛應用于醫療、保健品、食品工業、化妝品等領域[2-4]。
藥理學研究表明,2 中的巰基(-SH)是發揮抗氧化等作用的活性位點,故將其結構中的γ-谷氨酸替換為α-谷氨酸,得到2 的類似物α-GSH(1),其化學結構式見圖1。動物實驗表明,其也有較好的抗氧化,清除自由基作用。
目前對于2 的制備方法的研究,國內外報道的主要有溶劑提取法、酶合成法、液相合成法、發酵法[5-9]。其中溶劑提取法生產工藝比較落后、生產規模小且產量低,產品質量不高。酶合成法操作較復雜、且需要底物氨基酸和昂貴的ATP,成本高。液相合成法反應步驟多、反應時間長、操作復雜、需光學拆分且產品純度不高,環境污染嚴重。缺點都較明顯,使用較少,目前工業生產以發酵法為主,但因其所得的目標產物含量不高、提取困難、成本造價高、產率不穩定,生產周期長等原因,應用也受到限制。而1 因其不是體內天然產物,發酵法無法直接獲得,合成方法目前報道較少。本研究采用Fmoc 固相多肽合成法,用逐步縮合的方式合成高純度1、2,再將2 經氧化得高純度的3,并研究了三者對四氯化碳(CCl4,4)誘導的小鼠急性肝損傷的治療效果。
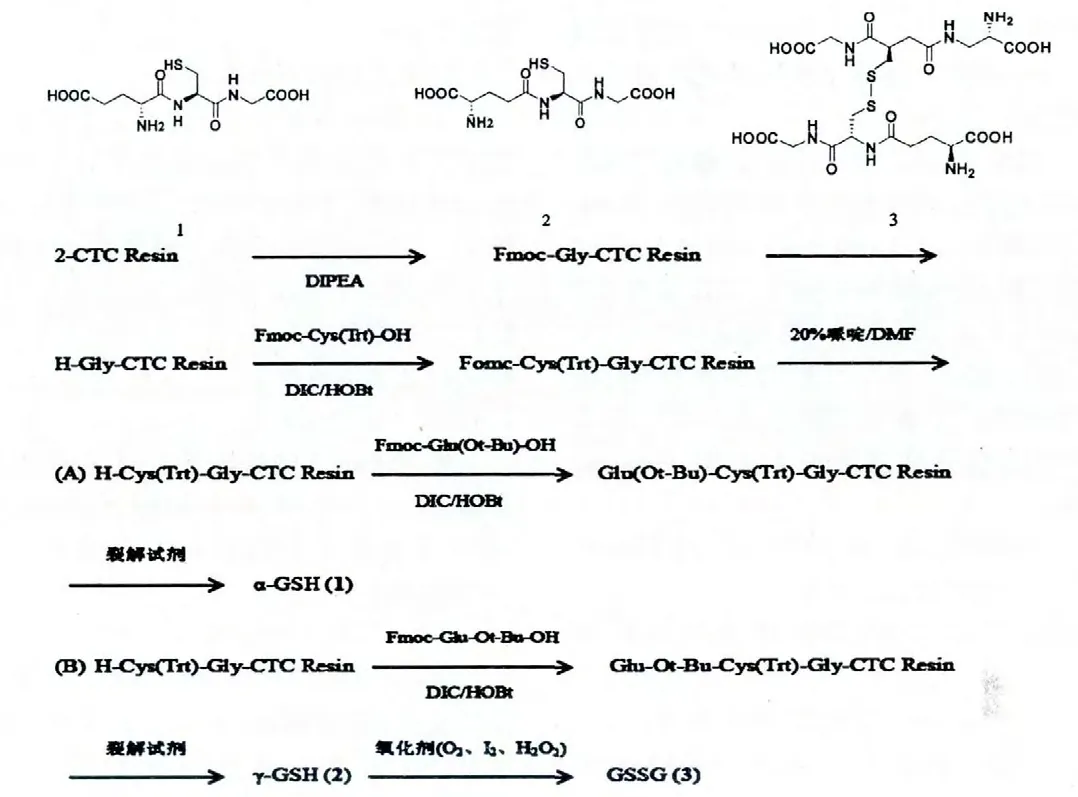
圖1 三種谷胱甘肽化學結構式和合8 成路線圖Fig.1 Structure and synthetic route of 1,2 and 3
1 材料與方法
1.1 儀器與試劑
Agilent Technologies 1200 型高相液相色譜(HPLC,美國Agilent 公司);Newstyle 型反相半制備HPLC(江蘇漢邦科技有限公司);Christ 冷凍干燥機(德國);TDL-40B 型大容量離心機(上海安亭科學儀器廠);Heal Force Easy 20 純水機(香港力康公司);752 型UV 分光光度計(上海光譜儀器有限公司);Agilent Technologies 6310 Ion trap LC/MS(美國Agilent 公司)。
2-氯三苯甲基氯樹脂(2-CTC 樹脂,替代度1.3 mmol/g,天津南開合成科技有限公司);Fmoc 保護的氨基酸有 Fmoc-Gly-OH,Fmoc-Cys (Trt)-OH,Fmoc-Glu-Ot-Bu-OH,Fmoc-Glu (Ot-Bu)-OH 全部購自成都誠諾新技術有限公司;縮合試劑1-羥基苯并三氮唑(HOBt),N,N-二異丙基碳二亞胺(DIC),N,N-二異丙基乙胺(DIPEA)由蘇州天馬醫藥集團有限公司提供;哌啶、甲醇(MeOH)、二氯甲烷(DCM)、N,N-二甲基甲酰胺(DMF)、三氟乙酸(TFA)、苯甲硫醚、乙二硫醇(EDT)、苯甲醚、間甲酚(m-Cresol)、三異丙基硅烷(TIS)、碘(I2)、雙氧水(30%H2O2)、無水乙醇、冰乙酸、碳酸氫鈉,維生素C 均為分析純;乙腈(高效液相色譜純),超純水,4(CCl4,含量99.5%,批號20120722),1、2 對照品(日本TCI 公司,含量>98.0%),3 對照品(上海源聚生物科技有限公司,進口分裝,含量99.0%),注射用還原型谷胱甘肽(2,陽性對照藥,上海復旦復華藥業有限公司,規格0.6 g),ALT、AST 測定試劑盒(南京建成生物工程研究所)。
雄性清潔級昆明小鼠[體重(20 ±2)g,北京華阜康生物科技有限公司,實驗動物生產許可證SCXK(京)2009-0004]。
1.2 還原型谷胱甘肽(1、2)的制備
1.2.1 Fmoc-Gly-CTC Resin 的制備
將3.846 g(5 mmol)2-CTC 樹脂兩份分別投入反應柱a、b 中,DCM 溶脹0.5 h,抽干。DMF 洗滌(50 mL × 5,每次1 min)后,抽干。將4.460 g(15 mmol)Fmoc-Gly-OH、5.239 mL(30 mmol)DIPEA 兩份分別用50 mL DMF 在冰浴下溶解后投入兩反應柱中,氮氣均勻吹拂,30 ℃反應1.5 h,DMF 洗滌(50 mL × 5,每次1 min),除去過量反應原料,制得Fmoc-Gly-CTC 樹脂。兩反應柱中分別加入50 mL MeOH 封閉液(體積比為DCM∶MeOH∶DIPEA=80∶15∶5)封閉兩次,每次10 min,抽干,DMF 洗滌(50 mL × 5,每次1 min),無水MeOH 洗滌(25 mL ×3,每次10 min),減壓干燥至恒重,取少量所得樹脂進行替代度檢測。由替代度測定方法[10],測得Fmoc-Gly-CTC 樹脂替代度分別為0.94 mmol/g,0.93 mmol/g。
1.2.2 Glu(Ot-Bu)-Cys(Trt)-Gly-CTC 與Glu-Ot-Bu-Cys(Trt)-Gly-CTC 樹脂的制備
將5.400 g(5 mmol)制備好的Fmoc-Gly-CTC 樹脂兩份分別加入到反應柱a、b 中,用DCM 溶脹0.5 h,抽干。加入30 mL 20%的哌啶/DMF 溶液,N2均勻吹拂反應15 min,脫除Fmoc 基團,用DMF 洗滌(50 mL × 3,每次1 min),抽干,茚三酮檢測陽性。將8.786 g (15 mmol)Fmoc-Cys(Trt)-OH、2.432 g(18 mmol)HOBt、2.787 mL(18 mmol)DIC 兩份分別用DMF 在冰浴下溶解,預反應10 min 后,投入兩反應柱中,N2吹拂,30 ℃反應2 h 后取少量樹脂洗滌后滴加茚檢液,檢測陰性,反應完全。DMF 洗滌(50 mL × 5,每次1 min),除去多余的氨基酸等。再按照谷胱甘肽的氨基酸序列,用上述方法分別偶聯Fmoc-Glu(Ot-Bu)-OH 與Fmoc-Glu-Ot-Bu-OH。
1.2.3 Glu-Ot-Bu-Cys(Trt)-Gly-CTC 樹脂的裂解
分別將1.36 g 干燥至恒重的Glu(Ot-Bu)-Cys(Trt)-Gly-CTC 與Glu-Ot-Bu-Cys(Trt)-Gly-CTC 樹脂置于兩圓底燒瓶中,冰浴攪拌下分別加入13.6 mL經冷凍的TFA-EDT-m-Cresol(體積比為95∶4∶1)裂解液,反應0.5 h 后,逐漸升至室溫,于室溫下繼續反應1.5 h。經粗過濾后將母液傾入120 mL 無水冰乙醚中,析出白色沉淀,4000 rpm 離心5 min,棄去上清液,重復5 次,減壓真空干燥至恒重,得粗肽分別為266、289 mg。
1.2.4 1、2 粗品的HPLC 鑒定分析
1、2 粗品進行HPLC 分析,色譜柱為Innoval C18柱(250 mm × 4.6 mm,5 μm);流動相為0.1%TFA/H2O(A),0.1% TFA/5% H2O/CH3CN(B),B相1%~21%,梯度洗脫20 min,流速為0.8 mL/min,檢測波長為215 nm,樣品濃度為1 mg/mL,進樣量5 μL。
1.2.5 1、2 純品的制備
分別稱取干燥至恒重的1、2 粗品各200 mg 分別溶于5 mL 超純水中,用反相半制備HPLC 分離純化,半制備柱Hedera ODS-2 反相硅膠柱(250 mm ×10 mm,10 μm)。收集主峰純度達99%的組分。冷凍干燥,得1、2 純品130 mg、136 mg。
1.3 3 的制備
1.3.1 3 粗品的制備
1.3.1.1 空氣氧化法
將100 mg 2 純品溶于5 mL 超純水中,用飽和碳酸氫鈉水溶液調pH 6,混勻,恒溫搖動(30 ℃),HPLC 監測反應進程,反應72 h 達終點,冰乙酸調pH 3 以終止反應。
1.3.1.2 雙氧水氧化法
將100 mg 2 純品溶于1 mL 超純水中,用飽和碳酸氫鈉水溶液調pH 6,加入0.2 mL、30%的過氧化氫溶液,混勻,恒溫搖動(30 ℃),HPLC 監測反應進程,30 min 達到反應終點,冰乙酸調pH 3 以終止反應。
1.3.1.3 碘氧化法
將100 mg 2 純品溶于1 mL 超純水中,加入2.758 mL、20 mg/mL 碘的乙醇溶液,使得碘與2 的摩爾比為1∶1.5,混勻,恒溫搖動(30 ℃),HPLC 監測反應進程,10 min 達到反應終點,飽和維生素C水溶液除去過量的碘以終止反應。
1.3.2 3 純品的制備
將1.3.1.3 所得溶液注入反相半制備HPLC中,半制備柱Hedera ODS-2 反相硅膠柱(250 mm ×10 mm,5 μm)。分段收集,合并主峰純度達98%的組分,減壓真空干燥,得3 91.8 mg。取少量干燥至恒重的3 進行HPLC 分析,分析條件同1.2.4。
1.4 1、2 與3 純品的ESI-MS 分析
分別取1、2 與3 純品各1 mg 分別溶于1 mL 超純水中,加少許乙腈,進樣5 μL,ESI-MS 分析。
離子阱質譜儀離子源:ESI;電離模式:正/負離子模式;質量掃描范圍:m/z 50~1500 amu;毛細管電壓:-130.2 V。
1.5 三種谷胱甘肽保肝活性研究
將112 只雄性昆明小鼠隨機分為14 組,每組8只,分別作為正常對照組、4(0.1%)致肝損傷模型組,注射用2 對照組(20、40、80 mg/kg),肝損傷+合成1 組(20、40、80 mg/kg),肝損傷+合成2 組(20、40、80 mg/kg),肝損傷+合成3 組(20、40、80 mg/kg)。用生理鹽水將購買的注射用2、合成化合物1(α-GSH)、合成化合物2(γ-GSH)、合成化合物3(GSSG)分別配得濃度為0.2%、0.4%、0.8%的溶液,4 配成0.1%的花生油稀溶液。正常組和4 肝損傷模型組以10 mL/kg 劑量連續7 d 腹腔注射生理鹽水,其余12 組則以腹腔注射給予等劑量的相應藥物。第7 d 給藥后,除正常組外各組按20 mL/kg 劑量腹腔注射給予0.1% 4 溶液,動物禁食24 h 后摘眼球取血600~800 μL,現制備血清并測定ALT 和AST 活性[11,12]。對試驗數據進行統計學處理,各組間的比較采用兩樣本均數的t 檢驗。
2 結果與討論
2.1 目標產物1、2、3 的表征與圖譜
還原型谷胱甘肽1(α-GSH):白色固體,總收率60%,粗品保留時間5.254 min,純品保留時間5.252 min,ESI-MS m/z:306.5[M-H]-,見圖2、圖3、圖5。
還原型谷胱甘肽2(γ-GSH):白色固體,總收率64%,粗品保留時間5.443 min,純品保留時間5.394 min,ESI-MS m/z:307.3[M-H]+,見圖2、圖3、圖5。
氧化型谷胱甘肽3(GSSG):白色固體,總收率57%,純品保留時間7.964 min,ESI-MS m/z:611.7[M-H]-,見圖4、圖5。
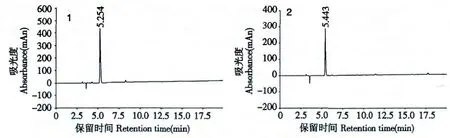
圖2 1、2 粗品的HPLC 色譜圖Fig.2 HPLC chromatograms of 1 and 2 before purification
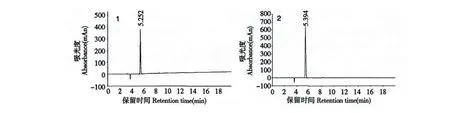
圖3 1、2 純品的HPLC 色譜圖Fig.3 HPLC chromatograms of 1 and 2 after purification
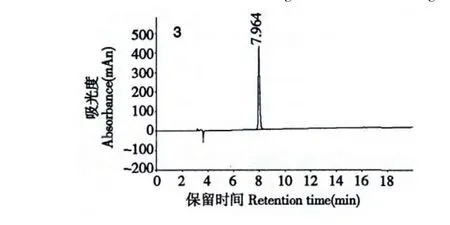
圖4 3 純品HPLC 色譜圖Fig.4 HPLC chromatogram of pureified 3
2.2 合成條件的優化
本研究采用Fmoc 固相合成法合成1、2,在全保護肽合成過程中,選擇合適的樹脂,縮合劑及替代度對提高純度、得率十分重要。由于兩者肽鏈較短,故選用了適合短肽合成,且合成速率較快的2-CTC 樹脂。縮合試劑選用縮合能力較強,價格低廉的DIC/HOBt 體系。替代度選用較高的1.3 mmol/g,這樣不僅可以提高收率,降低成本,還可以避免因替代度過高導致的相鄰分子間的相互作用,影響產品的純度和后處理。

圖5 三種谷胱甘肽ESI-MS 分析圖譜Fig.5 ESI-MS spectra of 1,2 and 3
在兩者合成過程中另一個影響產品純度和收率的重要因素就是切割條件的選擇。
2.2.1 裂解試劑
固相合成中切割反應是在各種酸條件下完成的,一般不同的樹脂需要不同的切割試劑,同一樹脂也因肽側鏈保護基的不同而需要不同的試劑配方,以減少副反應,提高純度。稱取干燥至恒重的2 樹脂,室溫下以不同配比的裂解試劑反應2 h,結果見表1。結合純度、收率與成本確定C 配方為較優的裂解試劑,1 樹脂裂解效果與之類似。
2.2.2 裂解溫度
一般認為,低溫可以抑制副反應的發生,適度提高溫度可以加快反應速度,但不可過高,否則會使多肽降解,副反應增多,嚴重影響產品純度。本實驗選用不同裂解溫度進行試驗,發現先將樹脂在冰浴條件下裂解0.5 h 后,再緩慢升至室溫(30 ℃),較直接于室溫下裂解效果好。
2.2.3 裂解時間
通常情況下,適度延長反應時間有利于反應完全,提高得率,但若時間過長在脫除樹脂和保護基時會發生許多副反應,同時當多肽長時間處于強酸性環境中時,也會影響到肽的穩定性。實驗中發現當裂解2 h 時,反應基本完全,且純度和收率都較高。
此外,本實驗還利用不同的氧化方法[13],通過氧化巰基為二硫鍵得到3,氧化在各自較優的條件下進行,并對氧化效果進行了比較,結果見表2。
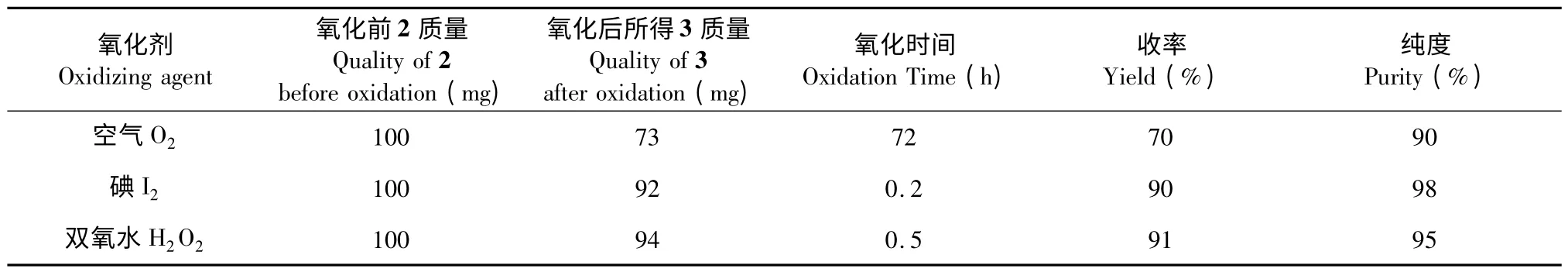
表2 不同氧化法氧化效果的比較Table 2 Comparison of different oxidation effect
從表中可知,空氣氧化的純度雖然較高,但收率較差,同時反應時間長,且底物濃度必須較低,否則副產物較多,較為繁瑣。故工業多采用雙氧水氧化法,本實驗除采用此法以外,還嘗試了碘氧化法,由
2.3 目標產物的保肝活性
由表3 知,合成1(α-GSH)、2(γ-GSH)和3(GSSG)與注射用2 在80、40 mg/kg 劑量下都可以顯著降低小鼠肝臟血清中ALT 和AST 水平,而低劑量(20 mg/kg)作用稍弱。
表3 連續給予合成化合物1、2、3 與注射用2 后對4 致急性肝損傷小鼠血清ALT 與AST 的影響(,n=8)Table 3 Effects of synthetic compounds 1,2,3 and 2 for injection on serum ALT and AST of 4-induced acute liver injury in mice (,n=8)
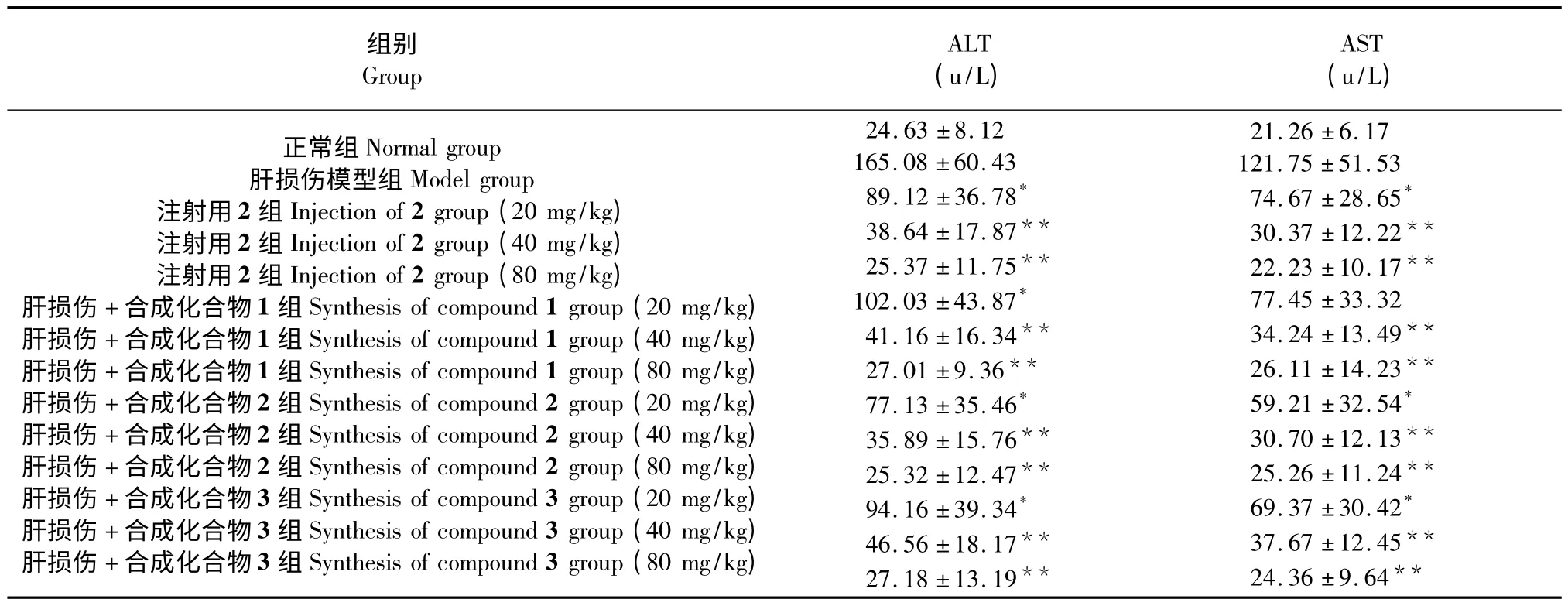
表3 連續給予合成化合物1、2、3 與注射用2 后對4 致急性肝損傷小鼠血清ALT 與AST 的影響(,n=8)Table 3 Effects of synthetic compounds 1,2,3 and 2 for injection on serum ALT and AST of 4-induced acute liver injury in mice (,n=8)
注:與肝損傷模型組比較,* P<0.05,**P<0.01。Note:compare with liver injury model group,* P<0.05,**P<0.01.
3 結論
通過與注射用γ-GSH 比較,小鼠急性肝損傷試驗結果表明,合成化合物1(α-GSH)、2(γ-GSH)和3(GSSG)的高、中劑量組都可以顯著降低小鼠肝臟ALT 和AST 水平,其治療效果與同等劑量的注射用γ-GSH 無顯著差異。初步說明可以考慮此方法用于谷胱甘肽的合成。
1 Jin CY (金春英),Cui JL (崔京蘭),Cui SY (崔勝云),et al.Synergistic effect of oxidized glutathione to glutathione and scavenging free radicals.Chem Anal (分析化學),2009,37:1349-1353.
2 Raghunathan VK,Ellis EM,Justice NAT,et al.Involvement of reduced glutathione and glutathione reductase in the chronic toxicity of hexavalent chromium tomonocytes in vitro.Toxicology,2007,23:105-106.
3 Every D,Morrison SC,Simmons LD,et al.Distribution of glutathione in millstreams and relationships to chemical and baking properties of flour.Cereal Chem,2006,83:57-61.
4 Jiang J (江潔),Shan LF (單立峰).Preparation and application of glutathione.Feed Ind (飼料工業),2007,28:15-17.
5 Liu GQ (劉國琴),Chen J (陳潔),Zhao L (趙雷),et al.Discussion of optimization method and technological conditions for extracting glutathione from wheat germ.J Henan Univ Tech (河南工業大學學報),2007,28:1-5.
6 Wu WT (吳梧桐),Lao XZ (勞興珍),Zheng X (鄭珩),et al.By the method of enzyme engineering technology of biosynthesis of glutathione (通過酶工程法生物合成谷胱甘肽).CN200710020902.1,2007-10-17.
7 Camera E,Picardo M.Analytical methods to investigate glutathione and related compounds in biological and pathological processes.J Chromatogr B,2002,781:181-206.
8 Chen J (陳堅),Wei GY (衛功元),Li Y (李寅),et al.Glutathione production by microbial fermentation.J Food Sci Biotech (食品與生物技術學報),2004,23:104-110.
9 Chen X (陳雪),Zhao WJ (趙文杰),Feng J (馮軍),et al.Strain screening of glutathione producing strain.Chin J Pharm Ind (中國醫藥工業雜志),2007,38:481-483.
10 Han Y (韓月),Yin ZF (尹志峰),Zhao HL (趙紅玲),et al.Solid phase synthesis of pramlintide.Chin J New Drug(中國新藥雜志),2012,21:1046-1049.
11 Xu SY (徐淑云),Bian RL (卞如濂),Chen X (陳修),et al.Methodology of pharmacological experiment (藥理實驗方法).Beijing:People's Medical Publishing House,2001.1346.
12 Sun J(孫鍵),Xu HJ(徐宏江),Zhu YH(朱裕輝),et al.Preparation and hepatoprotective activity of oxidized glutathione system.Chin J Pharm Ind (中國醫藥工業雜志),2013,44:265-268.
13 Wang LY (王良友),Pan HP (潘和平),Chen ZY (陳正英).The formation of several two disulfide bonds in peptide synthesis method is introduced.Organ Chem (有機化學),1998,18:576-580.

