甲氨基阿維菌素脅迫下福壽螺肝臟抗氧化酶活性及顯微結構的變化
黃秀枝, 蔡璦安, 尚戰峰, 賢振華
(廣西大學農學院,廣西 南寧 530005)
自1981年福壽螺引入中國以來,其作為外來入侵物種,在新的環境和氣候條件下,福壽螺失去了原有天敵的制約,加上盲目引進和管理不善,福壽螺大量生長繁殖,逐步擴散到稻田,成為一種新的為害水稻的有害生物[1-2]。隨著螺源的逐年積累,福壽螺已成為為害中國水稻的惡性水生動物,嚴重威脅水稻生產[3],被稱為“為害最大的外來物種之一[4]”、“世界性惡性入侵水生動物[5]”和“為害水稻的惡性水生動物[6]”。
甲氨基阿維菌素(Methylamino abamectin)是一種新型的高效生物殺蟲殺螨劑,具有低毒、無殘留、無公害的特點,被廣泛應用于農業生產中。其對菜青蟲、棉鈴蟲、甜菜夜蛾、小菜蛾等鱗翅目害蟲具有較高的殺蟲活性[7-8],對福壽螺的防治效果優于茶皂素和殺螺胺[9]。
超氧化物歧化酶(SOD)和過氧化氫酶(CAT)是生物體內的重要保護酶,可以清除細胞內多余的自由基,防止其毒害[10]。楊光研究發現,5.6 μg/L 以上的阿維菌素長時間脅迫對鯉魚產生較強的氧化壓力,使得機體抗氧化防御系統的正常功能受損,造成細胞或組織的不可逆損傷[11]。食用蟹在亞致死量的阿維菌素(10%)中暴露24 h,其鰓與肝胰腺的SOD活性上升[12]。楊家長等認為低濃度阿維菌素對鯉魚SOD活性的影響較大[13]。李世凱發現伊維菌素對斑馬魚肌肉SOD活性表現為低濃度的抑制,高濃度先誘導后抑制[14]。
甲氨基阿維菌素尚未在軟體動物中登記使用,其對福壽螺的毒性機理尚未清楚。本試驗擬以福壽螺中螺為研究對象,研究甲氨基阿維菌素對福壽螺肝臟SOD、PO和CAT酶活性的影響,及其對福壽螺肝臟顯微結構產生的病理變化,以期更系統地了解甲氨基阿維菌素在福壽螺體內的毒理。
1 材料與方法
1.1 試驗螺源
試驗螺為人工繁殖的第一代健康福壽螺中螺,體質量為(3.5±0.4)g,試驗期間不投食。飼養水池保持水體流通,水質清新。
1.2 試驗方法
1.2.1 甲氨基阿維菌素急性毒力測定 取68.3%甲氨基阿維菌素原藥配制成母液,加水稀釋成5個梯度濃度,分別為 0.80 mg/L、0.40 mg/L、0.20 mg/L、0.10 mg/L、0.05 mg/L,設清水為對照處理,每個處理重復3次。用桶 (8.75 cm×8.75 cm×16.50 cm)盛適當藥液,保證福壽螺能浸泡于藥液中。每桶投螺15只,加蓋紗網,防止福壽螺逃逸。在(25±1)℃的恒溫室浸泡福壽螺,每6 h觀察福壽螺的行為和死亡情況,并清除死螺,48 h后統計死螺數,計算死亡率和校正死亡率。試驗數據用DPS軟件進行處理,計算福壽螺在48 h的急性毒力回歸方程及LC25、LC50及LC75的濃度值。
1.2.2 福壽螺肝臟抗氧化酶活力測定 設置LC25、LC50、LC753個質量濃度和空白對照,每個濃度設3個重復,試驗開始后分別于6 h、12 h、24 h、48 h取樣,每組隨機選擇12只活螺,用自來水沖洗表面的藥液,于冰盤上快速取出福壽螺的肝臟,吸干表面水分。快速稱取1 g肝臟置于研缽中,用剪刀剪碎,加入液氮后快速研磨,加入緩沖液稀釋。
1.2.2.1 SOD及PO酶源及活力測定 按質量體積1∶5的比例,即1 g組織中加入5 ml預冷的0.2 mol/L Na2HPO4-NaH2PO4緩沖液(pH 6.8)冰浴、勻漿,4℃靜置30 min,冷凍離心(4℃,10 000 r/min)30 min,取上清液作為酶源,上清液中的蛋白含量用考馬斯亮藍法[15]測定。鄰苯三酚自氧化速率測定參考許申鴻和顧含真的方法[16-17]并作如下改進:依次加入0.1 mol/L Tris-HCl 4.5 ml緩沖液、4.2 ml二次蒸餾水,樣品管加入2.50 mmol/L 0.3 ml鄰苯三酚,于325 nm波長下測定吸光值。SOD酶活力單位定義為在25℃、pH 8.2時1 min抑制鄰苯三酚自氧化速率達50%的酶量[18]。PO酶活力測定參照Benjamin的方法[19]稍加改進:在2.0 ml的測定體系[1.0 ml 0.10 mol/L,pH 6.8的Na2HPO4-NaH2PO4緩沖液和1.0 ml 8.00 mmol/L鄰苯二酚]中加入200 μl酶源上清液,28℃檢測430 nm處的吸光值。酶活力單位定義為以1 min催化底物氧化增加吸光值0.001的酶量[20]。
1.2.2.2 CAT酶源及活力測定 取0.6 g肝臟于勻漿器中,加入6.0 ml已預冷的Tris-HCl緩沖液(0.01 mol/L Tris,0.25 mol/L蔗糖,0.10 mmol/L EDTA,pH 7.5),在冰浴下10 000 r/min勻漿,冷凍離心10 min[21]。在恒溫25℃條件下,將CAT酶提取液加入H2O2-磷酸鹽緩沖液中,采用1 cm比色皿在250 nm波長處每隔10 s測其吸光值。CAT酶活性單位定義為25℃、100 s內分解H2O2一半時的酶量[22]。
1.2.3 福壽螺肝臟顯微結構觀察 分別取清水(CK)、LC25、LC50及 LC75濃度處理6 h、12 h、24 h 及48 h受藥嚴重且瀕臨死亡的福壽螺肝臟,將其用鹽水洗凈,經固定、脫水、包埋、切片、蘇木精-伊紅染色法(HE)染色后在光學顯微鏡下觀察拍照。
1.3 數據統計
試驗數據用平均值±標準誤表示,組間數據用Duncan’s新復極差法進行顯著性比較。
2 結果與分析
2.1 急性毒力測定
試驗期間空白對照組(CK)的福壽螺正常,均無死亡。低濃度甲氨基阿維菌素給藥處理后,福壽螺出現行動稍遲鈍,爬行能力減弱等中毒癥狀;隨著給藥濃度提高,福壽螺呼吸管、觸角及外套膜均出現中毒癥狀。在給藥6 h內無死亡發生;給藥48 h后,各處理出現了不同程度的死亡。給藥48 h,甲氨基阿維菌素濃度與福壽螺死亡率呈線性相關關系(表1)。

表1 甲氨基阿維菌素對福壽螺的急性毒力試驗Table 1 Acute toxicities of methylamino abamectin to Pomacea canaliculata
2.2 甲氨基阿維菌素對福壽螺肝臟SOD活性的影響
從時間-效應關系上,甲氨基阿維菌素為LC25濃度時,福壽螺肝臟的SOD酶活性在6 h開始升高,在24 h時出現峰值,此時較對照組高14.24%,差異極顯著,但之后活性開始下降,到48 h時降至與對照水平幾乎一致;甲氨基阿維菌素在LC50濃度時,福壽螺肝臟SOD酶活在給藥6~24 h呈現顯著的激活作用,酶活力在24 h時達高峰,約為對照組的1.4倍,之后回落至低于對照組水平,整個過程呈現出了上升-下降的過程;甲氨基阿維菌素在LC75濃度時,福壽螺肝臟內SOD酶活性則表現出先升后降的過程,6~12 h內,SOD酶活性均顯著高于對照,6 h時達最大值,較對照組高28.33%,之后酶活逐步下降,至48 h時降至最低,較對照組降低了24.38%(圖1)。從濃度-效應關系分析,在處理6~12 h時間段,隨著濃度的增大,SOD活力呈現出增加的趨勢,24 h時SOD活性則表現出LC50>LC25>CK>LC75,此時濃度若達到LC75時,福壽螺肝臟的SOD活性已經受到抑制;48 h時,SOD活性為LC25>CK>LC50>LC75。在甲氨基阿維菌素高濃度和長時間處理下,福壽螺肝臟體內SOD酶活力受到較強抑制(圖1)。
2.3 甲氨基阿維菌素對福壽螺肝臟PO活性的影響

圖1 甲氨基阿維菌素對福壽螺肝臟SOD活性的影響Fig.1 Effect of methylamino abamectin on the activity of SOD in the liver of P.canaliculata
福壽螺肝臟PO活性在處理6 h內呈現上升趨勢,但隨著暴露時間的延長,各處理組PO的活性開始下降(圖2)。甲氨基阿維菌素濃度為LC25時,福壽螺肝臟PO酶活力在6 h急劇上升,6~12 h緩慢下降,之后急劇下降,至48 h時降至低于對照組水平;LC50濃度組,6 h時福壽螺肝臟PO酶活力上升趨勢較LC25濃度組小,之后PO酶活力開始下降,至48 h酶活極顯著低于對照;LC75濃度組PO酶活力的變化與LC25濃度組相似,均在6 h時最高,為對照組的2.4倍(P<0.01),但在12~48 h內急劇下降,48 h時PO酶活力極顯著低于對照組水平(圖2)。從濃度-效應關系分析,在12 h內,福壽螺肝臟PO活力表現出LC75>LC25>LC50>CK,但在48 h時,呈現CK>LC25>LC50>LC75(圖2)。說明在長時間高濃度甲氨基阿維菌素脅迫下,福壽螺抵抗甲氨基阿維菌素的能力減弱,表現出了明顯的時間和劑量效應。
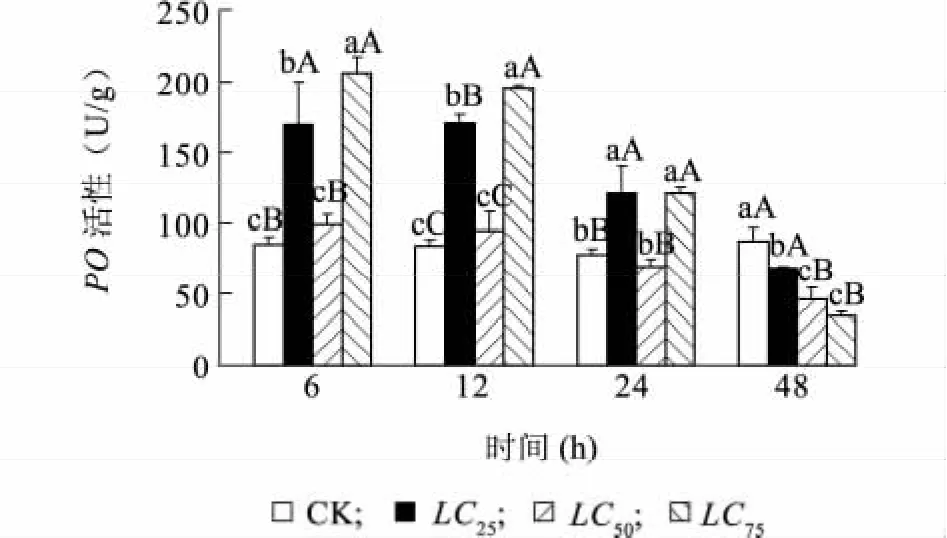
圖2 甲氨基阿維菌素對福壽螺肝臟PO活性的影響Fig.2 Effect of methylamino abamectin on the activity of PO in the liver of P.canaliculata
2.4 甲氨基阿維菌素對福壽螺肝臟CAT活性的影響
如圖3所示,在甲氨基阿維菌素作用下福壽螺肝臟內CAT活性總體表現為上升-下降的趨勢。甲氨基阿維菌素濃度為LC25時,福壽螺肝臟CAT酶活力在給藥6 h時緩慢增大,24 h之后開始下降,至48 h時極顯著低于對照組;甲氨基阿維菌素濃度為LC50時,福壽螺肝臟CAT酶活力在給藥6 h時顯著升高,隨后逐漸下降,至48 h時,CAT酶活力較對照組少30.06%(P<0.01);甲氨基阿維菌素在LC75濃度時,福壽螺肝臟CAT酶活性也表現出了先上升后下降的趨勢,CAT活性在6 h處出現高峰,為對照組的2.3倍,隨后急劇下降,至48 h時極顯著低于對照水平。從濃度-效應關系來看,6~12 h時隨著甲氨基阿維菌素濃度的增加,福壽螺體內肝臟CAT酶活力呈上升的趨勢,而后則表現出隨著濃度的增加而下降。說明短時間內(6~12 h)處理,甲氨基阿維菌素濃度越高,其對福壽螺肝臟內的CAT活力具有越強的激活作用,隨著作用時間延長,福壽螺肝臟CAT酶活力受到抑制作用。
2.5 福壽螺肝臟顯微結構的變化
正常福壽螺的肝臟消化小管結構完整、清晰,肝細胞未見異常(圖4-1、4-2)。低濃度(LC25)甲氨基阿維菌素處理6 h后,其結構沒有發生異常(圖4-3),濃度為LC50時,可見結締組織中的血管有少量瘀血(圖4-4),濃度為LC75時,瘀血面積加大(圖4-5)。甲氨基阿維菌素處理12 h時,福壽螺肝臟消化小管的結締組織明顯擴張,血管瘀血加重;消化小管的基膜變薄(圖4-6)。甲氨基阿維菌素處理24 h時,LC25濃度組福壽螺肝臟整個結構出現彌漫性瘀血(圖4-9);LC50處理組福壽螺肝臟消化小管的基膜大部分溶解壞死,細胞開始變形(圖4-10)。甲氨基阿維菌素處理48 h時,福壽螺中毒嚴重,在低濃度下方可看見消化小管基膜,但結構不完整(圖4-12);LC75組福壽螺肝臟上皮組織出現溶解壞死,結締組織高度擴張,其間可見大量絮狀壞死物,嗜堿性細胞和消化細胞變性,細胞畸形(圖4-14)。
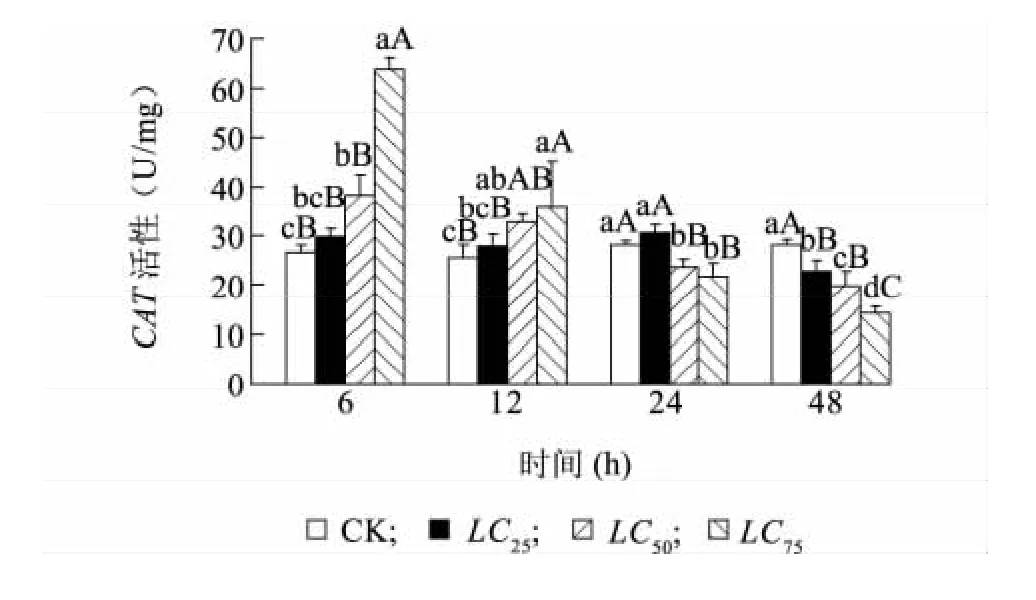
圖3 甲氨基阿維菌素對福壽螺肝臟過氧化氫酶活性的影響Fig.3 Effect of methylamino abamectin on the activity of CAT in the liver of P.canaliculata
3 討論
本研究發現各濃度組的福壽螺在不同的暴露時間下,其肝臟內SOD酶活力的變化趨勢不同。甲氨基阿維菌素低濃度(LC25)組的福壽螺肝臟SOD酶活力變化不大,長時間(48 h)暴露后,與對照組無顯著差異;中濃度(LC50)組福壽螺肝臟內SOD酶活力在24 h達到最大值,48 h其酶活力才被顯著抑制;而高濃度(LC75)組的SOD酶活性比低、中濃度組在更快的時間(6 h)達到高峰后開始持續下降并在24 h時被極顯著抑制。福壽螺中毒后,體內原有的自由基代謝受到了破壞,發生氧化損傷,在較輕的損傷程度下,福壽螺靠自身的抵抗防御作用,SOD發揮自身功能,清除掉多余的自由基,此時誘導的作用表現為適應性反應,但福壽螺在48 h高劑量的藥劑下,SOD無法在較短的時間抵抗過多的自由基,防御系統遭到了破壞,SOD活性受到了抑制,解毒功能下降,表現出嚴重的中毒現象。表明甲氨基阿維菌素對福壽螺肝臟內SOD酶活性具有激活作用,但隨著暴露時間的延長和暴露濃度的增加,激活能力下降,最終其肝臟SOD酶活力受到抑制。試驗中觀察到的SOD酶活性與其他相關研究中酶活性的變化類似,均呈先上升后下降的趨勢[23-24]。

圖4 福壽螺肝臟顯微結構(×100)Fig.4 The microstructure of livers of normal(1 and 2)and methylamino abamectin treated P.canaliculat(3 to 14)
PO以PPO的形式存在于血液淋巴中,是黑色素合成的關鍵酶,同時也是昆蟲體內的重要免疫蛋白。PPO一經活化成PO,則參與機體代謝過程的細胞吞噬、黑化作用和傷口愈合等過程,起防御作用[25]。本研究中暴露于甲氨基阿維菌素12 h的福壽螺,其肝臟PO酶活性波動大,以低濃度(LC25)、高濃度(LC75)組的福壽螺肝臟PO酶活性被顯著激活,而中濃度(LC50)對福壽螺肝臟內PO酶活性無顯著影響。短時間內,福壽螺肝臟內的PO先被激活,這與松油烯-4-醇對家蠅酚氧化酶具有激活作用[26]一致。而高濃度長時間(48 h)的暴露,則會使福壽螺體內PO酶活性受到抑制,這可能與破壞了黑色素的形成從而損壞了免疫系統有關。
短時間(6 h)脅迫下,福壽螺肝臟CAT酶活性均表現出激活作用,其中以高濃度(LC75)組福壽螺肝臟CAT酶活力激活效應顯著,但在長時間脅迫下,肝臟內產生大量的H2O2,超出CAT的清除能力,機體受損。國內外也有大量研究表明,CAT酶活力受毒物劑量的影響,當濃度較低時,毒物對代謝有一定的促進作用[27-28]。各濃度組福壽螺肝臟CAT酶活力均呈現先上升后下降的變化趨勢,這與阿維菌素脅迫下黃河鯉魚鰓組織中CAT酶活力的變化趨勢一致[12]。因此,CAT酶活性狀況變化能夠很好地反應機體受甲氨基阿維菌素的損害程度。CAT酶活性與其他兩種酶活性是否具有相關性或與其他抗氧化酶酶活性及脂質過氧化酶酶活性是否有關聯,有待進一步研究。
[1] 劉雨芳,李 菲,李玉峰,等.福壽螺在湖南的分布現狀、危害與擴散風險預警[J].水生生物學報,2011,35(6):1067-1071.
[2] 王志高,譚濟才,劉 軍,等.福壽螺綜合防治研究進展[J].中國農學通報,2009,25(12):201-205.
[3] 李小慧,胡隱昌,宋紅梅,等.中國福壽螺的入侵現狀及防治方法研究進展[J].中國農學通報,2009,25(14):229-232.
[4] CARLSSON N O L,BR?NMARK C,HANSSON L A.Invading herbivory:The golden apple snail alters ecosystem functioning in Asian wetlands[J].Ecology,2004,85(6):1575-1580.
[5] JOSHI R.Managing invasive alien molluse species in rice[J].International Rice Research Notes,2005,30(2):5-12.
[6] YUSA Y,Wada T.Impact of the introduction of apple snails and their control in Japan[J].The ICLARM Quarterly,1999,22(3):9-13.
[7] 葛 紅,韓 娟,徐 莉,等.甲氨基阿維菌素苯甲酸鹽應用研究概況[J].金陵科技學院學報,2010,26(1):90-95.
[8] 畢富春,徐風波.甲氨基阿維菌素苯甲酸鹽研究概述[J].農藥科學與管理,2002,23(2):31-33.
[9] 賈道田.三種藥劑對福壽螺生長發育繁殖影響的研究[D].桂林:廣西大學,2012.
[10]田春美,鐘秋平.超氧化物歧化酶的現狀研究進展[J].中國熱帶醫學,2005,5(8):1730-1732.
[11]楊 光.阿維菌素對鯉魚毒理效應的研究[D].南京:南京農業大學,2011.
[12]李燮陽.阿維菌素對黃河鯉抗氧化系統和Na+-K+-ATPase活性影響的研究[D].鄭州:河南農業大學,2010.
[13]楊家長,楊 光,馬曉燕,等.低濃度阿維菌素對鯉魚超氧化物歧化酶(SOD)的影響[J].生態毒理學報,2009,4(6):823-826.
[14]李世凱.伊維菌素在斑馬魚(Danio rerio)和吉富羅非魚(GIFT,Oreochromis niloticus)體內的毒理學研究[D].上海:上海海洋大學,2014.
[15] BRADFORD M.A rapid and sensitive assay of protein utilizing the principle of dye binding[J].Analytical Biochemistry,1976,72:248-254.
[16]許申鴻,杭 瑚,李運平.超氧化物歧化酶鄰苯三酚測活法的研究及改進[J].化學通報,2001,8(12):516-519.
[17]顧含真,袁勤生,趙 健,等.腎上腺素SOD測活性法的改進及影響因素研究[J].食品與藥品,2006,8(8A):46-49.
[18]史競艷,羅辛茹,鮑江鴻,等.超氧化物歧化酶活性的測定[J].湖北大學學報:自然科學版,2012,34(4):373-377.
[19] BENJAMIN N D,MONTGOMERY M W.Polyphenoloxidase of Royal Ann cherries:purification and characterization[J].J Food Sci,1973,38:799-806.
[20]楊進孫,唐小牛,周書林,等.EDTA與金屬離子對釘螺酚氧化酶活性的影響[J].中國病原生物學雜志,2007,2(6):457-459.
[21]李紅艷,張 喆,陳海剛,等.三唑磷對斑節對蝦肝胰腺和鰓的氧化脅迫效應[J].農業環境科學學報,2013,32(12):2345-2351.
[22]徐鏡波,哀曉凡,郎佩珍.過氧化氫酶活性及活性抑制的紫外分光光度測定 J].環境化學,1997,16(1):73-76.
[23] MATER-MIHAICH E,RICHARD T,DI GIULIO R T.Antioxidant enzyme activities and malonaldehydel,glutathione and methemoglobin concentrations in channel fish exposed to DEF and N-butylmercaptan[J].Chem And Physiol,1986,85C:427-432.
[24]柯佳穎,肖良豪,黃周英,等.六價鉻(Cr6+)對福壽螺肝胰臟抗氧化酶活性和脂質過氧化的影響[J].南方農業學報,2013,44(9):1471-1476.
[25]徐亞玲,李文楚.昆蟲酚氧化酶作用機制的研究進展[J].安徽農業科學,2010,38(27):14844-14846.
[26]馬志卿,馮俊濤,郭志波,等.松油烯-4-醇對家蠅幾種代謝酶及酚氧化酶的影響[J].浙江大學學報:農業與生命科學版,2008,34(5):509-515.
[27] MACNAIR M.The genetics of metal tolerance in vascular plants[J].New Phytophysiology,1993,124:541-559.
[28] CUMMING J R,TOMSETT A B.Metal tolerance in plants:signal transduction and accumulation mechanisms[C]//ADRIANO D D.Biogeochemistry of trace metals.Boca Raton:Lewis Publishers,1992:329-364.

