殼聚糖螯合凝膠層析法純化血液超氧化物歧化酶
王保全, 平 娟 , 張永州, 黃繼海,李昭華, 董先智, 龐曉斌, 李梅基
(1.河南大學 淮河臨床學院,河南 開封 475001;2.中國科學院 生物物理研究所,北京 100101;3.河南大學 藥學院,河南 開封475001;4.蘭州大學 生物工程學院,甘肅 蘭州730000)
超氧化物歧化酶簡稱SOD,是廣泛存在于生物體內的一種可防止氧化損傷和缺失的活性酶[1],也是一種應用廣泛的藥用酶[2],具有抗衰老、預防輻射及治療炎癥等一系列功能[3],已經被廣泛應用于食品及醫藥衛生行業。
1975年proath首次提出固定化金屬螯合親和層析(IMAC),并發展成為一種有效的生化分離技術[4],該方法是利用固定在基質上的過渡態金屬離子和蛋白質表面的組氨酸、半胱氨酸、色氨酸等殘基的配位作用,來實現對金屬離子有親和力的蛋白質的吸附和分離。其中組氨酸是與金屬離子作用較強的氨基酸 ,含有較多組氨酸的蛋白質(如SOD)可以在IMAC介質中有效的保留,故多聚組氨酸已經成為最常用的蛋白質純化標簽[5]。在制備親和介質時,常用的金屬離子有Cu2+,Zn2+和Ni2+等,常用的螯合配基有亞氨基二乙酸 (IDA),三羧基甲基乙二胺(TED),次氨基三乙酸(NTA)等[6-7]。固定化螯合親和色譜常常以凝膠為載體,如在SephadexG-75或者DEAE-superpose等凝膠上用化學交聯方法引入螯合劑IDA,再通過交聯固定和親和配 (Ba2+,Cu2+,Zn2+)。用該方法制備的凝膠介質生產成本很高,軟基質很易被壓縮,不易被放大生產。近年來,隨著基因工程下游技術的發展,基因重組蛋白質的分離純化技術越來越顯示其重要性,金屬螯合層析技術(IMAC)分辨率高、選擇性好,能在常規的變性條件下及非變性條件下進行蛋白質組分分離純化。研究表明[8-9],影響金屬螯合層析的因素很多,但是決定色譜填料分離效果的主要因素在于填料的性質、基質種類、配基及所螯合的金屬離子種類等。國外有報道用硅膠來制備螯合介質[10-11],但硅膠顆粒很難被改性,而且生物相容性和親水性較差,易于吸附其他雜質,所以不適合工業化大規模生產應用。作者以殼聚糖為原料,以固定相偶聯的配基-亞氨基二乙酸(IDA)及金屬離子Cu2+發生螯合作用,制得金屬親和層析凝膠,改凝膠化學穩定性好,基質穩定,容易再生,并首次以聚合高分子電解質聚丙烯酸鈉對傳統血液超氧化物歧化酶提純工藝進行改進。改進后的新工藝比傳統血液提純工藝大大縮短了分離流程,省去了氯仿、乙醇等有毒易污染的試劑。將金屬親和層析原理引入改進后的新工藝中,用于分離純化血液SOD,達到了很好的純化效果,為工業上放大生產提供了參考。
1 材料與方法
1.1 材料和儀器
新鮮豬血,北京市第五肉聯廠提供;檸檬酸三鈉,氯化銅,丙酮,北京化學試劑廠產品;聚丙烯酸(PAA),上海阿拉丁試劑總廠產品;不同相對分子質量聚丙烯酸鈉(PAAS),由北京順義希濤化學試劑廠合成,固含3.45%(質量分數);殼聚糖,脫乙酰度≥90%,Sigma公司進口分裝;SOD活性試劑盒,南京建成生物公司產品;低相對分子質量標準蛋白質,華美生物技術公司產品;SOD標準品,華美生物技術公司產品;臨苯三酚,國藥集團產品;SephedexG-75,DEAE-sepherose-fast flow4B,瑞典 Pharmacia公司產品;UV-2010型紫外分光光度計,大型離心機,日本島津公司制造;DYY-6C型電泳儀,北京六一儀器廠制造;超濾杯,FD-IC-50冷凍干燥機,北京博益康實驗儀器有限公司制造;HD-5型紫外監測儀,上海滬西分析儀器廠制造;其他試劑均為分析純。
1.2 試驗方法
1.2.1 SOD的制備及PAAS相對分子質量對酶活性的影響 取新鮮抗凝血液,4 000 r/min離心45 min,或新鮮抗凝血靜止過夜分層后取下層血球,待用。取8份100 mL血球,加等體積含質量分數0.6%Tritonx-100的蒸餾水,磁力30 min攪拌溶血,然后加溶血體積的20%的固含為3.45%PAAS(相對分子質量分別為 3 000,10 000,50 000,100 000,500 000,1 000 000,2 000 000,4 000 000)在水浴鍋中,將加入體積分數20%PAAS后的溶血液加熱到60℃。等液體溫度達到70℃時再加10%溶血體積的氯化銅(質量分數為 10%)作為激活劑,恒溫10 min。將熱變后的溶血液用細紗過濾,收集濾液(觀察酶液顏色),加入2倍濾液體積預冷-4℃的丙酮,離心收集沉淀,沉淀(約2 mL)用pH為7.6的PBS溶解(加50倍于沉淀體積的PBS)。將上述酶液裝入超濾杯中,選用相對分子質量為10 000的超濾膜反復超濾2~3次,收集膜上酶液,即為粗酶液。
1.2.2 殼聚糖自制親和凝膠的制備 取4 g殼聚糖,加入體積分數1%的CH3COOH溶液,攪拌至完全溶解,滴入戊二醛至一定質量分數(2‰),以質量分數(30%~40%)NaOH溶液調至堿性,磁力攪拌交聯6 h,在快速攪拌下加入NaOH溶液,使殼聚糖呈顆粒狀沉淀。收集沉淀,水洗至中性。稱取2 g NaBH4攪拌還原,水洗至中性,得戊二醛交聯濕狀殼聚糖。取其懸液調pH到12,取一定量交聯殼聚糖懸液滴入一定量的環氧氯丙烷,于恒溫振蕩器中振蕩反應2 h,將其洗滌至中性,抽干。按活化殼聚糖的比例加入2 g亞氨基二乙酸鈉在恒溫振蕩器中,于一定溫度(65℃)反應一段時間(24 h)。洗滌至中性,用布氏漏斗抽干,得殼聚糖親和凝膠。
1.2.3 Cu2+的螯合、平衡和SOD的純化 取以殼聚糖為載體合成的親和吸附劑裝柱(4 cm×20 cm),用0.1 mol/L的CuSO4灌注至飽和吸Cu2+。螫合柱用含0.5 mol/L 的 NaCI,pH 7.5,0.05 mol/L 的磷酸鉀緩沖液進行平衡過夜后,取豬紅細胞Cu-Zn SOD粗提液上樣。先以上述平衡液進行平衡洗脫,再以含0.5 mol/L NaCl,0.05 mol/L L 咪唑的 pH 7.5,0.05 mol/L 的磷酸鉀緩沖液進行洗脫。控制體積流量為15 mL/h,每2 mL收集一管,并以紫外檢測儀檢測,冷凍干燥。
1.2.4 SOD凝膠過濾層析純化 預先裝好Sepedex G-75 柱(1 cm×60 cm),柱子事先用 0.05 mol/L pH 7.6的PBS平衡過夜,然后把上述酶液上柱,紫外監測儀檢測,收集蛋白質活性峰,用恒流泵控制體積流量為1 mL/min,每5 min收集一管,收集上述各個蛋白質峰,經超濾濃縮、透析除鹽后,冷凍干燥24 h得到淺藍色固體粉末。詳見文獻[12]。
1.2.5 SOD離子交換層析純化 預先裝好的DEAE-superpose-fast flow 4B 柱(2 cm×60 cm)用 0.05 mol/L pH為7.8的PBS平衡過夜,酶液上柱后,用0~2 mol/L的氯化鈉溶液進行梯度洗脫,并用紫外監測儀檢測,恒流泵控制體積流量為2~3 mL/min,收集蛋白質活性峰 ,收集上述各個蛋白質峰,經超濾濃縮、透析除鹽后,冷凍干燥24 h得到淺藍色固體粉末。詳見文獻[13]。
1.2.6 蛋白質含量測定 考馬斯亮藍方法測定,以牛血清白蛋白質濃度為橫坐標,蛋白質紫外吸收值為縱坐標,繪制蛋白質標準曲線,其線性回歸方程為:A=0.102C-0.025 3,R2=0.991 5。
1.2.7 SOD活力的測定 按照SOD試劑盒說明進行。
1.2.8 酶紫外吸收光譜測定 取經純化的酶,溶于適量的蒸餾水,用UV-2001型紫外分光光度計在200~500 nm范圍內進行紫外掃描[14]。
1.2.9 SDS-PAGE聚丙烯酰胺凝膠電泳 測定相對分子質量和純度分離膠質量分數12%,濃縮膠質量分數5%,電極緩沖液為pH 8.3 Tris-Gly緩沖液;電流條件:12 mA 50 min,50 min 后 24 mA,2~3 h。
2 結果與分析
2.1 殼聚糖螯合金屬層析介質的作用機理
殼聚糖螯合金屬層析技術是建立在蛋白質表面的氨基酸和固定化金屬離子的親和力的不同來進行蛋白質分離純化的一項技術,過渡態的金屬離子能夠與電子供體,如氮,硫,氧等原子以配位鍵結合,金屬離子上剩余的空軌道是電子供體的配位點,當它在溶液中時會被水分子或陰離子占據。然而,當蛋白質表面氨基酸殘基與金屬離子的結合力較強時,氨基酸殘基的供電原子就會與金屬離子結合形成復合物,取代原先結合的水分子或陰離子,這樣就能使蛋白質分子結合在固體表面。SOD含有相對較多的組氨酸上的咪唑基,可以與螯合柱上的金屬離子特異性結合,然后通過特殊質子化洗脫而達到分離純化,作用機理見圖1。
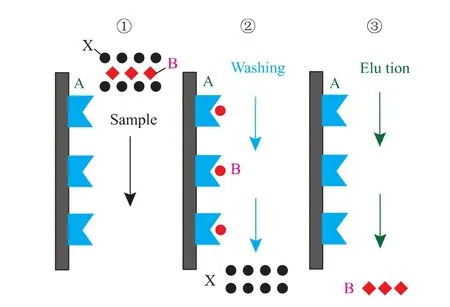
圖1 殼聚糖螯合凝膠層析對蛋白質的作用機理Fig.1 Mechanism of the chitosan gel chromatography on the protein
2.2 不同相對分子質量聚丙烯酸鈉對SOD酶活性的影響
固定PAAS用量為20%(體積分數),氯化銅用量為10%,另外pH值恒定7.8,考察不同相對分子質量(3 000,10 000,50 000,100 000,500 000,1 000 000,2 000 000,4 000 000)的 PAAS 對酶活性的影響,并從實驗現象和酶液顏色來確定最佳相對分子質量,這些相對分子質量涉及了低相對分子質量、中相對分子質量,高相對分子質量3個階段。實驗發現,在相對分子質量大于10 000時,酶液顏色有顯著變化。中相對分子質量和高相對分子質量PAAS,由于其黏性很大,導致酶液過濾困難,并且高分子PAAS由于對血液細胞有很強的蓄積作用,導致熱變反應很不徹底,所以選用低相對分子質量的PAAS效果較好,見圖2。
2.3 純化各步驟層析譜圖
由層析譜圖3—5可以知道,超濾濃縮后的粗酶液,經離子交換和凝膠過濾層析,金屬親和凝膠層析純化后,均出現兩個明顯的蛋白質活性吸收峰,經活性檢測得知,大峰中SOD的活性明顯較高,小峰沒有明顯的蛋白質活性,驗證了金屬親和凝膠層析的可靠性和代替傳統昂貴填料的可能性。
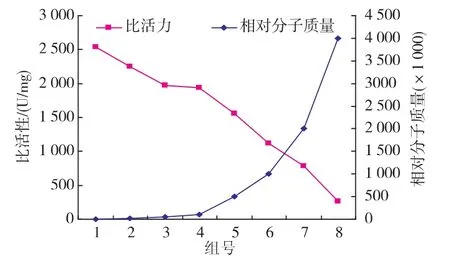
圖2 不同相對分子質量聚丙烯酸鈉對SOD酶活性的影響Fig.2 Effect of the molecular weight of PAAS on the enzyme activity
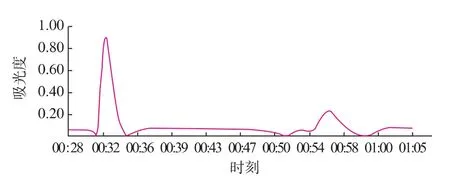
圖3 殼聚糖金屬親和層析譜圖Fig.3 Chistosan metal affinity chromatography spectra
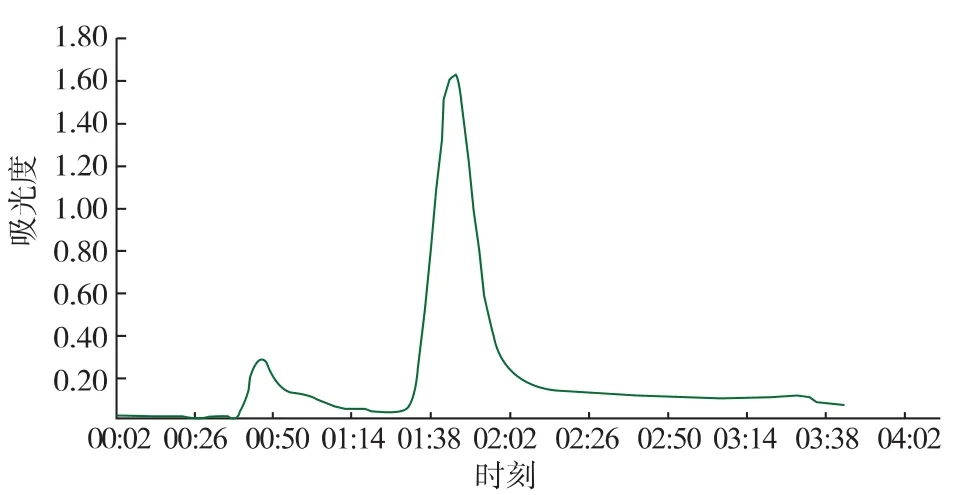
圖4 凝膠過濾層析譜圖Fig.4 Gel filtration chromatography spectra
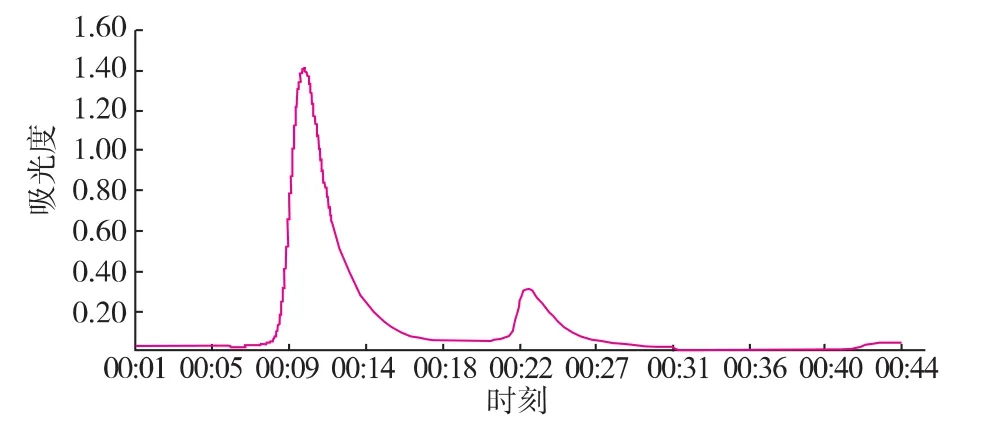
圖5 離子交換層析譜圖Fig.5 Ion exchange chromatography spectra
2.4 酶紫外吸收特性和酶種類鑒定結果
取金屬親和層析后冷凍干燥的純化酶在200~550 nm范圍內掃描產品,酶的紫外吸收光譜表明最高吸收峰在 259、258 nm 處(UV ABS:0.328),次高峰在 265、266 nm 處 (UV ABS:0.314), 呈典型 Cu Zn-SOD吸收光譜曲線[15]。如圖6所示。
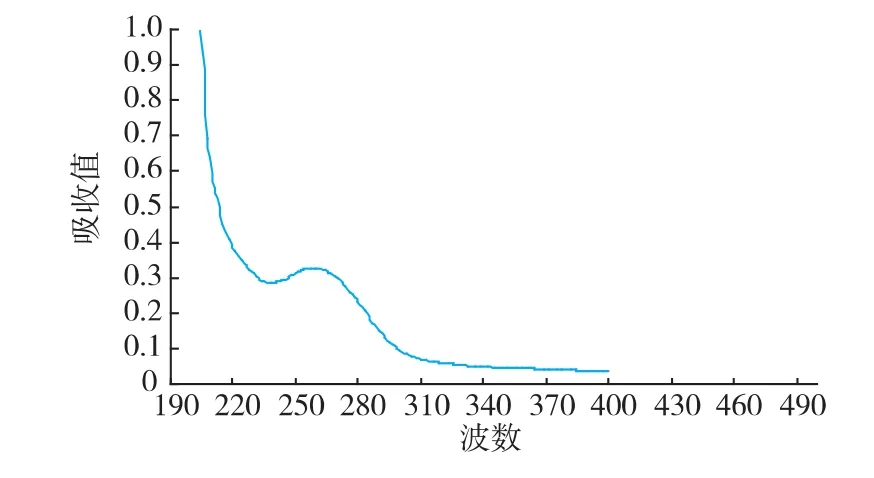
圖6 純化后酶的紫外吸收圖譜Fig.6 Ultraviolet absorption of the enzyme
2.5 血液SOD純化后各步驟凝膠電泳圖及相對分子質量的鑒定
如圖7—9所示。
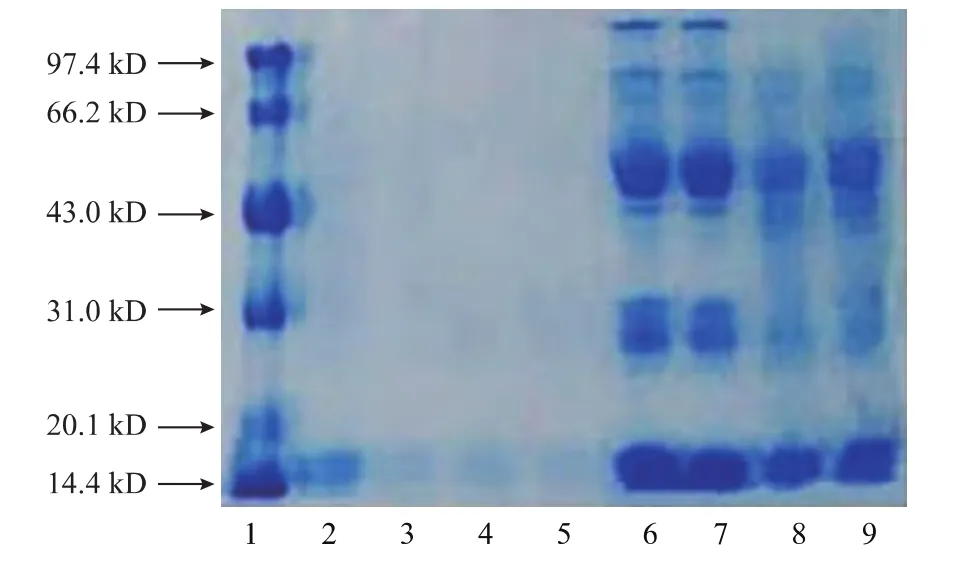
圖7 凝膠過濾層析各步電泳圖Fig.7 Electrophoretogram of Purification steps by gel filtration chromatography
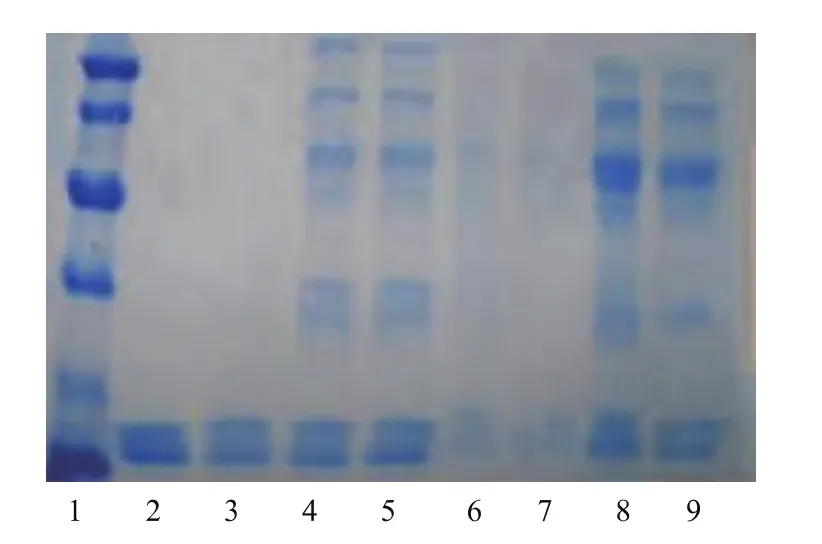
圖8 離子交換層析各步層析譜圖Fig.8 Electrophoretogram of Purification steps by ion exchange chromatography
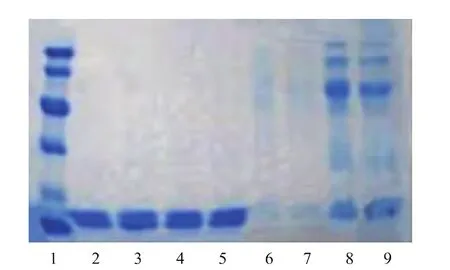
圖9 殼聚糖金屬親和層析各步純化譜圖Fig.9 Electrophoretogram ofPurification stepsby chitosan affinity chromatography
2.6 血液(取新鮮豬血100 mL)SOD各步純化結果
100 mL的新鮮血球經金屬螯合層析純化后,雖然酶活性不及傳統的離子交換和凝膠過濾層析等方法的,但是酶活性有很大的提高,產品得率和活性回收率分別達到15.5%和42.6%。見表1。
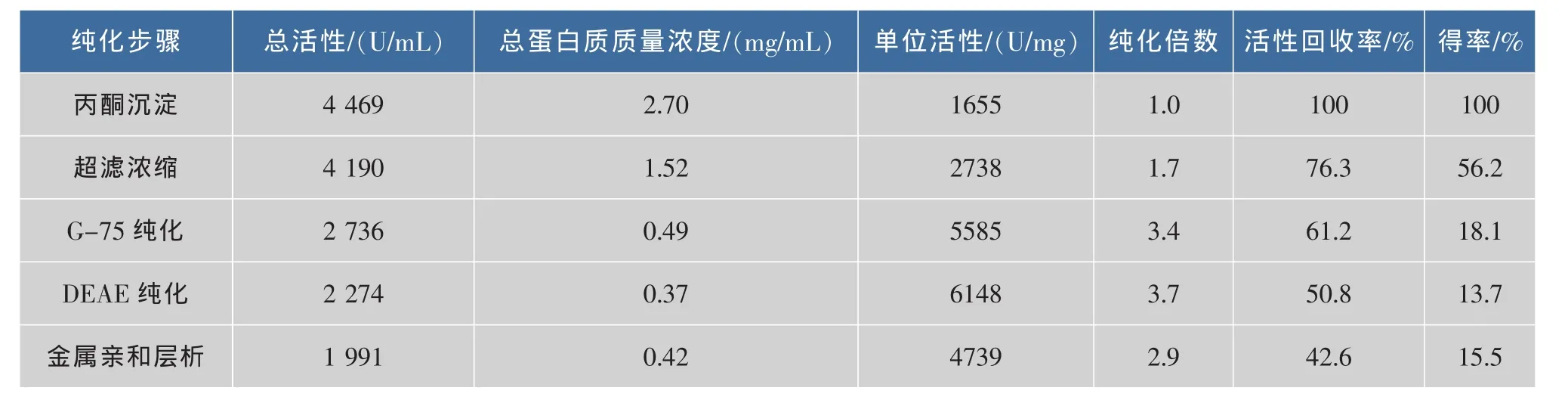
表1 血液SOD提純各個步驟純化結果表Table 1 Results of the purification steps of blood SOD
3 結語
層析純化是獲得蛋白質多肽類藥物精品最關鍵的一步,對SOD的酶活性有很大的提高。作者制備了含殼聚糖為基礎基質的螯合凝膠,并成功螯合了金屬Cu2+,采用增加離子強度或者降低pH值來洗脫純化蛋白質。國外對層析純化的多步組合應用研究較為活躍,Cui L Y等[16]依次采用熱處理、乙醇氯仿沉淀、冷丙酮沉淀和DEAE離子交換層析方法和羧甲基纖維素陽離子交換層析方法純化SOD粗品;Cheryl L等[17]人采用肝磷脂瓊脂糖凝膠層析柱(2.5 cm×20 cm)層析、Q-瓊脂糖凝膠層析、伴刀豆球蛋白質A-瓊脂糖凝膠層析、MonoQ-瓊脂糖凝膠層析、Mono S-瓊脂糖凝膠層析等步驟純化小鼠肺細胞外液SOD,使酶活力進一步提高。目前國內外SOD的純化材料多用DEAE或者Sephedex等昂貴填料[18],導致生產純化過程中純化成本較高。金屬螯合層析和普通的層析方法相比具有一些特殊的優點:如親和配基Cu2+、Zn2+價廉易得,可以在高鹽濃度下操作,穩定,容易再生,介質化學穩定性好,剛性強。制備的新型金屬螯合層析介質可用于蛋白質的分離純化,相比DEAE-52具有吸附容量大、吸附特異性高等優點,但由于金屬螯合層析采用劇烈的洗脫條件洗脫,純化效果略低于離子交換層析和凝膠過濾層析的。
致謝:感謝中科院研究平臺為本實驗提供了相關設備支持,特別感謝劉翠、李昭華、李梅基等給予的幫助。感謝河南大學藥學院相關老師的幫助,特別是中藥實驗室李勉老師、方明月老師,在此一并感謝。
[1]杜秀敏,殷文璇,張慧,等.超氧化物歧化酶(SOD)的研究進展[J].中國生物工程雜志,2003,23(1):48-50.DU Xiumin,YIN Wenxuan,ZHANG Hui,etal.Theresearchingprogressofsuperoxidedismutase [J].Progressin Biotechnology,2003,23(1):48-50.(in Chinese)
[2]張翊,王軍志,吳勇杰.超氧化物歧化酶藥用研究進展[J].藥學學報,2003,38(1):71-74.ZHANG Yu,WANG Zhijun,WU Yongjie.Progress of pharmaceutical studies on superoxide dismutase[J].Acta Pharmaceutica Sinica,2003,38(1):71-74.(in Chinese)
[3]李東旭,吳蕾,任云霞.超氧化物歧化酶的提取和純化技術研究進展[J].食品研究與開發,2008,29:183-185.LI Dongxu,WU Lei,REN Yunxia.The progress of extraction and purification technology of superoxide dismutase[J].Food Research and Development,2008,29:183-185.(in Chinese)
[4]魏琪,姚汝華,鮑時翔.固定化金屬螯合親和膜色譜柱的制備及純化銅鋅超氧化物歧化酶的研究[J].中國色譜,2000,18(4):361-365.WEI Qi,YAO Ruhua,BAO Shixiang.Preparation of immobilized metal-chelated affinity membrane and its application to purification of Cu/Zn-Superoxide dismutase[J].Chinese Journal of Chromatography,2000,18(4):361-365.(in Chinese)
[5]李淑娟,孫永亮.金屬螯合親和色譜填料的制備及其在六聚組氨酸融合蛋白分離中的應用[J].中國生物工程學報,2007,23(5):942-946.LI Shujuan,SUN Yongliang.Preparation of metal chelate affinity chromatographic medium and its application in the purification of 6 Histidine-tagged protein[J].Chinese Journal of Biotechnology,2007,23(5):942-946.(in Chinese)
[6]李蓉,陳國亮,趙文明.固定金屬離子親和色譜——蛋白質分離的方法、原理、特性和應用[J].化學通報,2005(5):352-356.LI Rong,CHEN Guoliang,ZHAO Wenming.Immobilized metal ion affinity Chromatography—Methods,Principles,Characteristics and applications for protein separation[J].Chemistry,2005(5):352-356.(in Chinese)
[7]李蓉,邸澤梅,陳國亮.金屬螯合親和色譜中固定金屬與蛋白質的作用[J].分析化學雜志,2002,30(5):552-555.LI Rong,DI Zemei,CHEN Guoliang.Interaction between immobilized metal and protein in metal chelate affinity chromatography[J].Chinese Journal of Analytieal Chemistry,2002,30(5):552-555.(in Chinese)
[8]李蓉,邸澤梅,陳國亮.流動相組成、濃度和pH對蛋白質在金屬螯合柱上的保留特性的影響[J].中國色譜,2001,19(5):385-389.LI Rong,DI Zemei,CHEN Guoliang.Influences of the mobile phase constitution,salt concentration and pH value on retention characters of proteins on the metal chelate column[J].Chinese Journal of Chromatography,2001,19 (5):385-389.(in Chinese)
[9]Abudiab T,Beitle J R R.Preparation of magneticimmobilized metal affinity separation media and its use in the isolation of proteins[J].Jour nal of Chromatogrphy A,1998,795:211-217.
[10]王曉軍,范代娣.金屬螯合親和層析在純化重組類人膠原蛋白中的應用[J].2005,19(3):410-414.WANG Xiaojun,FAN Daidi.Purification of recombinant Human-like collagen by using metal chelated affinity chromatography[J].2005,19(3):410-414.(in Chinese)
[11]趙輝,沈夢長,錢愛,等.Cu-Zn SOD的硅膠吸附分離法[J].中國生化藥物雜志,1995,16(4):151-154.ZHAO Hui,SHEN Mengchang,QIAN Ai,et al.The separation method of Cu,Zn-Superoxide dismutase (SOD) by silica gel absorption[J].Chinese Journal of Biochemical Pharmaceutics,1995,16(4):151-154.(in Chinese)
[12]黃曉佳,袁光譜,王愛勤.模板交聯殼聚糖對過渡金屬離子吸附性能研究[J].離子交換與吸附,2000,16(3):262-266.HUANG Xiaojia,YUAN Guangpu,WANG Aiqin.Adsorption of the transition metal ions on cross-linked chitosan resin prepared in presence of Zn(Ⅱ) tablate[J].Ion Exchange and Adsorption,2000,16(3):262-266.(in Chinese)
[13]李豪,車振明,周太剛,等.豬血紅細胞超氧化物歧化酶的純化研究[J].化學與生物工程,2005(12):21-25.LI Hao,CHE Zhenming,ZHOU Taigang,et al.Purification of superoxide dismutase from porcine erythrocyte[J].Chemical and Biological Engineering,2005,12(3):21-25.(in Chinese)
[14]賴雅平,王東耀,劉汝鋒,等.豬血中超氧化物歧化酶的分離工藝及穩定性研究[J].食品研究與開發,2008,29(4):10-13.LAI Yaping,WANG Dongyao,LIU Rufeng,et al.The extraction thchnies and character of superoxide dismutase from fresh pig blood[J].Food Research and Development,2008,29(4):10-13.(in Chinese)
[15]韓文清,栗淑媛,喬辰.鄂爾多斯高原堿湖鈍頂螺旋藻SOD的純化與性質研究[J].內蒙古師范大學學報,2008,7(6):780-783.HAN Wenqing,LI Shuyuan,QIAO Chen.Purification and properties of SOD in spirulina platensis from erdos plateau alkaline lake[J].Journal of Inner Mongolia Normal University,2008,7(6):780-783.(in Chinese)
[16]CUI L Y,AN L W.Purification and paritial characterization of Cu,Zn superoxide dismutase from haemolymph of oriental river prawn macrobrachium[J].Aquaculture,2007,270(14):559-565.
[17]Chery F,Jan E.Purification and characerization of extracellular superoxide dismutase in mouse lung[J].Biochemical and Biophysical Research Communications,2000,275(2):542-548.
[18]Namir I A,Haddad Q,Yuan S.Purification and some properties of Cu,Zn superoxide dismutase from Radix lethospermi seed kind of Chinese traditional meidicine[J].Journal of Chromatography B,2005,818(2):123-131.

