共表達蛋白質折疊輔助因子對畢赤酵母分泌表達IFNβ-HSA融合蛋白質的影響
陳鳳祥, 關 波, 陳 蘊, 段作營, 金 堅, 李華鐘*
(1.江南大學 工業生物技術教育部重點實驗室,江蘇 無錫 214122;2.江南大學 藥學院,江蘇 無錫 214122)
干擾素 β(Interferon β,IFNβ)是由人成纖維細胞分泌的一種糖蛋白質,它是一種具有廣譜抗病毒、抑制細胞增殖、免疫調節等多種生物活性的細胞因子,由166個氨基酸殘基組成,相對分子質量為22 000~23 000[1-2]。由于IFNβ相對分子質量較小,易被腎小球濾過,因而在體內的半衰期較短。作者所在實驗室前期利用基因融合技術將IFNβ與人血清白蛋白質(Human serum albumin,HSA)基因融合,并成功地在畢赤酵母(Pichia pastoris)KM71中進行了表達,融合蛋白質具有HSA和IFNβ的抗原性以及良好的臨床應用前景[3]。
研究表明,外源蛋白質過量表達時,初生肽鏈在內質網中折疊、加工和轉運途徑超載,造成蛋白質錯誤折疊,成為外源蛋白質分泌表達的限速步驟[4]。分子伴侶BiP是定位于內質網腔內的伴侶蛋白質,能幫助新合成蛋白質完成進一步的折疊,或者與未折疊蛋白質、錯誤折疊蛋白質結合并通過內質網相關的降解(ER associated degradation,ERAD)途徑實現其降解[5-6]。有文獻報道,共表達分子伴侶BiP能夠促進畢赤酵母分泌外源蛋白質[7];但也有研究表明,BiP的過量共表達會對外源蛋白質表達造成負面影響[8]。分析其原因可能是過表達BiP將導致其輔助分子伴侶Lhs1p或內質網腔內ATP等含量不足,過多的BiP不再能發揮分子伴侶活性,從而使蛋白質進入ERAD途徑而被降解[9-10]。
二硫鍵異構酶(PDI)能夠加速對蛋白質的進一步折疊,主要負責二硫鍵的形成和異構化,能夠防止新生多肽多聚體產生,而且能使錯誤折疊的蛋白質重新正確裝配[11]。二硫鍵的形成需要氧化型PDI再生,而黃素腺嘌呤二核苷酸依賴的內質網氧化還原酶(Endoplasmic reticulum oxidation 1,Ero1)能促進氧化型PDI再生,從而激活其活性[12-13]。
研究中使用相對溫和的GAP啟動子,構建了共表達Ero1、PDI和BiP等蛋白質折疊輔助因子的Pichia pastoris GS115/pPIC-IFNβ-HSA菌株,考察共表達這3種蛋白質折疊輔助因子對融合蛋白質表達水平的影響。
1 材料與方法
1.1 菌株和質粒
融合蛋白質表達菌株Pichia pastoris GS115/pPIC-IFNβ-HSA和蛋白質折疊輔助因子表達載體pGAP-Ero1、pGAP-PDI、pGAP-BiP 由作者所在實驗室構建并保藏,酵母表達載體pGAPZ B購自Invitrogen公司。
1.2 主要試劑
限制性內切酶AvrII,購自Thermo公司;PCR產物純化試劑盒,購自生工生物工程(上海)股份有限公司;酵母基因組提取試劑盒,購自北京康為世紀生物科技有限公司;酸洗玻璃珠 (500 μm),購自Sigma公司;博來霉素(Zeocin),購自美國Invitrogen公司;酵母浸粉(Yeast Extract)、胰蛋白胨(Tryptone Powder),購自OXOID公司;其它試劑均為進口或國產分析純。
1.3 共表達轉化子的構建與驗證
將 pGAP-Ero1、pGAP-PDI和 pGAP-BiP 共表達質粒和pGAPZ B空載分別用AvrII限制性內切酶進行線性化,電擊轉化GS115-IFNβ-HSA感受態細胞(1.5 kV、5 ms)[14]。 加入預冷的 1 mol/L 山梨醇30℃靜置培養1 h后,再加入YPD培養基30℃振蕩培養 2 h, 涂布 YPD平板 (含 400 μg/mL的Zeocin),置于30℃培養箱中培養3 d。
挑取若干YPD平板單菌落分別接種于5 mL YPD 液體培養基中 (含 100 μg/mL Zeocin),200 r/min、30℃培養24 h,用酵母基因組DNA提取試劑盒提取基因組DNA,采用pGAP載體通用引物(正向:5′-GTCCCTATTTCAATCAATTGAA-3′;反向:5′-GCAAATGGCATTCTGACATCC-3′)進行 PCR擴增。PCR產物進行瓊脂糖凝膠電泳,以驗證各蛋白質折疊輔助因子基因的過表達載體是否成功整合至重組酵母菌中。
1.4 Ero1、PDI、BiP 的 Western blot分析
共表達菌株胞內蛋白質提取及誘導表達參照pGAPZ B說明書進行。提取經基因組DNA PCR驗證正確的共表達菌株的胞內蛋白質進行Western blot分析。
由于在構建共表達質粒時,將Ero1、PDI和BiP終止密碼子去除,使得6×His標簽分別與Ero1、PDI和BiP的C端融合表達(圖1)。因此,可利用抗6×His抗體檢測各蛋白質折疊輔助因子是否在重組酵母胞內過量表達。
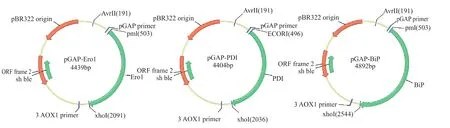
圖1 pGAP-Ero1、pGAP-PDI和pGAP-BiP質粒圖譜Fig.1 Schematic map of pGAP-Ero1,pGAP-PDI and pGAP-BiP plasmids
1.5 共表達 Ero1、PDI和 BiP菌株分泌表達IFNβ-HSA的SDS-PAGE和Western blot分析
接種共表達 Ero1、PDI和 BiP的重組菌株至BMGY培養基培養,收獲菌體后在BMMY培養基中用體積分數2%甲醇誘導表達,將不同誘導時間的發酵液離心后取上清液,進行SDS-PAGE和Western blot分析,并用圖像處理軟件ImageJ對SDS-PAGE結果進行灰度定量,用統計分析軟件SPSS對定量結果進行統計分析。
1.6 共表達重組菌株生長測定
將各共表達菌株和轉化pGAPZ B空載的對照菌株分別接種至YPD液體培養基,200 r/min、30℃振蕩培養24 h,以體積分數1%接種量接種至BMGY培養基,200 r/min、30℃培養,采用比濁法(OD600)測定菌體生長。
2 結果與分析
2.1 共表達Ero1、PDI和BiP酵母菌株的構建及其陽性轉化子的篩選
將線性化的 pGAP-Ero1、pGAP-PDI、pGAP-BiP和空載pGAPZ B電擊轉化GS115-IFNβ-HSA感受態細胞。分別從YPD(含400 μg/mL Zeocin)平板上挑取轉化子若干,以其基因組DNA為模板,進行PCR擴增,結果如圖2所示。
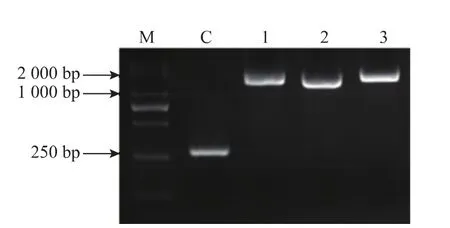
圖2 酵母基因組DNA的PCR鑒定Fig.2 Identification of genome of Pichia pastoris
結果顯示,轉化空載的菌株基因組DNA經擴增后獲得約250 bp的片段 (C泳道);而以轉化pGAP-Ero1、pGAP-PDI和pGAP-BiP菌株的基因組DNA為模板時,PCR擴增產物在約2 000 bp處各有明顯條帶,表明 pGAP-Ero1、pGAP-PDI和pGAP-BiP表達框已成功整合至相應轉化子基因組。
2.2 Ero1、PDI和BiP表達的Western blot分析
為了驗證蛋白質折疊輔助因子 Ero1、PDI和BiP在胞內過量表達,用抗6×His抗體對Ero1、PDI和BiP共表達菌株和對照菌株胞內蛋白質進行了Western blot分析,結果如圖3所示。
對照菌株胞內蛋白質的Western blot雜交沒有出現特異性條帶,而Ero1、PDI和BiP共表達菌株胞內蛋白質Western blot均出現特異性雜交條帶,表明蛋白質折疊因子Ero1、PDI和BiP分別在共表達菌株中被過量表達。Ero1、PDI和BiP蛋白質雜交條帶均比理論分子量略大,Ero1尤其顯著,這可能是由于畢赤酵母的Ero1自身存在糖基化修飾造成的[15]。
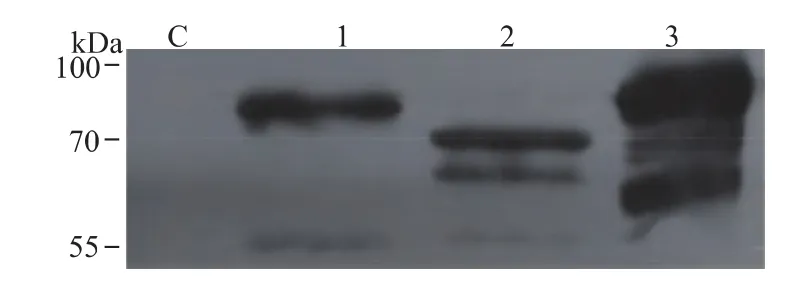
圖3 蛋白質折疊輔助因子Western blot分析Fig.3 Western blot analysis of folding helper factors
2.3 Ero1、PDI、BiP共表達對重組菌株生長的影響
為了分析共表達各種蛋白質折疊輔助因子是否對重組畢赤酵母菌株的生長有不利影響,對共表達Ero1、PDI、BiP的菌株和對照菌株在BMGY培養基中的生長進行了測定,結果如圖4所示。
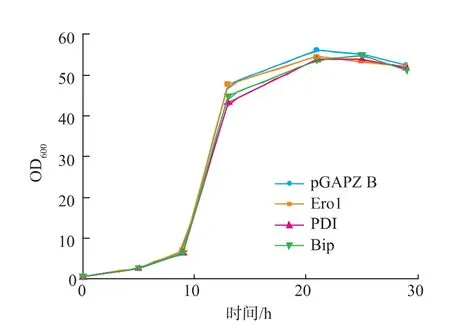
圖4 pGAPZ B、Ero1、PDI及BiP菌株的生長曲線Fig.4 Growth curves of strains co-overexpressing pGAPZ B Ero1,PDI and BiP
結果表明,各種共表達菌株的生長曲線與對照菌株均無明顯差異。各菌株培養約24 h后到達平衡期,此時酵母細胞密度OD600≈50。這說明,共表達Ero1、PDI、BiP 對 IFNβ-HSA 融合蛋白質表達菌株的正常生長沒有影響。
2.4 Ero1、PDI和 BiP共表達對融合蛋白質IFNβ-HSA分泌表達的影響
為了分析共表達Ero1、PDI、BiP是否對融合蛋白質IFNβ-HSA的分泌表達有促進作用,將共表達Ero1、PDI、BiP的菌株和對照菌株分別誘導表達72 h后,離心取上清液,對各個菌株的IFNβ-HSA表達作SDS-PAGE和Western blot分析,并用ImageJ軟件對其表達量作相對定量,結果見圖5。
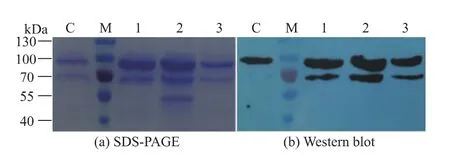
圖5 表達產物IFNβ-HSA的SDS-PAGE和Western blot分析Fig.5 Analysis of the expression of product IFNβ-HSA
由圖5可知,對照菌株和共表達菌株均表達融合蛋白質IFNβ-HSA(分子量約90 kD)。利用SPSS對ImageJ定量結果進行統計分析,結果如表1所示,誘導72 h后,Ero1、PDI和BiP共表達菌株融合蛋白質表達量分別是對照菌株的1.8倍、1.9倍和1.1倍,且具有統計學意義(P≤0.05),表明共表達Ero1和PDI對提高重組畢赤酵母外源蛋白質的表達量具有顯著作用,而共表達BiP對重組畢赤酵母外源蛋白質的表達水平沒有影響。
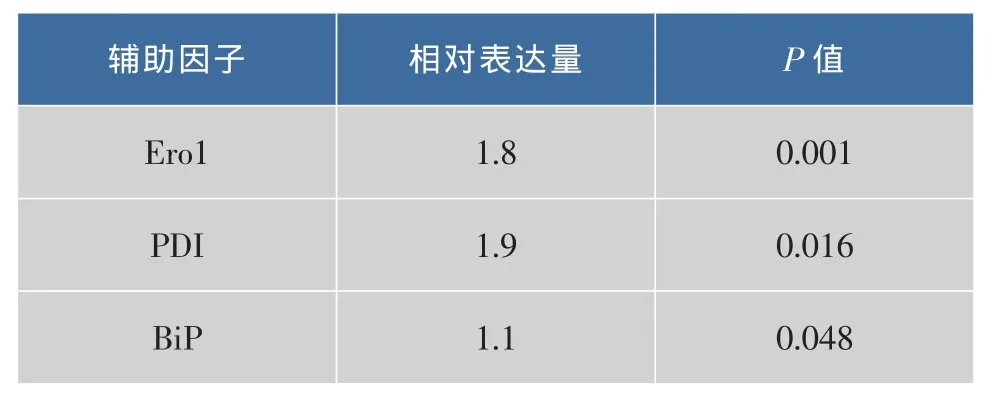
表1 蛋白質輔助折疊因子表達量的統計Table 1 Mean improvements of IFNβ-HSA by coexpression of folding helper factors
見上圖5,共表達PDI時,SDS-PAGE結果顯示,表達產物中還存在一分子量約為50 kDa的條帶,用抗 HSA 抗體作 Western blot分析(圖 5(b))可見,雜交結果顯示此條帶并非表達產物IFNβ-HSA的相關條帶,其具體來源有待進一步研究。
3 結語
本實驗中,通過在GS115-IFNβ-HSA中分別共表達Ero1、PDI和BiP,探索了過量表達內質網中這3種蛋白質折疊輔助因子對外源蛋白質IFNβ-HSA分泌表達的影響。實驗結果表明,Ero1、PDI和BiP成功地在胞內過量表達,且不影響宿主細胞的正常生長。共表達Ero1和PDI的重組菌株,其IFNβ-HSA融合蛋白質表達量有不同程度的提高,分別是對照菌株的1.8倍和1.9倍。這表明二硫鍵的形成過程可能是外源蛋白質IFNβ-HSA分泌表達過程中的限速步驟之一,通過在Pichia pastoris GS115細胞中分別共表達Ero1和PDI,可能促進了融合蛋白質IFNβ-HSA折疊過程中二硫鍵的形成,有助于融合蛋白質在內質網中的折疊加工,從而提高了外源蛋白質IFNβ-HSA的表達量。共表達BiP的重組菌株中,IFNβ-HSA融合蛋白質的表達量與對照組相當,可能過表達BiP加重重組菌株表達外源蛋白質的負擔,使得過多的BiP已不能發揮蛋白質輔助因子的活性。已有的文獻報道顯示,共表達BiP對外源蛋白質表達的影響存在較大差異[16],在某些情況下,共表達BiP對一些外源蛋白質表達沒有顯著影響[17]。因此,組合表達不同的蛋白質折疊輔助因子能否進一步提高目的蛋白質的產量,值得深入研究。
[1]Jonasch E,Haluska F G.Interferon in oncological practice:review of interferon biology,clinical applications and toxicities[J].The Oncologist,2001,6(1):34-55.
[2]Kontsek P.Human type I interferons:Structure and function[J].Acta Virologica,1994,38(6):345-360.
[3]雷楗勇,張蓮芬,楊健良,等.人β干擾素-血清白蛋白融合蛋白在畢赤酵母中的分泌表達[J].中國生物工程,2006(7):6.LEI Jianyong,ZHANG Lianfeng,YANG Jianliang,et al.Secretory expression of the fusion protein IFNβ-HSA in Pichia pastoris[J].China Biotechnology,2006(7):6.(in Chinese)
[4]Nishikawa S I,Fewell S W,Kato Y,et al.Molecular chaperones in the yeast endoplasmic reticulum maintain the solubility of proteins for retrotranslocation and degradation[J].J Cell Biol,2001,153(5):1061-1070.
[5]Otero J H,Lizak B,Hendershot L M.Life and death of a BiP substrate[J].Seminars in Cell&Developmental Biology,2010,21(5):472-478.
[6]Li J,Lee A S.Stress induction of GRP78/BiP and its role in cancer[J].Current Molecular Medicine,2006,6(1):45-54.
[7]Damasceno L M,Anderson K A,Ritter G,et al.Cooverexpression of chaperones for enhanced secretion of a single-chain antibody fragment in Pichia pastoris[J].Applied Microbiology and Biotechnology,2007,74(2):381-389.
[8]VAN DER Heide M,Hollenberg C P,VAN DER Klei I J,et al.Overproduction of BiP negatively affects the secretion of Aspergillus niger glucose oxidase by the yeast Hansenula polymorpha[J].Applied Microbiology and Biotechnology,2002,58(4):487-494.
[9]Steel G J,Fullerton D M,Tyson J R,et al.Coordinated activation of Hsp70 chaperones[J].Science,2004,303(5654):98-101.
[10]關波,金堅,李華鐘.改良畢赤酵母分泌表達外源蛋白能力的研究進展[J].微生物學報,2011,51(7):851-857.GUAN Bo,JIN Jian,LI Huazhong.Genetic engineering of Pichia pastoris expression system for improved secretion of heterologous proteins-a review[J].Acta Microbiologica Sinica,2011,51(7):851-857.(in Chinese)
[11]Wilkinson B,Gilbert H F.Protein disulfide isomerase[J].Biochimica et Biophysica Acta,2004,1699(1-2):35-44.
[12]Tu B P,Weissman J S.The FAD-and O2-Dependent reaction cycle of Ero1-Mediated oxidative protein folding in the endoplasmic reticulum[J].Mol Cell,2002,10(5):983-994.
[13]Sevier C S,Cuozzo J W,Vala A,et al.A flavoprotein oxidase defines a new endoplasmic reticulum pathway for biosynthetic disulphide bond formation[J].Nature Cell Biology,2001,3(10):874-882.
[14]Wu S,Letchworth G J.High efficiency transformation by electroporation of Pichia pastoris pretreated with lithium acetate and dithiothreitol[J].Bio Techniques,2004,36(1):152-154.
[15]Frand A R,Kaiser C A.The ERO1 gene of yeast is required for oxidation of protein dithiols in the endoplasmic reticulum[J].Mol Cell,1998,1(2):161-170.
[16]Smith J D,Tang B C,Robinson A S.Protein disulfide isomerase,but not binding protein,overexpression enhances secretion of a non-disulfide-bonded protein in yeast[J].Biotechnology and Bioengineering,2004,85(3):340-350.
[17]Robinson A S,Bockhaus J A,Voegler A C,et al.Reduction of BiP levels decreases heterologous protein secretion in Saccharomyces cerevisiae[J].J Biol Chem,1996,271(17):10017-10022.

