納米銀凍干粉小鼠經口最大耐受劑量實驗
王醒,江筱莉,周昱薇,陳明祺,呂海,顧寧
(1.東南大學生物科學與醫學工程學院,江蘇南京 210009;2.江蘇省中醫院重癥醫學科,江蘇南京 210029)
在生物醫學領域,納米銀的抗菌性能已為人們逐漸認識和使用。納米銀抗菌譜廣,對G+和G-菌均有良好的抑制作用,同時,納米銀還可以抗病毒和抗其它真核微生物[1-3]。與臨床上其他抗菌劑比較,納米銀不僅是一種廣譜抗菌劑,微量即可發揮殺菌作用,而且它不同于抗生素,不會產生耐藥性,且效力持久,是一種長效的抗菌劑[4-6]。但目前有關納米銀生物安全性評價的研究尚不多見。開展納米銀在動物體內的安全性評價實驗,對促進納米銀材料抗菌導管進入臨床試驗階段具有重要意義。本研究通過對健康小鼠一次性經口灌胃給藥行最大劑量耐受實驗,為納米銀的生物安全應用提供一定的支持和依據。
1 材料與方法
1.1 實驗材料
ICR小鼠40只,體重18~22 g,由揚州大學實驗動物中心提供,合格證號:SCXK(蘇)2012-0004。納米銀凍干粉由東南大學生物科學與醫學工程學院重點實驗室提供,粒徑15~30 nm;臨床成人日用量為1.67μg·kg-1。實驗條件:室溫[(20±2)℃],濕度55% ~65%,光照適度,通風潔凈良好。
1.2 實驗方法
1.2.1 實驗動物分組 將40只ICR小鼠隨機分為實驗組與對照組各20只。實驗組給予納米銀凍干粉6 mg·kg-1,對照組給予等量生理鹽水(NS)。
1.2.2 實驗方法 所有動物實驗前正常飼養,給藥前禁食(不禁水)12 h,實驗組用150μg·ml-1納米銀(最大濃度)灌胃給藥,按0.4 ml·(10 g鼠重)-1灌胃1次。全價營養顆粒飼料飼養2周。
1.2.3 觀察指標 給藥后觀察2周內小鼠行為、外觀、進食、排泄物、有無死亡情況等。2周后處死實驗動物進行尸檢,肉眼觀察各主要臟器(心、肝、脾、肺、腎)有無異常改變,并在電鏡下觀察有無損傷情況。
1.3 統計學處理
2 結 果
2.1 兩組小鼠一般情況
納米銀凍干粉按6 mg·kg-1劑量給實驗組小鼠經口灌胃后,未觀察到動物出現不良反應。小鼠活動未見明顯改變,行為無異常,安靜,無明顯煩躁;皮毛干燥整潔,尿液及糞便正常。攝食量、體重等與對照組比較差異無統計學意義(P>0.05,表1)。兩組動物2周內均未發生死亡。
表1 納米銀灌胃最大給藥量對小鼠一般特征的影響±s)Tab 1 General characteristics of mice after intragastric administration with the maximum dose of nano silver lyophilized powder±s)
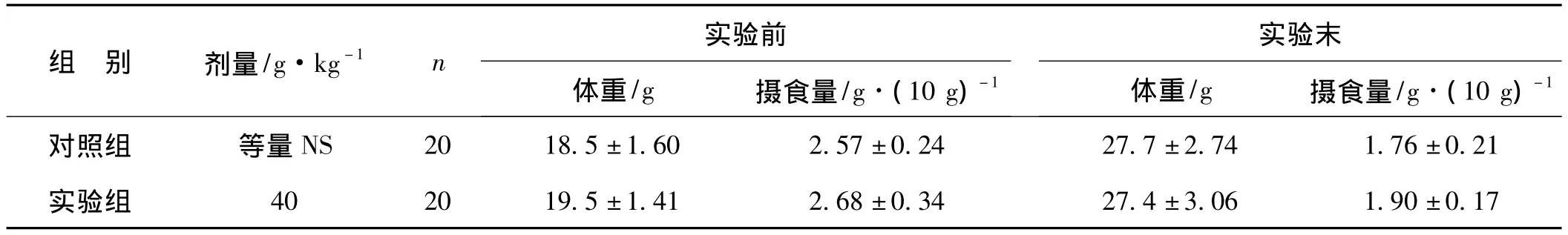
表1 納米銀灌胃最大給藥量對小鼠一般特征的影響±s)Tab 1 General characteristics of mice after intragastric administration with the maximum dose of nano silver lyophilized powder±s)
組 別 劑量/g·kg-1 n 實驗前體重/g 攝食量/g·(10 g)-1實驗末體重/g 攝食量/g·(10 g)-1對照組 等量NS 20 18.5±1.60 2.57±0.24 27.7±2.74 1.76±0.21實驗組 40 20 19.5±1.41 2.68±0.34 27.4±3.06 1.90±0.17
2.2 主要臟器病理改變情況比較
給藥2周后處死兩組小鼠,肉眼觀察兩組小鼠各內臟(心、肝、脾、肺、腎)外形、顏色、質地、大小等均未見異常改變。HE染色后電鏡下觀察兩組小鼠主要臟器切片形態,顯示兩組心、腎、肺、肝、脾均形態結構正常,無明顯細胞凋亡、變性,無納米銀顆粒沉積(圖1)。
3 討 論
隨著納米銀材料在醫療領域應用的日益廣泛,納米銀的生物安全性問題愈加值得關注。納米銀可通過呼吸道、消化道、皮膚暴露等多種途徑進入人體內,與機體相互作用后所產生物質的化學特性、生物活性與化學成分相同的常規物質有很大不同,具有潛在的毒性效應,并成為一些疾病的誘因[7]。以往研究認為,銀尚屬于相對安全的抗菌材料。銀的常規毒性表現為銀中毒,但一般只有當患者存在大面積開放性創傷,且長期使用大劑量的銀離子抗菌劑時才會出現銀離子的蓄積中毒[8]。有關納米銀的體外細胞毒性實驗中發現,當納米銀的濃度和蓄積量達到一定程度,其對細胞的形貌和活性都會產生一定的影響,并且隨著濃度增加而毒性作用進一步增強[9-11]。Asharani等[12]對納米銀的細胞毒理和基因毒理進行了研究,并對納米銀的毒理機制進行了較為詳細的探討,發現:納米銀可以改變細胞形態、細胞的生存能力、代謝活動、氧化過程;納米銀可以減少細胞中ATP的量,造成線粒體的損害,增加活性氧的產物。Asharani等[13]通過斑馬魚模型進一步研究了納米銀在活體中的毒性:魚的精胚和納米銀共孵育一段時間后可發現,納米銀吸附于一些重要器官,如腦部;隨著魚的生長可進一步引起后期的發育缺陷。該研究也在一定程度上證實了納米銀在活體的沉積吸附方式,以及其如何與生物分子相互作用(如蛋白和DNA)。

圖1 電鏡下兩組主要臟器病理形態 4×10 A1~A5為對照組(依次為心、腎、肺、肝、脾),B1~B5為實驗組(依次為心、腎、肺、肝、脾)Fig 1 Comparison of major organs pathological form(4 ×10)A1-A5 for the control group(heart,kidney,lung,liver,spleen),B1-B5 for the experimental group(heart,kidney,lung,liver,spleen)
本研究中,納米銀凍干粉經口灌胃給藥后小鼠未能測出LD50,小鼠經口最大給藥量、最大容積的實驗結果表明:20只小鼠給藥后無明顯毒性反應,2周內亦無死亡。因此,納米銀經口給藥的小鼠最大給藥量為6 mg·kg-1,如按臨床成人1日口服1.67μg·kg-1計算,則該藥的小鼠1日灌胃藥量為臨床成人1日口服量的3 592倍。
本實驗肉眼觀察了兩組小鼠主要臟器外形、顏色、質地、大小等,均未見異常改變;HE染色后電鏡下觀察,兩組小鼠主要臟器切片均形態結構正常,無明顯細胞凋亡、變性,這與目前已進行的大鼠28 d經氣道和經口毒性實驗取得的結果[14-15]相似。Ji等[14]給大鼠吸入納米銀粒子(4~80 nm),結果顯示,大鼠在28 d的體重、器官重量均未發生顯著變化,亦未發現明顯臟器毒性。Kim等[15]用納米銀顆粒(60 nm)進行了大鼠經口毒性實驗,發現各組大鼠28 d體重無明顯變化,未見明顯臟器損害情況,僅在高劑量(300 mg·kg-1)時引起輕度肝損,而該劑量為本實驗小鼠經口給藥劑量的50倍,表明該劑量的納米銀是相對安全的。
然而,納米銀是通過其釋放的銀離子還是自身通過細胞膜進入細胞后與其它亞細胞器反應而產生毒性,目前尚未定論。在設計高效抗菌的納米銀抗菌材料的同時,因其要求抗菌效果實現持久緩慢的特點,更需要注重納米銀的安全性。所以,進一步深入開展納米銀生物安全性方面的研究,有助于推進醫用納米銀抗菌材料的推廣應用。
[1]張宇,葛存旺,虞偉,等.無機納米抗菌劑用于醫用無菌紗布的研究[J].東南大學學報:自然科學版,2001,31(2):11-11.
[2]向冬喜,鄭叢龍.納米抗菌材料抗病毒作用的研究進展[J].中國微生態學雜志,2009,21(8):760-761.
[3]苗迎秋,向冬喜,鄭叢龍.納米銀抗流感病毒H3N2作用的實驗研究[J].山東醫藥,2010,50(16):18-20.
[4]陳美婉,彭新生,吳琳娜,等.納米銀抗菌劑的研究和應用[J].中國消毒學雜志,2009,26(4):424-426.
[5]ALT V,BECHERT T,STEINRUCKE P,et al.An in vitro assessment of the antibacterial properties and cytotoxicity of nanoparticulate silver bone cement[J].Biomaterials,2004,25(18):4383-4391.
[6]JEON H J,YI S C,OH S G.Preparation and antibacterial effects of Ag-SiO2thin films by sol-gel method[J].Biomateri-als,2003,24(27):4921-4928.
[7]孫倩,李明春,馬守棟.納米銀抗菌活性及生物安全性研究進展[J].藥學研究,2013,32(2):103-105.
[8]YOU C,HAN C,WANGX,et al.The progress of silver nanoparticles in the antibacterial mechanism,clinical application and cytotoxicity[J].Mol Biol Rep,2012,39(9):9193-9201.
[9]BRAYDICH-STOLLE L,HUSSAIN S,SCHLAGER J,et al.In vitro cytotoxicity of nanoparticles in mammalian germline stem cells[J].Toxicol Sci,2005,88(2):412-419.
[10]BURD A,KWOK CH,HUNGSC,et al.A comparative study of the cytotoxicity of silver-based dressings in monolayer cell,tissue explant,and animal models[J].Wound Repair Regen,2007,15(1):94-104.
[11]TANGJ,XIONGL,WANGS,et al.Distribution,translocation and accumulation of silver nanoparticles in rats[J].JNanosci Nanotechnol,2009,9(8):4924-4932.
[12]ASHARANI PV,MUN GL K,HANDE M P,et al.Cytotoxicity and genotoxicity of silver nanoparticles in human cells[J].ACSNano,2009,3(2):279-290.
[13]ASHARANI P V,WU Y L,GONG Z Y,et al.Comparison of the toxicity of silver,gold and platinum nanoparticles in developing zebrafish embryos[J].Nanotoxicology,2011,5(1):43-54.
[14]JI JH,JUNG J H,KIM SS,et al.Twenty-eight-day inhalation toxicity study of silver nanoparticles in Sprague-Dawley rats[J].Inhal Toxicol,2007,19(10):857-871.
[15]KIM Y S,KIM J S,CHO H S,et al.Twenty-eight-day oral toxicity,genotoxicity,and gender-related tissue distribution of silver nanoparticles in Sprague-Dawley rats[J].Inhal Toxicol,2008,20(6):575-583.

