MAPK信號通路調控長波紫外線誘導的皮膚成纖維細胞組織蛋白酶K表達
許慶芳 侯巍 鄭躍 劉晨 龔子鑒 陸春 賴維
MAPK信號通路調控長波紫外線誘導的皮膚成纖維細胞組織蛋白酶K表達
許慶芳 侯巍 鄭躍 劉晨 龔子鑒 陸春 賴維
目的研究MAPK信號通路調控長波紫外線(UVA)誘導皮膚成纖維細胞組織蛋白酶K(CatK)的表達。方法原代培養的皮膚成纖維細胞取自兒童包皮。Western印跡檢測10 J/cm2UVA照射前及照射后0.75、1.5、3和6 h皮膚成纖維細胞中磷酸化JNK(p-JNK)、JNK、磷酸化P38(p-P38)、P38蛋白的表達。800 nmol/L SP600125(SP)、10 μmol/L SB203580(SB)分別孵育皮膚成纖維細胞,實驗分為無UVA照射的對照組、SP組、SB組及10 J/cm2UVA照射的對照(UVA)組、UVA-SP組、UVA-SB組。先以Western印跡檢測各組UVA照射后1.5 h磷酸化c-Jun(p-c-Jun)和磷酸化MAPKAPK2(p-MAPKAPK2)表達,再以RT-PCR和Western印跡檢測各組照射后48 h CatK mRNA、蛋白的表達。結果皮膚成纖維細胞在UVA照射后0.75、1.5 h,p-JNK表達的灰度值分別為4.77±0.19和4.68±0.09,p-P38分別為2.44±0.13、2.30±0.04,均較照射前(p-JNK為3.2±0.27,p-P38為1.61±0.08)顯著升高(均P<0.05);而在照射后3、6 h的表達與照射前相比差異無統計學意義(P>0.05)。p-c-Jun在UVA-SP組表達(2.55±0.48)、p-MAPKAPK2在UVA-SB組表達(1.16±0.12)均顯著低于UVA組(分別為4.85±0.96和2.46±0.09),均P<0.05。UVA-SP組、UVA-SB組CatK mRNA、蛋白的表達分別降為UVA組的38.9%、28.7%和55.7%、49.6%(P<0.05),UVA-SP組CatK mRNA、蛋白的表達也均顯著低于UVA-SB組(P<0.05)。結論JNK和P38信號通路在調控UVA上調的皮膚成纖維細胞CatK表達中起重要作用。
成纖維細胞;組織蛋白酶類;MAP激酶信號系統;紫外線;皮膚衰老
皮膚光老化最具特征性的病理改變為變性彈性纖維在真皮中上層的堆積,即光線性彈性組織變性。其形成機制包括彈性纖維變性機制和堆積機制[1]。組織蛋白酶K(cathepsin K,CatK)屬于溶酶體內半胱氨酸蛋白酶家族的成員之一,是皮膚成纖維細胞內降解彈性蛋白的主要蛋白酶,在光線性彈性組織變性中起重要作用[2]。我們的前期研究已揭示,長波紫外線(UVA)促進皮膚成纖維細胞中CatK表達[3]。然而,調控UVA誘導皮膚成纖維細胞中CatK表達的機制目前還不清楚。UVA主要激活皮膚成纖維細胞的絲裂原激活蛋白激酶(mitogen-activated protein kinases,MAPK)通路。本實驗檢測UVA對皮膚成纖維細胞JNK和P38通路的影響,并以SP600125和SB203580分別抑制JNK和P38通路,再采取RTPCR和Western印跡檢測JNK和P38通路的抑制對UVA誘導的CatK表達的影響,以研究MAPK信號通路是否調控UVA誘導的皮膚成纖維細胞中CatK表達。
材料與方法
一、實驗材料
1.皮膚成纖維細胞的組織來源:健康人皮膚組織來自于中山大學附屬第三醫院泌尿外科健康兒童包皮環切術后的包皮組織,年齡5~9歲。本研究經中山大學附屬第三醫院倫理委員會批準。
2.試劑和儀器:DMEM(Dulbecco's modified Eagle's media)高糖培養基、胰酶、胎牛血清、磷酸鹽緩沖液(PBS)、青鏈霉素為美國Gibco公司產品。SP600125(SP)、SB203580(SB)為德國默克公司產品。一抗兔抗人CatK-IgG抗體為美國Abcam公司產品;一抗兔抗人磷酸化JNK(p-JNK)、兔抗人JNK、兔抗人磷酸化c-Jun(p-c-Jun)、兔抗人磷酸化P38(p-P38)、兔抗人 P38、兔抗人磷酸化MAPKAPK2(p-MAPKAPK2)、內參兔抗人GAPDH多克隆IgG抗體及二抗HRP-羊抗兔IgG均為美國Cell signaling technology公司產品。BCA蛋白定量試劑盒為美國Pierce公司產品。ECL顯色試劑盒為美國Millipore公司產品,預染Marker為加拿大Mbi fermentas公司產品。總RNA提取試劑Trizol為美國Invitrogen公司產品。Primescript RT master mix逆轉錄試劑盒和Sybrpremix ex taqTm試劑盒為日本Takara公司產品。UVA紫外線輻射儀(Sigma ss-03A)和UVA輻照計(Sigma ss-03)均由上海希格瑪高科技有限公司生產,燈管為Philips UVA TL10RS,波長320~400 nm;酶聯免疫檢測儀(美國Biotek公司);CO2細胞培養箱(美國Thermo scientific公司);Abi prism 7500型實時熒光定量PCR儀。
二、方法
1.原代皮膚成纖維細胞培養:取兒童包皮,參照文獻[3]分離培養皮膚成纖維細胞,第3代細胞凍存。細胞復蘇后10代以內的細胞行后續實驗。
2.UVA照射后不同時間皮膚成纖維細胞p-JNK、JNK、p-P38、P38蛋白表達的變化:將3~10代的成纖維細胞按106接種于6 cm細胞培養皿,培養24 h至80%~90%匯合時取出,吸棄培養液,用PBS洗2次,每皿加入等量的薄層PBS。按照文獻[3]的方法,把培養皿置于UVA紫外線輻射儀下,距離紫外光源約15 cm,平均照射功率為13 mW/cm2,照射769 s,使照射1次的UVA劑量達10 J/cm2。照射后立即吸棄PBS,加入新鮮培養液,置于95%濕度、5%CO237 ℃培養箱中培養。在照射后 0、0.75、1.5、3、6 h提取蛋白,Western印跡檢測各時間點p-JNK、JNK、p-P38、P38蛋白表達的變化。實驗重復3次。
3.SP、SB對UVA照射的皮膚成纖維細胞p-MAPKAPK2、p-c-Jun 表達的影響:10 μmol/L SB 工作濃度的選擇參照生產廠家推薦及文獻[4]。參照文獻[4],采用CCK8和Western印跡篩選出800 nmol/L SP可抑制UVA激活的JNK通路。實驗設無UVA照射的對照組、800 nmol/L SP 的 SP 組、10 μmol/L SB的SB組及10 J/cm2UVA照射的UVA組、800 nmol/L SP的UVA-SP組、10 μmol/L SB的UVA-SB組。 將細胞從培養箱中取出,向培養皿中分別加入SP、SB(終濃度分別為 800 nmol/L、10 μmol/L)孵育 1 h,吸棄培養液,用PBS洗2次,每皿加入等量的薄層PBS,予 10 J/cm2UVA照射1次,再在含SP、SB的培養基中孵育1.5 h,提取細胞蛋白,最后以Western印跡對比檢測p-MAPKAPK2、p-c-Jun在各組的表達變化。實驗重復3次。
4.SP、SB對UVA照射的皮膚成纖維細胞CatK表達的影響:按以上方法分組,照射前SP和SB分別孵育細胞及UVA照射后再在含SP、SB的培養基中孵育48 h,提取RNA和蛋白,最后以RT-PCR和Western印跡對比檢測各組CatK的表達變化。實驗重復3次。
5.RT-PCR檢測皮膚成纖維細胞中CatK mRNA的表達變化:按照Trizol試劑盒的方法提取總RNA。按逆轉錄試劑盒說明書配制逆轉錄反應體系,總體積20 μl,37℃下反轉錄15 min,85℃下5 s使反轉錄酶失活,即獲得cDNA,置-20℃冰箱中保存。采用染料法(SYBR Green I)進行相對定量分析。PCR反應體系共20 μl,包括SYBR? Premix Ex TaqⅡ 10 μl,ROXDyeⅡ 0.4 μl,雙蒸水 6 μl,上下游引物各 0.8 μl和 cDNA 2 μl。 兩步法實時定量PCR:95℃5 s,1個循環;95℃5 s,60℃30 s,40個循環。CatK上游引物序列5'-GTCTGAGAATGATGG CTGTGGA-3',下游5'-CATTTAGCTGCCTTGCCTGT TG-3',擴增片段長度150 bp。GAPDH上游引物序列5'-GCACCGTCAAGGCTGAGAAC-3',下游5'-TGGTGAAGACGCCAGTGGA-3',擴增片段長度138 bp。在實時熒光定量PCR儀上讀取擴增曲線、熔解曲線和Ct值。重復3次實驗,結果取均值,用2-ΔΔCt法計算目的基因和內參基因的表達相對值。
6.Western印跡檢測皮膚成纖維細胞中CatK、p-JNK、JNK、p-P38、P38、p-MAPKAPK2、p-c-Jun 蛋白的表達變化:提取各組細胞總蛋白-80℃保存。BCA法蛋白定量。總蛋白經12%SDS-PAGE分離后,電轉移到PVDF膜上。一抗兔抗人CatK-IgG(滴度 1∶500)、兔抗人 p-JNK-IgG(滴度 1∶1 000)、兔抗人JNK-IgG(滴度1∶1 000)、兔抗人p-P38(滴度1∶1 000)、兔抗人 P38(滴度 1∶1 000)、兔抗人 p-MAPKAPK2(滴度1∶1 000)、兔抗人p-c-Jun(滴度1∶1 000),內參兔抗人GAPDH-IgG(滴度1∶4 000),4℃孵育過夜,TBST液洗膜,加入HRP-羊抗兔IgG(滴度1∶1 000)37℃ 孵育1 h,TBST液洗膜。ECL顯色。所有實驗重復3次。
結 果
一、皮膚成纖維細胞中 p-JNK、JNK、p-P38、P38蛋白的表達隨UVA照射后不同時間的變化
見圖 1、表 1。UVA 照射后 0、0.75、1.5、3、6 h,各組p-JNK、p-P38灰度值經單因素方差分析,差異均有統計學意義(P<0.05)。LSD-t檢驗發現,p-JNK、p-P38在照射后0.75、1.5 h的表達均明顯高于0 h(P<0.05),在3、6 h的表達與0 h相比差異均無統計學意義(P>0.05)。JNK、P38蛋白表達在各時間點變化無明顯差異。
二、SP、SB對UVA激活的皮膚成纖維細胞JNK和P38信號通路的影響
見圖 2、表 2。 p-c-Jun、p-MAPKAPK2在各組的灰度值經單因素方差分析,差異均有統計學意義(P<0.01)。LSD-t檢驗發現,UVA組和UVA-SB組p-c-Jun表達差異無統計學意義(P>0.05),但UVASP組明顯低于UVA組(P<0.05);UVA組與UVASP組p-MAPKAPK2的表達差異無統計學意義(P>0.05),但UVA-SB組明顯低于UVA組(P<0.01)。

圖1 皮膚成纖維細胞中p-JNK、JNK、p-P38、P38表達隨UVA照射后不同時間變化的電泳圖 1~5:分別為UVA照射后0、0.75、1.5、3、6 h組。p-JNK、p-P38在UVA 照射后0.75、1.5 h均較0 h顯著升高,后恢復至0 h水平,而JNK、P38在各時間點表達無顯著差異
表1 UVA照射皮膚成纖維細胞后不同時間p-JNK、JNK、p-P38、P38蛋白表達變化(灰度值,±s)
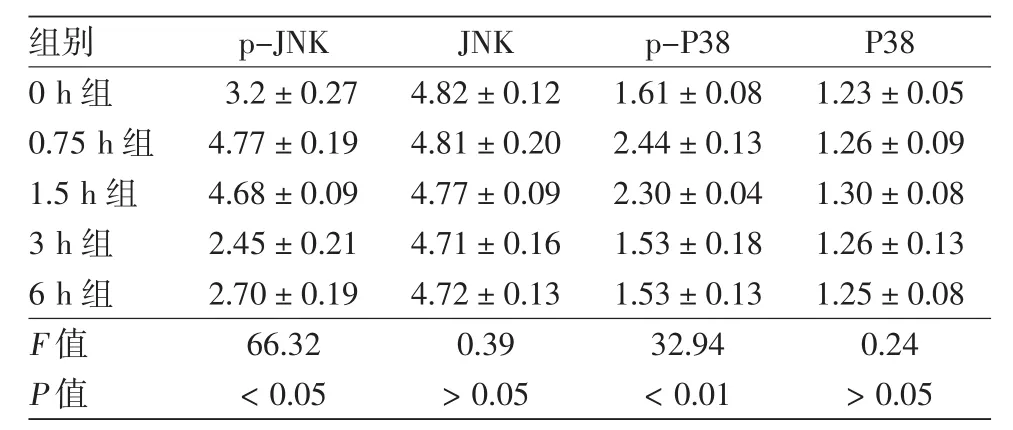
表1 UVA照射皮膚成纖維細胞后不同時間p-JNK、JNK、p-P38、P38蛋白表達變化(灰度值,±s)
注:n=3
p-JNK JNK p-P38 P38 3.2±0.27 4.82±0.12 1.61±0.08 1.23±0.05 4.77±0.19 4.81±0.20 2.44±0.13 1.26±0.09 1.5 h組 4.68±0.09 4.77±0.09 2.30±0.04 1.30±0.08 3 h組 2.45±0.21 4.71±0.16 1.53±0.18 1.26±0.13 6 h組 2.70±0.19 4.72±0.13 1.53±0.13 1.25±0.08 F值 66.32 0.39 32.94 0.24 P值 <0.05 >0.05 <0.01 >0.05

圖2 SP600125、SB203580抑制UVA激活的皮膚成纖維細胞JNK和P38信號通路的電泳圖 1:對照組;2:SP組;3:SB組;4:UVA組;5:UVA-SP組;6:UVA-SB組。p-c-Jun在UVA-SP組、p-MAPKAPK2在UVA-SB組的表達均顯著低于UVA組
表2 SP、SB對UVA激活的皮膚成纖維細胞JNK和P38信號通路及CatK表達的影響(±s)

表2 SP、SB對UVA激活的皮膚成纖維細胞JNK和P38信號通路及CatK表達的影響(±s)
注:n=3
組別 p-c-Jun(灰度值)CatK蛋白(灰度值)對照組 1.63±0.17 1.03±0.13 0.172±0.012 1.58±0.24 SP組 1.46±0.38 1.02±0.18 0.170±0.013 1.57±0.26 SB組 1.48±0.33 0.36±0.08 0.110±0.010 1.02±0.32 UVA組 4.85±0.96 2.46±0.09 0.517±0.030 2.68±0.36 UVA-SP組 2.55±0.48 2.45±0.09 0.201±0.026 0.77±0.10 UVA-SB組 4.61±0.71 1.16±0.12 0.288±0.037 1.33±0.44 F值 23.29 157.43 146.66 14.14 P值 <0.01 <0.01 <0.01 <0.01 p-MAPKAPK2(灰度值)CatK mRNA(2-ΔΔCt)

圖3 SP、SB對UVA誘導的皮膚成纖維細胞CatK蛋白表達影響的電泳圖 1:對照組;2:SP組;3:SB組;4:UVA組;5:UVASP組;6:UVA-SB組。UVA組CatK蛋白表達顯著高于對照組,UVA-SP組、UVA-SB組的蛋白表達均顯著低于UVA組,在UVASP組的蛋白表達顯著低于UVA-SB組
三、SP、SB對 UVA誘導的皮膚成纖維細胞CatK表達的影響
見表2、圖3。Western印跡可檢測到CatK酶原和活性CatK兩個條帶。CatK mRNA表達及CatK蛋白灰度值6組比較,差異均有統計學意義。LSD-t檢驗發現,UVA組CatK mRNA、蛋白表達均顯著高于對照組(P<0.05);UVA-SP組、UVA-SB組CatK mRNA、蛋白表達均顯著低于UVA組(P<0.05),且UVA-SP組CatK表達均顯著低于UVA-SB組(P<0.05)。
討 論
組織蛋白酶K屬于溶酶體內半胱氨酸蛋白酶家族的成員,是目前最強的降解彈性蛋白和膠原蛋白的酶[5]。最近研究發現,CatK是皮膚成纖維細胞內降解彈性蛋白的主要蛋白酶。光老化皮膚及皮膚成纖維細胞中CatK表達和活性降低,使得胞內彈性蛋白降解減少,從而在光老化病變彈性纖維堆積中起作用[6]。然而,我們的前期研究揭示,急性UVA照射促進皮膚成纖維細胞中CatK表達[3]。目前調控UVA誘導的光老化皮膚成纖維細胞中CatK表達的機制還不清楚。 UVA可激活皮膚成纖維細胞的絲裂原激活蛋白激酶(mitogen-activated protein kinases,MAPK) 通路、NF-κB通路及PI3K-AKT通路等,但主要為MAPK通路[7]。有研究報道,MAPK通路調控CatK在其他細胞的表達[8],所以我們研究該信號通路是否也調控UVA上調的皮膚成纖維細胞中CatK表達。
MAPK通路主要包含JNK、P38和ERK三條通路,而UVA只激活前兩者[4]。本研究發現,皮膚成纖維細胞中的p-JNK、p-P38在UVA照射后0.75、1.5 h均較0 h顯著升高,后恢復至0 h水平,說明本實驗所用10 J/cm2UVA可激活皮膚成纖維細胞JNK和P38通路。JNK和P38通路的活化分別磷酸化下游的 c-Jun 和 MAPKAPK2[4]。 SP600125 和 SB203580分別是JNK和P38通路的高選擇性抑制劑,它們對這兩條通路的抑制分別表現為下調p-c-Jun、p-MAPKAPK2 表達[9-10],所以我們以 Western 印跡檢測 SP、SB對 UVA照射的皮膚成纖維細胞 p-MAPKAPK2、p-c-Jun表達的影響,以研究800 nmol/L SP和10 μmol/L SB能否分別特異性地抑制UVA激活的JNK和P38通路。10 μmol/L SB工作濃度的選擇參照文獻[4,11]。 因 UVA 照射 SP 孵育的 HaCaT細胞可導致細胞凋亡,所以我們采用CCK8和Western印跡實驗篩選出 800 nmol/L SP既可保持成纖維細胞活性在90%以上,也可抑制UVA激活的JNK通路[12]。Western印跡結果顯示,p-c-Jun在UVA-SP組表達顯著低于UVA組、p-MAPKAPK2在UVA-SB組的表達顯著低于UVA組,表明本實驗采用800 nmol/L SP和10 μmol/L SB可分別抑制UVA活化的JNK和P38通路。
我們采用RT-PCR、Western印跡觀察以SP和SB分別抑制JNK和P38通路活化對UVA上調的皮膚成纖維細胞CatK表達的影響,結果發現,UVA組CatK mRNA、蛋白的表達顯著高于對照組,表明UVA促進皮膚成纖維細胞CatK表達。UVA-SP組、UVA-SB組CatK mRNA、蛋白表達均顯著低于UVA組,且UVA-SP組CatK mRNA、蛋白表達均顯著低于UVA-SB組,提示JNK和P38通路的抑制均可從基因、蛋白水平降低UVA誘導的CatK表達,前者對UVA誘導的CatK表達的抑制程度高于后者。由此我們推測,UVA很可能通過激活JNK和P38通路、且以前者為主刺激皮膚成纖維細胞CatK的表達。這與調控CatK在其他細胞表達的信號通路相似。在巨噬細胞中,其表面沉積的膽固醇通過活化P38MAPK刺激CatK的表達[13];在血管內皮細胞中,腫瘤壞死因子α通過激活JNK通路促進CatK的表達[14];在關節軟骨細胞中,Ⅱ型膠原的N-端肽通過激活蛋白激酶C和P38MAPK通路上調CatK的表達[15]。
已有研究揭示,UVA通過激活MAPK通路上調AP-1的轉錄活性,活化的AP-1與基質金屬蛋白酶(matrix metalloproteinases,MMP)啟動子結合,使得啟動子被反式激活而導致MMP的表達上調[16]。由此可見,UVA誘導皮膚成纖維細胞MMP和CatK表達的調控途徑有類似的地方,UVA很可能也通過激活MAPK/AP-1通路上調CatK表達。然而,CatK表達在急性UVA照射的皮膚成纖維細胞中增加,在光老化皮膚及皮膚成纖維細胞中卻下降。我們推測這可能由于光老化的皮膚成纖維細胞CatK的啟動子結構或功能因紫外線損傷發生改變,使之不能與AP-1很好結合,抑或不能啟動CatK基因的轉錄;也可能因光老化皮膚成纖維細胞線粒體突變、DNA損傷及降低的細胞新陳代謝等致CatK基因轉錄、翻譯下降。至于UVA照射早期皮膚成纖維細胞表達上調的CatK在光老化過程中如何降低及其確切機制,尚需進一步研究。
[1]許慶芳,賴維,鄭躍.光線性彈性組織變性形成機制的研究進展[J].國際皮膚性病學雜志,2012,38(1):45-47.
[2]Codriansky KA,Quintanilla-Dieck MJ,Gan S,et al.Intracellular degradation of elastin by cathepsin K in skin fibroblasts--a possible role in photoaging[J].Photochem Photobiol,2009,85(6):1356-1363.
[3]許慶芳,侯巍,劉晨,等.UVA照射對皮膚成纖維細胞組織蛋白酶K表達的影響[J].中華皮膚科雜志,2013,46(9):652.
[4]Silvers AL,Bachelor MA,Bowden GT.The role of JNK and p38 MAPK activities in UVA-induced signaling pathways leading to AP-1 activation and c-Fos expression[J].Neoplasia,2003,5(4):319-329.
[5]Rünger TM,Quintanilla-Dieck MJ,Bhawan J.Role of cathepsin K in the turnover of the dermal extracellar matrix during scar formation[J].J Invest Dermatol,2007,127(2):293-297.
[6]Zheng Y,Lai W,Wan M,et al.Expression of cathepsins in human skin photoaging [J].Skin Pharmacol Physiol,2011,24(1):10-21.
[7]Zheng J,Lai W,Zhu G,et al.10-Hydroxy-2-decenoic acid prevents ultravioletA-induced damage and matrix metalloproteinases expression in human dermal fibroblasts[J].J Eur Acad Dermatol Venereol,2013,27(10):1269-1277.
[8]Matsumoto M,Kogawa M,Wada S,et al.Essential role of p38 mitogen-activated protein kinase in cathepsin K gene expression during osteoclastogenesis through association of NFATc1 and PU.1[J].J Biol Chem,2004,279(44):45969-45979.
[9]Bennett BL,Sasaki DT,Murray BW,et al.SP600125,an anthrapyrazolone inhibitor of jun N-terminal kinase[J].Proc Natl Acad Sci USA,2001,98(24):13681-13686.
[10]Kumar S,Jiang MS,Adams JL,et al.Pyridinylimidazole compound SB 203580 inhibits the activity but not the activation of p38 mitogen-activated protein kinase [J].Biochem Biophys Res Commun,1999,263(3):825-831.
[11]Schieke S,Stege H,Kürten V,et al.Infrared-A radiation-induced matrix metalloproteinase 1 expression ismediated through extracellular signal-regulated kinase 1/2 activation in human dermal fibroblasts[J].J Invest Dermatol,2002,119(6):1323-1329.
[12]許慶芳,侯巍,鄭躍,等.SP600125抑制UVA激活皮膚成纖維細胞JNK通路的最佳濃度[J].中山大學學報(醫學科學版),2014,35(2):194-199.
[13]Sun Y,Ishibashi M,Seimon T,et al.Free cholesterol accumulation in macrophage membranes activates Toll-like receptors and p38 mitogen-activated protein kinase and induces cathepsin K[J].Circ Res,2009,104(4):455-465.
[14]Keegan PM,Wilder CL,Platt MO.Tumor necrosis factor alpha stimulates cathepsin K and V activity via juxtacrine monocyteendothelial cell signaling and JNK activation [J].Mol Cell Biochem,2012,367(1-2):65-72.
[15]Ruettger A,Schueler S,Mollenhauer JA,et al.Cathepsins B,K and L are regulated by a defined collagen typeⅡpeptide via activation of classical protein kinase C and p38 MAP kinase in articular chondrocytes[J].J Biol Chem,2008,283(2):1043-1051.
[16]Hwang YP,Oh KN,Yun HJ,et al.The flavonoids apigenin and luteolin suppress ultraviolet A-induced matrix metalloproteinase-1 expression via MAPKs and AP-1-dependent signaling in HaCaT cells[J].J Dermatol Sci,2011,61(1):23-31.
MAPK pathway regulates ultraviolet A-induced cathepsin K expression in human dermal fibroblasts
Xu Qingfang,Hou Wei,Zheng Yue,Liu Chen,Gong Zijian,Lu Chun,Lai Wei.Department of Dermatology,Third Affiliated Hospital,Sun Yat-sen University,Guangzhou 510630,China
Lai Wei:Email:drlaiwei@163.com
Objective To investigate whether ultraviolet A(UVA)-induced CatK expression is regulated by the mitogen-activated protein kinases(MAPK)signaling pathway in human dermal fibroblastsin vitro.Methods Human dermal fibroblasts were obtained from circumcised foreskin of children,and subjected to primary culture.After several passages of subculture,some fibroblasts were irradiated with UVA at a dose of 10 J/cm2.Western blot was performed to measure the expressions of total and phosphorylated JNK(t-and p-JNK)and P38(t-and p-P38)at 0.75,1.5,3 and 6 hours after the irradiation.Some fibroblasts were divided into six groups:control group receiving no treatment,SP group treated with SP600125 of 800 nmol/L,SB group treated with SB203580 of 10 μmol/L,UVA group irradiated with UVA at a dose of 10 J/cm2,UVA-SP group treated with SP600125 for 1 hour before and for 1.5 or 48 hours after UVA irradiation at 10 J/cm2,UVA-SB group treated with SB203580 for 1 hour before and for 1.5 or 48 hours after UVA radiation at 10 J/cm2.Subsequently,Western blot was performed to determine the expressions of p-c-Jun and p-MAPKAPK2 in these groups at 1.5 hours after the UVA irradiation,and reverse transcription(RT)-PCR and Western blot to detect the mRNA and protein expressions of CatK at 48 hours after the UVA irradiation,respectively.Statistical analysis was carried out byttest,one way analysis of variance and least significant difference(LSD)-ttest.Results The expression levels(gray values)of p-JNK and p-P38 were significantly increased at 0.75 hour(4.77±0.19 and 2.44±0.13 respectively,bothP<0.05)and 1.5 hours(4.68±0.09 and 2.30±0.04 respectively,bothP<0.05),but showed no significant changes at 3 hours(bothP>0.05)and 6 hours(bothP>0.05)after the UVA irradiation compared with those before the irradiation(3.2±0.27 and 1.61±0.08 respectively).A significant decrease was observed in the expression of p-c-Jun in the UVA-SP group and p-MAPKAPK2 in the UVA-SB group compared with the UVA group(p-c-Jun,2.55±0.48 vs.4.85±0.96;p-MAPKAPK2,1.16 ± 0.12 vs.2.46 ± 0.09,bothP< 0.05).The CatK mRNA and protein expressions were attenuated by 61.1%and 44.3%respectively in the UVA-SP group(bothP< 0.05),and by 71.3%and 50.4%respectively in the UVA-SB group(bothP<0.05)in comparison with the UVA group.The UVA-SP group also showed a significant reduction in CatK mRNA and protein expressions as compared with the UVA-SB group(bothP< 0.05).Conclusion Both JNK and P38 signaling pathways,especially the JNK pathway,may contribute to the upregulation of CatK expression in dermal fibroblasts induced by UVA irradiation.
Fibroblasts;Cathepsins;MAP kinase signaling system;Ultraviolet rays;Skin aging
10.3760/cma.j.issn.0412-4030.2014.08.003
國家自然科學基金(81171523);廣東省自然科學基金(10151008901000117);廣東省科技計劃項目基金(2012B031800057);2010年中國醫師協會-寶潔基金;2011年中國醫師協會-資生堂DQ基金
510630廣州,中山大學附屬第三醫院皮膚科
賴維,Email:drlaiwei@163.com
2013-09-30)
(本文編輯:顏艷)

